APROFUNDAMENTO – QUÍMICA – 2012
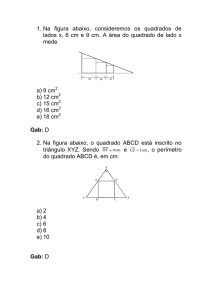
LISTA 8 – pH, pOH, Indicadores Ácido/Base,
Conceitos Modernos de ácido/base, Reações
Inorgânicas e química descritiva.
descritiva
Questão 01) O sulfato de amônio é um composto muito
utilizado como fertilizante. Uma das maneiras de produziproduzi
lo é por meio da reação entre ácido sulfúrico e amônia,
conforme o esquema a seguir:
a)
b)
Questão 03) Assinale o que for correto.
01. Enquanto a definição de Arrhenius para ácido e base
adapta-se
se somente em meio aquoso, a de Brönsted e
Lowry estende-se
se para qualquer meio.
02. Em solução aquosa ácida, enquanto Arrhenius sugere a
existência de um próton H+(aq), Brönsted e Lowry
sugerem que esse próton esteja ligado a uma molécula de
água, formando o íon H3O+(aq).
04. O ácido sulfúrico é um líquido incolor, um pouco viscoso
e é um poderoso agente desidratante.
08. O hidróxido de magnésio é uma dibase usada
comercialmente para a produção de leite de magnésia
(laxante e antiácido
cido estomacal).
16. O calcáreo entra em efervescência, quando colocado em
uma solução ácida, porque a reação entre ele e o ácido
libera CaO gasoso.
01.
02.
04.
08.
16.
Questão 04) Comparando-se
Comparando os conceitos ácido-base de
Arrhenius (A), Brönsted-Lowry
Lowry (BL) e Lewis (L), pode-se
pod
dizer, por exemplo, que uma substância que é um ácido de
Arrhenius será obrigatoriamente um ácido de BrönstedBrönsted
Lowry e também de Lewis. Por outro lado, um ácido de
Brönsted-Lowry
Lowry não será necessariamente um ácido de
Arrhenius. Arranjando esses conceitos
conceit em um diagrama de
conjuntos, assinale o que for correto.
L ⊂ BL e BL ⊃ A.
A ⊂ L e BL ⊂ A.
BL ⊂ L e L ⊃ A.
L ⊃ BL e BL ⊃ A.
A ⊂ BL e BL ⊂ L.
00.
01.
02.
03.
04.
Questão 05) No mesmo ano (1923) em que uma definição
para ácidos e bases, mais abrangente do que a de
Arrhenius, era proposta por Brönsted e Lowry, um novo
conceito foi elaborado por Lewis, fundamentado na teoria
eletrônica da valência. De acordo com a interpretação de
d
Lewis, uma base é qualquer substância contendo um par
de elétrons que possa ser doado para formar uma ligação
covalente coordenada, e um ácido, qualquer substância que
possa aceitar um par de elétrons para formar tal ligação.
A partir dessa informação podemos
po
classificar como
exemplo da definição do comportamento ácido-base
ácido
de
Lewis, a reação:
Ni + 4 CO → Ni(CO)4
Ag+ + 2 NH3 → Ag(NH3)2+
BF3 + NH3 → H3NBF3
Cl + AlCl3 → AlCl4
Co + 2 H+ → Co2+ + H2
Considerando-se o exposto,
escreva a equação da reação que ocorre no balão, após a
abertura da torneira, representando produtos e reagentes
em fase aquosa;
escreva o par ácido-base
base conjugado presente na reação.
Questão 02)
A sibutramina, cuja estrutura está
representada, é um fármaco indicado para o tratamento da
obesidade e seu uso deve estar
star associado a uma dieta e
exercícios físicos.
N
Cl
sibutramina
a)
b)
c)
d)
e)
Com base nessa estrutura, pode-se
se afirmar que a
sibutramina:
é uma base de Lewis, porque possui um átomo de
nitrogênio que pode doar um par de elétrons para ácidos.
é um ácido de Brönsted-Lowry,
Lowry, porque possui um átomo
de nitrogênio terciário.
é um ácido de Lewis, porque possui um átomo de
nitrogênio capaz de receber um par de elétrons de um
ácido.
é um ácido de Arrhenius, porque possui um átomo de
nitrogênio capaz de doar próton.
é uma base de Lewis, porque possui um átomo de
nitrogênio que pode receber um par de elétrons de um
ácido.
Questão 06) Com base na definição de ácido-base de
Brönsted-Lowry,
Lowry, analise os grupos funcionais que
representam os compostos orgânicos listados a seguir:
ésteres, haletos orgânicos, cetonas, fenóis, álcoois e
aminas.
a)
b)
c)
d)
e)
Assinale a alternativa CORRETA:
O caráter básico é observado apenas nas aminas.
O caráter básico é observado em aminas e fenóis.
O caráter básico é observado em ésteres, haletos orgânicos
e cetonas.
O caráter básico é observado em fenóis, álcoois e ésteres.
O caráter básico é observado em haletos orgânicos e
álcoois .
Questão 07) O íon hidrogênio, H+, existe somente na fase
gasosa e a altas temperaturas. Em outras condições, o
campo elétrico intensamente concentrado do próton
isolado assegura que ele vai interagir fortemente com
outros átomos na sua vizinhança, aderindo a moléculas ou
a íons contendo tais átomos. A competição entre diferentes
espécies químicas por íons hidrogênio tem significado
relevante na formulação dos conceitos de Brönsted e
Lowry para ácido e base, em meio aquoso. O modelo por
eles proposto é consistente com as seguintes afirmações:
00. ácidos e bases existem como pares conjugados, cujas
fórmulas estão relacionadas pelo ganho ou perda de um
íon hidrogênio, H+.
01. a teoria de Brönsted e Lowry explica a relação entre a
força de um ácido e a de sua base conjugada.
02. nas reações ácido-base, a água aceita íons H+ dos ácidos
para formar uma base.
03. a teoria de Brönsted e Lowry pode ser expandida para
incluir outros solventes, além da água, e reações que
ocorrem nas fases gasosa ou líquida.
04. ácidos e bases fortes parecem ter a mesma força quando
dissolvidos em água.
H2O. A respeito dessas substâncias, são feitas as seguintes
afirmações:
I.
Quando dissolvidos em água, os gases CO2, SO2, SO3 e
HCl geram soluções eletrolíticas cujo pH é menor que 7.
II. As moléculas de CO2, SO2 e H2O apresentam geometria
linear.
III. No estado sólido, as moléculas de CO2 encontram-se
atraídas entre si por ligações de hidrogênio muito intensas.
É correto o que se afirma em:
a) I, apenas.
b) II, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
Questão 10) Nas diversas formas de culturas agrícolas
praticadas no estado de Mato Grosso, como por exemplo a
soja, o milho, o algodão e o arroz, necessitam-se de
condições ideais do solo para cada uma delas. Para isso,
faz-se necessário corrigir o pH (potencial hidrogeniônico)
do solo, com vistas a se obter boa produtividade.
Considerando-se, por exemplo, que um solo ideal para a
cultura da soja necessite de um pH=5,0, este solo possuirá
uma concentração de íons Hidrogênio (H+) e pOH,
respectivamente iguais a:
a)
b)
c)
d)
e)
H+ = 5. 10 -1 mol/litro e pOH = 9,0
H+ = 1. 10 -5 mol/litro e pOH = 5,0
H+ = 1. 10 -9 mol/litro e pOH = 9,0
H+ = 5. 10 -5 mol/litro e pOH = 14,0
H+ = 1. 10 -5 mol/litro e pOH = 9,0
a)
b)
c)
d)
e)
Questão 11)
As águas de alguns poços possuem quantidades
significantes de íons Ca2+ e Mg2+, que são removidos no
processo de tratamento. Os íons Ca2+ são precipitados
como fosfatos e como carbonatos e os íons Mg2+ são
precipitados como hidróxido de magnésio. Após as
precipitações, os sólidos são removidos por filtração e o
pH da água é ajustado para próximo da neutralidade.
Os precipitados citados no texto podem ser representados
pelas fórmulas:
Ca3(PO4)2 , CaCO3 e Mn(OH)2;
Ca3(PO4)2 , CaCO3 e Mg(OH)2;
CaHPO3 , Ca(HCO3)2 e Mn(OH)2;
CaF2 , Ca(HCO3)2 e Mg(OH)2;
CaF2 , CaCO3 e Mg(OH)2.
Questão 08) Em um laboratório de química, um analista
utilizou um indicador universal para determinar o pH de
diferentes amostras comerciais. Os resultados estão
listados na tabela a seguir.
Amostras
pH
I. Leite Integral
6,1
II. Cerveja escura
III.Suco de laranja
5,0
3,0
IV. Hidróxido de sódio 12,0
V. Água mineral
a)
b)
c)
d)
e)
8,0
Com base nos dados apresentados, conclui-se que a ordem
crescente das amostras, quanto à concentração de H+, é:
I, II, III, IV e V
II, III, IV, V e I
III, II, IV, V e I
IV, V, I, II e III
IV, II, I, V e III
Questão 09) O magma que sai dos vulcões durante as
erupções é constituído por rochas fundidas e vários tipos
de gases e vapores, tais como CO, CO2, SO2, SO3, HCl e
Questão 12) Para identificar quatro soluções aquosas, A,
B, C e D, que podem ser soluções de hidróxido de sódio,
sulfato de potássio, ácido sulfúrico e cloreto de bário, não
necessariamente nessa ordem, foram efetuados três
ensaios, descritos a seguir, com as respectivas
observações.
I.
A adição de algumas gotas de fenolftaleína a amostras de
cada solução fez com que apenas a amostra de B se
tornasse rosada.
II. A solução rosada, obtida no ensaio I, tornou-se
tornou
incolor
pela adição de amostra de A.
III. Amostras
ostras de A e C produziram precipitados brancos
quando misturadas, em separado, com amostras de D.
Com base nessas observações e sabendo que sulfatos de
metais alcalino-terrosos
terrosos são pouco solúveis em água,
pode-se
se concluir que A, B, C e D são, respectivamente,
respectivame
soluções aquosas de
a) H2SO4, NaOH, BaCl2 e K2SO4.
b) BaCl2, NaOH, K2SO4 e H2SO4.
c) NaOH, H2SO4, K2SO4 e BaCl2.
d) K2SO4, H2SO4, BaCl2 e NaOH.
e) H2SO4, NaOH, K2SO4 e BaCl2.
a)
b)
Questão 13) A solução de azul de bromotimol atua como
indicador de pH. Em meio ácido, sua cor fica amarela e,
em meio básico, azul. Para valores de pH entre 6 e 7, a
solução fica verde.
Considere um aquário de água doce, iluminado e montado
com peixes e plantas aquáticas. Retirouse uma amostra de
água
gua desse aquário (amostra 1) e a ela adicionou-se
adicionou
solução de azul de bromotimol (indicador de pH),
observando-se a cor verde.
O aquário foi mantido, por certo tempo, em ambiente
escuro. Nova amostra de água foi retirada (amostra 2)
2 e, ao
se adicionar o indicador de pH, a coloração foi diferente da
observada na amostra 1. Explique o que provocou a
diferença de pH entre as amostras 1 e 2.
A adição excessiva de ração para peixes levou ao aumento
da população de decompositores no aquário.
aq
Que
coloração é esperada ao se adicionar o indicador de pH a
uma amostra de água do aquário (amostra 3)? Justifique
sua resposta.
01. Em solução de ácido acético o equilíbrio da reação do
indicador
ador ficará deslocado para a esquerda e, portanto,
predomina a coloração amarela com pH < 7.
02. Em solução de cloreto de sódio, o indicador apresentará
coloração verde pois esta solução é neutra, pH = 7.
04. Em solução de acetato de sódio, o indicador ficará
fic
amarelo, uma vez que este sal em água forma ácido
acético.
08. Em solução de cloreto de amônio, o indicador apresentará
cor azul, pois esta solução é básica devido à hidrólise dos
íons amônio.
a)
b)
c)
d)
e)
Questão 16) Analise as equações:
I.
K2S(aq.) + 2 HClO3(aq.) → 2 KClO3(aq.) + H2S(aq.)
II. Zn(OH)2(s) → ZnO(s)
(s) + H2O(l)
III. Cl2(g) + 2 HI(aq.) → I2(s) + 2 HCl(aq.)
A classificação da reação equacionada e o nome do
composto em negrito são respectivamente:
a) em II, reação de simples troca e óxido de zinco.
b) em III, reação de simples troca e ácido perclórico.
c) em I, reação de dupla troca e cloreto de potássio.
d) em II, reação de decomposição e hidróxido de zinco.
e) em I, reação de dupla troca e clorato de potássio.
Questão 14) Um indicador ácido-base
base constitui uma
substância que muda de cor de acordo com o pH do meio e
por esta razão
ão é utilizado para indicar mudanças de pH em
soluções. A reação abaixo mostra a reação de equilíbrio de
um indicador ácido-base,
base, no qual a forma ácida (HInd) é
amarela e a forma básica (Ind–) é azul.
HInd(ℓ)
amarelo
+
H 2 O(ℓ)
→
←
+
H 3O (aq)
+
−
Ind (aq)
azul
O comportamento deste indicador em diferentes pH é
ilustrado abaixo:
a)
b)
c)
d)
De acordo com estas informações, quando este indicador
for adicionado a diferentes soluções, assinale o que for
correto
Questão 15) O indicador fenolftaleína apresenta-se
apresenta incolor
em soluções cujo pH, a 25 ºC, é inferior a 8,
aproximadamente. Considere as seguintes informações:
• ácido clorídrico é ácido forte;
• ácidos carbônico e sulfídrico são ácidos fracos;
• amônia é base fraca;
• hidróxido de sódio é base forte.
Sendo assim, o indicador fenolftaleína deve-se
deve
apresentar
incolor ao interagir com uma solução aquosa, a 25 ºC, de
cloreto de amônio.
amônia.
carbonato de sódio.
hidróxido de sódio.
sulfeto de sódio.
e)
Questão 17)
Adicionou-se
se uma porção de magnésio a uma solução de
ácido clorídrico em um frasco de erlenmeyer. Na boca do
frasco adaptou-se
se um balão de borracha bastante flexível.
Após algum tempo, o balão encheu-se
encheu
de gás. O balão
ascendeu após ter sua ponta amarrada e ser solto no ar. Ao
se aproximar dele um palito de fósforo aceso, o balão
explodiu.
Com base nessas informações, é correto afirmar que
o gás formado na primeira reação é o óxido de magnésio.
o produto gasoso formado na reação de combustão é mais
denso
nso que o ar, em idênticas condições.
a reação da combustão do gás é representada por H2(g)
+1/2 O2(g) → H2O(g).
na reação com o ácido, o metal sofre redução do seu
estado de oxidação.
a necessidade da chama indica que a reação de combustão
não é espontânea.
Questão 18) Considere o seguinte experimento:
Em um tubo de ensaio contendo uma certa quantidade de
zinco em pó, colocou-se uma quantidade suficiente de
solução aquosa de sulfato de cobre II. Na sequência, o
tubo foi agitado.
Depois de certo tempo de repouso, o que é possível
observar?
a) O sistema libera gás e torna-se incolor.
b) O sistema absorve energia deixando o tubo congelado.
c) O zinco em pó volta a se depositar no fundo do tubo.
d) Deposita-se cobre metálico no fundo do tubo e a solução
torna-se incolor.
e) Não ocorre qualquer reação química e o sistema
permanece inalterado.
Questão 19) Uma lâmina de zinco desgasta-se, com
efervescência, se for mergulhada em uma solução aquosa
1,0 mol/L a 25ºC de
a) NaCl.
b) HCl.
c) KNO3.
d) CuSO4.
e) NH4CH3COO.
Questão 20) De acordo com a ordem de reatividade, assinale a
alternativa na qual a reação não ocorre.
a) Zn + 2 HCl → H2 + ZnCl2
b) Fe + 2 HCl → H2 + FeCl2
c) Mg + H2SO4 → H2 + MgSO4
d) Au + 3 HCl →
e)
Informações:
“Os sais de amônio, em presença de hidróxidos e carbonatos de
metais alcalinos, desprendem amônia, NH3, de cheiro
característico”.
“Os carbonatos reagem com ácido, produzindo efervescência,
ou seja, desprendimento de gás carbônico CO2”.
Questão 23) Leia as informações abaixo e em seguida
responda ao que se pede.
A acidez estomacal é causada por alguma disfunção na
digestão, por estresse ou por excesso de alimentos.
Para aliviar a popular “queimação” no estômago, deve-se
ingerir um antiácido estomacal, geralmente o bicarbonato
de sódio, o qual é capaz de neutralizar o excesso de ácido
clorídrico presente no suco gástrico.
a) Escreva a equação balanceada que representa a reação
entre o acido clorídrico e o antiácido em questão.
b) Explique o comportamento básico do bicarbonato de sódio
na redução da acidez estomacal, uma vez que ele é
classificado como um sal ácido.
Questão 24) Complete as equações das reações abaixo e
preencha a tabela com os nomes e funções das substâncias
indicadas:
a) H3PO4 + Mg(OH)2 → ...................+.................
b) BaCl2 + Na2CO3 → ...................+.................
c) Na2O + H2O → ...................+.................
3
H2 + AuCl3
2
Substância Função Nome
Zn + 2 AgNO3 → 2 Ag + Zn(NO3)2
H3PO4
Questão 21) O bicarbonato de Sódio tem como principal
função no organismo o tamponamento dos radicais H+
livres. Para tanto, logo após sua introdução, via injetável,
ocorre uma dissociação da molécula nos íons bicarbonato
(aniônico) e
Sódio (catiônico), sendo o primeiro
responsável pela ligação com o H+. Marque a opção que
contém todas as substâncias necessárias à fabricação do
bicarbonato de Sódio
a) Na2CO3 e CO2
b) Na2CO3, CO2 e H2O
c) CO2 e H2O
d) NaCl, H2O e CaO
Mg(OH) 2
BaCl2
Na2CO3
Na2O
Questão 25) Os ácidos e bases definidos por Arrhenius
obedecem à seguinte equação geral de reação em meio
aquoso, ácido + base → sal e água. Analise as hipóteses de
reação a seguir e determine, considerando o balanço
estequiométrico correto, o produto formado na reação 1, e
os reagentes utilizados na reação 2.
Questão 22) No armazém de uma empresa, perderam-se
acidentalmente os rótulos de três barricas. Uma delas
contém nitrato de amônio (NH4NO3), outra carbonato de
Reação 1 – H2SO4 + 2NaOH → sal + água
Reação 2 – ácido + base → CaCO3 + 2H2O
sódio (Na2CO3) e outra, nitrato de sódio (NaNO3). Todos
estes sais têm o mesmo aspecto (pós brancos). Utilizando
apenas vinagre (solução aquosa de ácido acético), água
filtrada, copos e talheres, disponíveis na cozinha da
empresa, e também as informações abaixo, como você
faria para identificar estes sais?
a)
b)
c)
d)
Na2SO4 + H2O e H2CO3 + CaOH
NaSO4 + 2H2O e HCO3 + 2CaOH
Na2SO4 + 2H2O e H2CO3 + Ca(OH)2
Na2SO4 + 2H2O e H2CO3 + 2Ca(OH)2
Questão 26) Considere as seguintes características de um
determinado metal:
–
é um sólido que reage violentamente com água,
produzindo hidróxido;
–
seu cátion monovalente é isoeletrônico do hélio;
–
é usado para o tratamento de distúrbios bipolares sob a
forma de um sal de carbonato.
Nomeie esse metal. Em seguida, escreva a reação química de
dupla-troca que produz o carbonato desse metal e o sulfato
de sódio.
Questão 27)
Um dos métodos utilizados para determinar o teor de
bicarbonato de sódio em comprimidos antiácidos é
realizado utilizando-se
se a aparelhagem esquematizada
abaixo.
a)
b)
c)
d)
e)
Questão 29) Uma transformação química evidenciada pela
formação de precipitado ocorre quando são misturados
a)
b)
c)
d)
e)
a)
b)
a)
b)
1.
2.
3.
4.
5.
Escreva as equações que representam as reações químicas
que ocorrem no erlenmeyer e no tubo de retenção.
Descreva o procedimento usado para determinar o teor de
bicarbonato de sódio por meio do método esquematizado
acima e justifique.
c)
d)
Questão 28) Muitas reações químicas podem ser
evidenciadas por uma observação experimental a olho nu.
A respeito disso, numere a coluna da direita, relacionando
as situações em que são misturadas espécies químicas com
as respectivas reações químicas.
00.
01.
Carbonato de cálcio (CaCO3) sólido e solução concentrada
de ácido clorídrico (HCℓ).
02.
Solução concentrada de ácido sulfúrico (H2SO4) e solução
concentrada de hidróxido de bário (Ba(OH)2).
Magnésio (Mg) metálico e oxigênio (O2) gasoso.
Solução concentrada de ácidoo nítrico (HNO3) e raspas
finas de cobre (Cu) metálico.
03.
Solução diluída de ácido clorídrico (HCℓ)
(HC e solução
04.
diluída de hidróxido de potássio (KOH).
( ) Reação evidenciada pela mudança de cor do meio.
( ) Reação evidenciada por uma efervescência devida à
liberação de gás incolor e inodoro.
( ) Reação evidenciada pela precipitação de um sólido branco.
( ) Reação não evidenciada a olho nu, pois não há alteração
na cor ou estado físico na mistura.
( ) Reação evidenciada pela emissão de luz.
Assinale a alternativa
lternativa que apresenta a numeração correta da
coluna da direita, de cima para baixo.
5 – 1 – 2 – 3 – 4.
4 – 1 – 2 – 5 – 3.
5 – 3 – 2 – 4 – 1.
4 – 3 – 5 – 1 – 2.
2 – 1 – 4 – 5 – 3.
comprimido efervescente e água.
vinagre e bicarbonato de sódio.
gás carbônico e água de cal.
água oxigenada e sangue.
álcool comum e água.
Questão 30) Funções químicas são um conjunto de
d
substâncias que apresentam propriedades químicas
semelhantes decorrentes de suas características estruturais.
Sobre esse assunto, é CORRETO afirmar:
na água oxigenada, o oxigênio apresenta um número de
oxidação igual a –2.
o CaO pode ser obtido pela
pel decomposição térmica do
CaCO3.
uma solução aquosa de NaHCO3 apresenta caráter ácido.
o HF e o LiOH são compostos insolúveis em água.
Questão 31) Em relação aos processos de fabricação e
utilização dos ácidos sulfúrico e nítrico, analise as
afirmativas abaixo e conclua.
Entre os ácidos inorgânicos, o ácido sulfúrico é um dos
mais importantes para as atividades industriais, sendo o
grau de desenvolvimento de um país aferido por seu
consumo.
A primeira etapa da produção industrial do ácido
ác
sulfúrico
pelo processo de contato é a oxidação do dióxido de
enxofre a anidrido sulfúrico.
No processo industrial de obtenção do ácido nítrico,
utilizando-se
se a amônia na presença de um catalisador
apropriado, obtém-se,
se, em uma das etapas, o NO2 gasoso.
O ácido nítrico é usado na indústria química, na produção
de fertilizantes, corantes, explosivos e em uma série de
outros produtos.
Tanto na produção industrial do ácido sulfúrico como na
do ácido nítrico, em uma das etapas, utiliza-se
utiliza
o
catalisador
isador bióxido de manganês.
Questão 32)
Sobre as propriedades das funções
inorgânicas, são apresentadas as afirmativas abaixo.
Analise-as e conclua.
00. O cloreto de hidrogênio é uma substância muito ácida e
corrosiva, razão pela qual o pH da referida substância no
estado líquido é próximo de zero.
01. O ácido nítrico é um agente oxidante muito utilizado em
laboratório, em diversas reações químicas.
02. A destruição de florestas, a diminuição da produção de
alimentos e o aumento das doenças do aparelho
respiratório nos humanos estão associados à queima de
combustíveis contendo enxofre.
03. O monóxido de carbono é um óxido muito perigoso
quando inalado, podendo levar à morte por asfixia, em
conseqüência do aumento de acidez que ele provoca no
sangue.
04. A bula de um remédio indica que ele serve, dentre outras
indicações, para hiperacidez. Isso nos permite concluir que
o hidróxido de alumínio é um provável componente na
formulação química desse remédio.
Questão 33)
A Substância
I) KOH
II) Fe2O3
III) Mg(OH)2
IV)HCl (aq.)
V) NaCl
B ocorrência
( ) no suco gástrico
( ) no soro fisiológico
( ) nas pilhas alcalinas
( ) na hematita
( ) nos medicamentos usados no combate à azia
Relacionando as substâncias da coluna A com a ocorrência
citada na coluna B,, a seqüência correta, de cima para
baixo, é:
a) IV , V , III , II , I.
b) IV , V , I , II , III.
c) III , I , II , V , IV.
d) I , V , IV , II , III.
e) V , IV , I , II , III.
Questão 34) Existem muitas substâncias químicas
quí
que
são utilizadas diariamente e são encontradas em produtos
de supermercados e, por isso, estão presentes na maioria
das residências. Alguns destes produtos são: água
sanitária, sabão, vinagre, sal e açúcar. Os compostos
químicos presentes são geralmente
mente identificados nos
rótulos. Para os produtos citados, os compostos químicos
são, respectivamente:
a) HIO, NH4OH, CHO2H, NaCl, C6H6
b) KCl, C2H6, CH3OH, CaCO3, CH3CH2OH
c) H2O2, NH3, C6H6, NaCl, C6H12O6
d) HClO, NaOH, CH3COOH, KIO3, C12H22O11
e) H2O2, C2H4, CH3CO2H, NaClO, C6H12O6
Questão 35) Ácido nítrico é produzido pela oxidação de
amônia com excesso de oxigênio, sobre um catalisador de
platina, em uma seqüência de reações exotérmicas. Um
esquema simplificado desse processo é
a)
b)
Escreva as equações químicas balanceadas das reações que
ocorrem no reator, na torre de oxidação e na torre de
absorção. Note que, desta última, sai NO(g), nela gerado.
A maior parte desse gás é aproveitada na própria torre,
onde há oxigênio em excesso. Duas
Du reações principais
ocorrem nessa torre.
A velocidade da reação que ocorre na torre de oxidação, ao
contrário da velocidade da maioria das reações químicas,
diminui com o aumento da temperatura. Baseando-se
Baseando
em
tal informação, explique o que deve ser o dispositivo A.
Questão 36) Relacione a coluna 1, que contém fórmulas de
compostos químicos, com a da coluna 2, que apresenta
algumas de suas aplicações.
Coluna 1
1. CaSO4.2H2O
2. Ca(OH)2
3. HF
4. NaNO3
5. H3PO4
Coluna 2
( ) gravação em vidro
( ) caiação de paredes
( ) construções e decorações
( ) conservante de carnes
( ) acidulante em bebidas
A seqüência numérica correta, de cima para baixo, é:
a) 3 – 2 – 5 – 1 – 4
b) 3 – 2 – 1 – 4 – 5
c) 2 – 4 – 5 – 1 – 3
d) 2 – 3 – 5 – 4 – 1
e) 2 – 3 – 1 – 5 – 4
Questão 37) Considere os íons SO42– , OH1– , Al3+ , HPO42– ,
H1+ , O2– e H3C — COO-. Combine-os
Combine
entre si, aos pares,
de forma a obter substâncias com as seguintes
características:
I. ioniza em presença de água.
II. é usada para neutralizar a acidez estomacal.
III. é usada, em uma das etapas, nas estações de tratamento de
água.
IV. é a componente principal do minério bauxita.
As substâncias I, II, III e IV podem ser, respectivamente:
a) H2SO4 , Al(OH)3 , H2O e Al2(HPO4)3.
b) H3PO4 , Al2(SO4)3 , Al2O3 e Al(OH)3.
c) H3C — COOH, Al(OH)3 , Al2(SO4)3 e Al2O3.
d) Al(OH)3 , H2O , H3PO4 e Al2(SO4)3.
e) Al2O3 , H2SO4 , Al2(SO4)3 e Al(OH)3.
Questão 38)
Alguns compostos químicos têm grande
importância na indústria e no laboratório sendo bastante
consumidos na fabricação (síntese) de outros compostos.
Analise as proposições e marque a alternativa correta:
1. Concentrado, é um dos desidratantes mais energéticos.
2. É utilizado na fabricação de explosivos (nitroglicerina).
3. Neutraliza o excesso de HCl no suco gástrico.
4. É utilizado na fabricação de vidro comum e sabões.
5. Diminui a acidez do solo na agricultura.
a) H2SO4, HNO3, NaHCO3, Na2CO3, CaO.
b) HNO3, H2SO4, NaHCO3, CaO, Na2O3.
c) HNO3, NaHCO3, Na2CO3, H2SO4, CaO.
d) H2SO4, NaHCO3, HNO3, Na2CO3, CaO.
e) CaO, Na2CO3, NaHCO3, CaO, H2SO4.
Questão 39) Duas etapas fazem-se
se necessárias na obtenção de
chumbo, a partir do minério denominado galena (PbS).
I.
Ustulação, que consiste no aquecimento ou “queima do
sulfeto” em presença de oxigênio, formando óxidos.
II. Redução do óxido de metal formado na etapa I, com
monóxido de carbono.
A alternativa que apresenta a equação correta de uma das
etapas é:
a) de I PbS + O2 → PbO2 + S
b) de II PbO + CO→ PbO2 + C
c) de I PbS + O2 → Pb + SO2
d) de II PbO + CO → Pb + CO2
e) de II PbO + CO2 → Pb + CO + O2
Questão 40) O carbonato de sódio é usado em grande escala na
fabricação do vidro, no tratamento de águas e na
neutralização de soluções ácidas.
O diagrama indica uma das etapas da obtenção do
carbonato de sódio a partir do aquecimento do
hidrogenocarbonato de sódio.
Dado: M(NaHCO3) = 84 g/mol
M(H2O) = 18 g/mol
M(CO2) = 44 g/mol
Julgue os itens seguintes:
00. A reação que ocorre é:
∆
2NaHCO3(s)
→
Na 2 CO3(s) + H 2O(g) + CO 2(g)
01. Em b recolhe-se o Na2CO3.
02. Em c recolhe-se o CO2.
03. Na decomposição de 84g de NaHCO3 obtêm-se 18g de
água.
04. Recolhe-se
se 0,5 mol de CO2 quando se decompõe 1,0 mol
de NaHCO3.
05. Quando se forma 1 mol de Na2CO3, formam-se 6,02×1023
moléculas de água.
Questão 41) Certas substâncias têm nome comercial
característico (coluna A), bem diferente do nome químico,
colocado junto com a respectiva fórmula na coluna B.
Associando a coluna A à B temos a seqüência
seqüê
numérica:
A
B
(1). barrilha
(
).. solução aquosa de peróxido de
hidrogênio H2O2.
(2). ácido muriático
( ). nitrato de sódio NaCO3.
(3). água oxigenada
( ). ácido clorídrico HCl(aq).
(4). soda cáustica
( ). carbonato de sódio Na2CO3.
(5). salitre do Chile
( ). hidróxido de sódio NaOH.
a) 4, 1, 2, 5, 3;
b) 2, 5, 3, 1, 4;
c) 3, 5, 2, 1, 4;
d) 1, 4, 3, 2, 5;
e) 3, 1, 4, 5, 2.
Questão 42) Explique
ue o que se entende por chuva ácida.
Quais são as causas deste problema? Quais são as formas
de controlá-lo?
- Entende-se
se por chuva ácida a qualquer chuva que apresenta
pH < 5,6
Questão 43) Reações de deslocamento ou simples troca são
aquelas em que uma substância simples de um elemento
mais reativo desloca outro de uma substância composta.
Um exemplo de reação de deslocamento, em que o cálcio
desloca o hidrogênio, é apresentado a seguir:
Ca(s) + 2 HNO3(aq) Ca(NO3)2(aq) + H2(g)
a) Qual o nome do sal formado nessa reação?
b) Por analogia, apresente a equação da reação em que o
alumínio desloca o hidrogênio do ácido clorídrico.
Questão 44) Uma solução contém cátions bário, Ba2+,
chumbo, Pb2+ e sódio, Na+. Os cátions bário e chumbo
formam sais insolúveis com ânions, sulfato, SO42-. Dentre
esses cátions, apenas o chumbo forma sal insolúvel com o
ânion iodeto, I-.
a) Com base nessas informações, indique um procedimento
para separar os três tipos de cátions presentes na solução.
b) Escreva as equações
ções das reações de precipitação
envolvidas nessa separação.
A gravura em metal é uma técnica antiga que pode
produzir belas obras de arte. A técnica consiste em revestir
umaa placa de metal com uma camada de cera protetora.
Com um instrumento pontiagudo, o artista desenha a
imagem riscando a cera e descobrindo o metal. A seguir,
com uma solução ácida, cria na placa sulcos onde é feito o
desenho. A placa é lavada, a cera é removida
re
e, após a
aplicação de tinta, é feita a impressão da gravura.
Questão 45) Uma solução pode ser caracterizada como ácida
pela observação de sua reação com o calcário (CaCO3) ou
com o zinco metálico (Zn0). Em ambas as situações
observa-se, nas condições normais
mais de temperatura e
pressão, o desprendimento de gases.
a) Forneça o nome do gás formado pela reação de soluções
ácidas com o calcário e o nome do outro gás formado pela
reação dessas soluções com o zinco metálico.
b) Das reações descritas, escreva a equação
ação química que
representa a reação de óxido-redução
redução e identifique qual
dos reagentes é o redutor.
Questão 46) Um grupo de alunos desenvolveu um
experimento no laboratório de química para o estudo das
propriedades de dois compostos sólidos de coloração
branca, consistindo de dois testes:
Teste I: condutividade elétrica de suas soluções aquosas.
Teste II: reação dos compostos em ácido sulfúrico H2SO4.
O grupo de alunos anotou os seguintes resultados:
Teste I: somente a solução aquosa do composto B
apresentou condutividade.
Teste II: Utilizando a capela, verificou--se que os dois
compostos reagem com o ácido sulfúrico, liberando calor e
produzindo gases. Na reação do composto A, a liberação
de energia foi mais intensa, com formação de bolhas,
expansão do volume e ainda um forte odor foi detectado.
Após a discussão dos resultados com o grupo de alunos, o
professor informou:
• Os sólidos A e B eram, respectivamente, a sacarose
(C12H22O11) e o carbonato de sódio Na2CO3.
• O ácido sulfúrico é um poderoso agente
gente desidratante. O
composto testado é completamente desidratado, com
formação de vapor d’água e um resíduo sólido escuro,
constituído de carbono.
a) Explique os resultados do teste I.
b) Escreva as equações das reações, devidamente
balanceadas, que ocorrem
rem com os compostos A e B no
teste II.
Questão 47) Um fermento químico utilizado para fazer bolos
é o sal bicarbonato de amônio, também chamado
carbonato ácido de amônio. Quando aquecido, esse sal se
decompõe em dióxido de carbono (gás carbônico), amônia
amôni
e água. Escreva a equação química desse processo e
explique como essa reação favorece o crescimento do
bolo.
TEXTO: 1 - Comum à questão: 48
Questão 48) Em um estúdio, um artista utilizou a técnica
de gravura sobre uma placa de zinco, empregando uma
solução de ácido clorídrico para gravar a imagem.
Escreva a equação balanceada da reação que ocorre entre o
metal e o ácido clorídrico.
TEXTO: 2 - Comum à questão: 49
Cerca de 1/4 de todo o dióxido de carbono liberado pelo
uso de combustíveis fósseis é absorvido pelo oceano, o
que leva a uma mudança em seu pH e no equilibrio do
carbonato na água do mar. Se não houver uma ação rápida
para reduzir as emissões de dióxido de carbono, essas
mudanças podem levar a um impacto devastador em
muitos organismos que possuem esqueletos, conchas e
revestimentos, como os corais, os
o moluscos, os que vivem
no plâncton, e no ecossistema marinho como um todo.
a)
b)
c)
d)
Questão 49) Do ponto de vista químico, inicialmente
ocorrem a dissolução do dióxido de carbono gasoso na
água e a formação de dióxido de carbono em solução.
Uma vez dissolvido na água do mar, o dióxido de carbono
reage rapidamente com a água, modificando seu equilíbrio
equilíbri
iônico. Assim, a reação do dióxido de carbono com a água
faz o pH da água aumentar e pode ser representada por
CO2(aq) + H2O(aq) → HCO 3− (aq) + H+(aq).
faz o pH da água baixar e pode ser representada por
CO(aq) + H2O(aq) → 2H+(aq) + CO2(aq).
faz o pH da água baixar e pode ser representada por
CO2(aq) + H2O(aq) → HCO 3− (aq) + H+(aq).
faz o pH da água aumentar e pode ser representada por
CO2(aq) + H2O(aq) → H2CO3(aq).
TEXTO: 3 - Comum à questão:
O ácido fosfórico, estrutura química representada na
figura, é utilizado na indústria de fertilizantes e de bebidas.
Seu uso vem aumentando devido à expansão da produção
agrícola e é comercializado como solução aquosa
concentrada com teor de 85% em massa e densidade 1,7
g.mL–1, a 20 ºC.
Naquele em que ocorrer desprendimento de gases de cheiro
característico será o que contém o nitrato de amônio:
Na2CO3(s) + 2NH4NO3(s) + água → 2NaNO3(aq) + 2NH3(g)
+ H2O(l) + CO2(g)
Portanto o outro sal será o o nitrato de sódio.
23) Gab:
O
H
H
P
O
O
O
a)
b)
c)
d)
e)
H
Questão 50) Na equação completa da reação de
neutralização total do ácido fosfórico com hidróxido de
potássio (KOH), a somatória dos índices estequiométricos
é igual a
4.
6.
8.
10.
12.
GABARITO:
a)
HCl + NaHCO3 (aq) → NaCl (aq) + H 2 O (l) + CO 2(g)
b)
Na reação observa-se que o bicarbonato de sódio, mesmo sendo
classificado como um sal ácido, em contato com ácidos fortes, no
caso específico o HCl, apresenta um comportamento básico,
capaz de neutralizar o excesso de ácido clorídrico presente no
estômago.
24) Gab:
a) Mg3(PO4)2 + H2O
b) BaCO3 + NaCl
c) NaOH
Substância Função Nome
1) Gab:
a)
2NH3(g) + SO 24- (aq) + 2 H + → 2 NH +4 (aq) + SO 24- (aq)
H3PO4
b)
Base: NH3
Mg(OH) 2
Ácido conjugado: NH +4
2) Gab: A
3) Gab: 15
4) Gab: 28
5) Gab: VVVVF
6) Gab: A
7) Gab: VVFVV
8) Gab: D
9) Gab: A
10) Gab: E
11) Gab: B
12) Gab: E
13) Gab:
a)
A diferença de pH foi provocada pela maior concentração de
CO2 na amostra 2 em relação à 1. A ausência de luz impede a
fotossíntese, que consumiria o CO2 liberado pela respiração.
Dessa forma, haverá maior acúmulo desse gás na água, tornandoa mais ácida e diminuindo o pH no aquário, segundo a reação:
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO–3
b) Na amostra 3, espera-se uma coloração amarelada. Isso ocorre
porque a decomposição aeróbia da matéria orgânica existente na
ração produzirá grande quantidade de CO2, tornando a água mais
ácida.
14) Gab: 03
15) Gab: A
16) Gab: E
17) Gab: C
18) Gab: D
19) Gab: B
20) Gab: D
21) Gab: B
22) Gab:
Colocando um pouco de vinagre em três copos e acrescentando
um pouco de cada um dos sais nos copos, pode-se observar que
em um dos deles irá se obsrvar o desprendimento de gás ( o copo
que contém carbonato de sódio):
CH3COOH(aq) + Na2CO3(s) → CH3COONa(aq) + H2O(l) +
CO2(g)
Como o frsaco que contém o carbonato de sódio já foi
identificado pode-se preparar uma solução aquosa desse sal e
adicionar a ele um pouco de cada um dos outros dois sais.
BaCl2
Na2CO3
Na2O
Ácido Fosfórico
Hidróxido
Base de magnésio
Cloreto
Sal
de bário
Carbonato
Sal
de sódio
Óxido de
Óxido sódio
25) Gab: C
26) Gab:
Lítio
Na2CO3 + Li2SO4 → Li2CO3 + Na2SO4
27) Gab:
a)
No erlenmeyer, ocorre a seguinte reação:
2 NaHCO3(aq) + H2SO4(aq) → Na2SO4(aq) + 2 CO2(g) + 2 H2O(l)
No tubo de retenção, ocorre a seguinte reação:
CO2(g)+ 2NaOH (s) → Na2CO3(s) + H2O (l)
b) O teor de bicarbonato pode ser medido pela diferença da massa
inicial do tubo de retenção, comparando-se com a massa ao fim
da reação. O aumento da massa é a retenção do CO2 gerado,
assim basta fazer-se uma regra de três e verificar o teor,
comparando-se a massa do comprimido com a massa de CO2
gerada.
28) Gab: B
29) Gab: C
30) Gab: B
31) Gab: VFVVF
32) Gab: FVVFV
33) Gab: B
34) Gab: D
35) Gab:
a) O método industrial conhecido como Processo Ostwald apresenta
as seguintes reações químicas:
⇒ no reator:
Pt
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
⇒ na torre de oxidação:
2NO(g) + O2(g) → 2NO(g)
⇒ na torre de absorção:
3NO2(g) + H2O(l) → 2HNO3(g) + NO(g)
2NO(g) + O2(g) → 2NO(g)
b)
O dispositivo A é umtrocador de calor que serve para regular
(diminuir) a temperatura do reator.
36) Gab: B
37) Gab: C
38) Gab: A
39) Gab: D
40) Gab: Corretos: 0, 2, 4 e 5.
41) Gab: C
42) RESOLUÇÃO
- CAUSAS:
Nos lagos:
- o aumento da acidez das águas provoca a destruição da
vegetação aquática e provoca a morte de peixes como por
exemplo a truta e o salmão que morrem em pH=5,5.
Nas florestas:
Produz morte nas floresta de grande porte devido à destruição
das
células respiratórias (estômatos) das árvores.
No solo:
Altera o pH , sendo necessário o uso de agentes corretivos como
por exemplo o calcário ( CaCO3)
Nos monumentos:
Os monumentos à base de calcário e mármore sofrem corrosão
na presença de ácido sulfúrico, sendo parcial ou totalmente
destruídos.
Na saúde humana:
Produz diversos danos ao aparelho respiratório
- Distúrbios biológicos como tosse, asma, bronquite, efizema
pulmonar e etc.
FORMAS CONTROLADORAS:
Do ponto de vista técnico, podemos empregar algumas medidas,
tais como:
- Usar carvão mineral mais purificado;
- Utilização de sistemas de absorção adequados de SO2 em
caldeiras;
- Eliminação do enxofre existente no petróleo;
- Diminuição do uso de transporte particular e aumento do uso de
transporte coletivo.
43) Gab:
a) Nitrato de cálcio
b) 2 Al + 6 HCl 2 AlCl3 + 3 H2
44) Gab:
a) Com a adição do iodeto irá ocorrer a precipitação do Pb2+ na
forma de PbI2 o qual poderá ser separado por uma filtração. A
seguir com a adição do sulfato irá ocorrer a precipitação do irá
ocorrer a precipitação do bário na forma de BaSO4 que também
poderá ser separado por filtração.
b)
Pb2+(aq) + 2I-(aq) → PbI2(s)
Ba2+(aq) + SO42-(aq) → BaSO4(s)
45) Gab:
a)
CO2(g) reação com o calcário
H2(g) reação com o zinco
b) 2HA + Zn → ZnA2 + H2(g)
Zno → redutor
46) Gab:
a) A solução do teste I (composto 8) é de carbonato de sódio
(Na2CO3). Esse composto em presença de água sofre dissociação
liberando os íons Na+ e CO32 − que conduzem corrente elétrica.
b)
1Na 2 CO 3 (aq ) + 1H 2SO 4 (aq ) →
→ 1Na 2SO 4 (aq) + 1H 2 O(l) + 1CO 2 (g )
47) Gab:
∆
NH 4 HCO3(s)
→
CO 2(s) + H 2O (l) + NH3(g) .
gases formados provocam aumento de volume.
48) Gab:
Zn + 2 HCl → ZnCl2 + H2
49) Gab: C
50) Gab: C
Os