Objetivos
Princípios
Farmacodinâmicos
Marcos Moreira
■
■
■
■
■
■
Farmacodinâmica
■
Estudo dos processos bioquímicos e
fisiológicos subjacentes à ação dos
fármacos:
■
Mecanismo de ação.
■
■
■
Interação fármaco-receptor.
Eficácia.
Perfil de segurança.
Definição.
Categorias de Receptores.
Processo de Ação do Fármaco.
Biofase.
Eficácia Intrínseca.
Agonistas & Antagonistas.
Farmacodinâmica ■
O que o fármaco fará com o organismo?
■
■
Nível celular.
Nível sistêmico.
Farmacodinâmica ■
Categorias de Receptores
Estuda o modo como os fármacos
influenciam os processos do organismo pela
sua interação com receptores específicos...
■
mecanismos de ação e seus efeitos resultantes.
■
■
■
■
■
Categorias de Receptores
Receptores de ligantes específicos
receptores de membrana (transmembrana).
receptores intracelulares.
Receptores enzimáticos.
Receptores carreadores de transporte.
Receptores
■
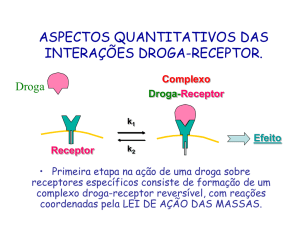
As ligações químicas se formam entre as
moléculas do fármaco e os sítios de ligação
de seus receptores...
■
essas ligações são geralmente de natureza fraca,
reversível, mas dinâmica.
Afinidade dos Receptores
■
Tendência ou grau com que moléculas de
um fármaco são atraídas para seus
receptores.
Afinidade dos Receptores
■
Fornece uma indicação da força das ligações
químicas que se formam entre as moléculas
e os receptores.
■
Afinidade dos Receptores
■
Fármacos com uma alta afinidade por seus
receptores exibirão uma tendência m_____
de se combinar com esses receptores do
que fármacos com baixas afinidades.
complexos fármaco-receptor (FR).
Afinidade dos Receptores
■
Quanto maior for a afinidade de um fármaco
por seus receptores, mais potente será o
fármaco !!!
Processo de Ação do Fármaco
■
Moléculas de fármacos podem ser vistas
como mensageiros químicos que conduzem
mensagens (sinais químicos) para alvos
biológicos.
■
■
Transdução de sinal : eventos iniciais
servem para amplificar e transmitir a
mensagem original para as partes funcionais
das células-alvo.
realiza mudanças bioquímicas ou elétricas em
órgãos efetores.
Processo de Ação do Fármaco
■
Processo de Ação do Fármaco
O processo de transdução de sinal pode
acontecer por influência direta da
permeabilidade da membrana (abertura de
canais de íons) como por um processo
acoplado à proteína G.
Processo de Ação do Fármaco
■
Tempo que uma molécula do fármaco
realmente passa em seu receptor é medido
em milissegundos.
■
isso implica que a dissociação fármaco-receptor
também ocorra.
Processo de Ação do Fármaco
■
Constante de Dissociação (KD)
■
■
■
Mede a afinidade do fármaco a um dado receptor.
Definida como a concentração do fármaco
necessária em solução para atingir 50% de
ocupação dos seus receptores.
Biofase
■
Processo de Ação do Fármaco
Área que circunda diretamente o sítio de
ligação do receptor.
Em farmacologia, diz-se que um equilíbrio
foi atingido quando a taxa de associação
se iguala à taxa de dissociação fármacoreceptor.
Biofase
■
Fármacos precisam alcançar a biofase em
concentrações suficientemente altas para
permitir que se liguem a um número
adequado de receptores para produzir efeito
clínico significativo.
Biofase
■
Alguns fármacos podem ser administrados
diretamente em sua biofase ...
■
■
doses menores e menos efeitos adversos
sistêmicos.
Transdução de Sinais Químicos
■
Transdução de Sinais Químicos
Receptores acoplados à proteína G fazem
uso de mensageiros secundários
intracelulares para sua transdução de sinal.
Quando a permeabilidade da membrana é
influenciada, a resposta pode ser esperada
dentro de milissegundos, enquanto as
respostas acopladas à proteína G se
manifestam dentro de segundos a minutos.
Transdução de Sinais Químicos
■
Fármacos podem ativar ou inibir
mensageiros secundários intracelulares.
■
cAMP, inositol trifosfato (IP3) e o diacilglicerol (DAG)
e até íons de Ca++ intracelulares.
Receptores de membrana
■
Proteínas transmembrana específicas
(proteínas de canal) formam canais de íons
na membrana plasmática.
Receptores de membrana
■
Canais de íons são regulados por ligantes ou
por meio de sua sensibilidade a impulsos
elétricos (regulados por voltagem).
Receptores de membrana
■
Canais de íons exibem seletividade por seus
íons específicos.
■
Canais de íons separados para Na+, Ca++ e Clpodem estar presentes em uma única membrana
plasmática.
Receptores de membrana
■
Alguns fármacos podem se ligar a áreas-alvo
diretamente nas proteínas de canal.
■
Uma vez que o complexo FR tenha sido formado,
a conformação do canal é modificada.
Receptores de membrana
■
Com isso, a permeabilidade do canal para
seus íons específicos é aumentada.
■
■
canal é “aberto”.
Interações Fármaco-Receptor
■
Receptores de membrana
Os fármacos podem ser classificados em
agonistas, antagonistas ou dualistas
dependendo da habilidade de seus
complexos FR de extrair ou iniciar respostas
celulares ou efeitos celulares ativos.
Íons movem-se ao longo de seus gradientes
eletroquímicos rapidamente para dentro da
célula, onde iniciarão respostas biológicas.
Atividade (Eficácia) Intrínseca
■
Descreve a efetividade biológica do
complexo FR = habilidade de o fármaco
obter uma resposta celular.
■
Expressa como uma fração (0 a 1).
Atividade (Eficácia) Intrínseca
■
■
Zero significa que absolutamente nenhum
efeito será provocado pelo fármaco.
Um indica que a resposta celular máxima
será iniciada.
Atividade (Eficácia) Intrínseca
■
A dopamina e a serotonina (5-HT), por
exemplo, provocam respostas excitatórias,
enquanto o NT endógeno ácido gamaaminobutírico (GABA) provoca uma
resposta inibitória.
Atividade (Eficácia) Intrínseca
■
Todos os transmissores endógenos de
sinais têm atividades intrínsecas iguais a 1.
■
todavia, as respostas celulares ativas podem ser
tanto excitatórias como inibitórias em sua
natureza.
Interações Fármaco-Receptor
■
Em termos de atividade intrínseca, os
fármacos podem ser categorizados em
agonistas e antagonistas.
Modelo dos dois Estados
■
Receptores coexistem em 2 estados de
conformação, inativo (repouso) e ativo
(ativado), presentes em equilíbrio.
Modelo dos dois Estados
■
Os agonistas mostram seletividade pelo
estado ativado; os antagonistas não
exibem seletividade.
Modelo dos dois Estados
■
Normalmente, quando não há nenhum
ligante, o equilíbrio está bastante
deslocado para a E, havendo poucos
receptores ativados.
Fármacos Agonistas
■
Dão origem a alterações no funcionamento
celular que produzem efeitos de vários
tipos.
Fármacos Agonistas
■
■
A potência dos agonistas depende de 2
parâmetros: afinidade (tendência de ligar-se
a receptores) e eficácia intrínseca.
Podem ser: totais, parciais e inversos.
Agonistas Totais (Plenos)
■
■
Apresentam eficácia intrínseca igual a 1
sendo capazes de provocar respostas
celulares máximas.
Possuem alta eficácia.
Agonistas Inversos
■
Ligam-se à
conformação
inativa do receptor
e a estabilizam,
desviando, assim,
o equilíbrio para o
estado inativo do
receptor.
Agonistas Parciais
■
São capazes de produzir apenas efeitos
submáximos.
■
■
conhecidos como antagonistas-agonistas.
possuem eficácia intermediária (<1).
Agonistas Parciais
■
■
Um agonista parcial com AI< 0,5
desempenhará provavelmente uma
atividade antagonista (bloqueadora).
Caso seja administrado como monoterapia
geralmente evocará suas atividades
agonistas.
Fármacos Antagonistas
■
■
Ligam-se a receptores sem originar
alterações no funcionamento celular.
Exibem eficácia intrínseca igual a ZERO e
são chamados comumente de
antagonistas competitivos.
Agonistas Parciais
■
Se um agonista total já estiver presente, ele
desempenhará suas propriedades de
antagonismo competitivo.
Antagonistas Competitivos
■
Geralmente mostram afinidades mais altas
por seus receptores do que seus agonistas
correspondentes.
Antagonistas Competitivos
■
São conhecidos como bloqueadores de
receptores simplesmente bloqueando
receptores para evitar que agonistas
formem complexos agonista-receptor
funcionais.
Antagonistas Competitivos
■
Uma vez que esteja ligado ao receptor, um
aumento na concentração do agonista na
biofase poderá novamente deslocar o
antagonista de seu sítio de ligação =
antagonismo competitivo reversível.
Antagonistas Competitivos
■
Podem deslocar o agonista
correspondente de seu sítio de ligação no
receptor, graças a sua maior afinidade.
■
Mas não podem reverter ativamente os efeitos
de seus agonistas correspondentes.
Antagonistas Competitivos
■
Antagonismo competitivo irreversível ocorre
quando o antagonista se dissocia muito
lentamente, ou não se dissocia, dos
receptores, tendo como resultado a não
alteração da ocupação do antagonista
quando o agonista é aplicado.
■
■
Usado como ferramenta de pesquisa.
Inibidores enzimáticos irreversíveis.
Antagonistas Multipotentes
■
Fármacos que são capazes de agir como
bloqueadores em mais de um sistema de
receptores.
Antagonistas Multipotentes
■
Suas estruturas químicas lhe permitem
algum grau de efeitos antagonistas não
seletivos de natureza antimuscarínica, antihistamínica, adrenérgica ...
■
Antagonistas Não Competitivos
■
■
São usados para anular ativamente os
efeitos de fármacos agonistas ou outras
substâncias químicas no organismo.
Existem 4 tipos descritos (funcionais,
químicos, metafinoides e bioquímicos).
Exemplos: AH de primeira geração e ADTs.
Antagonista Funcional
■
Na verdade é um agonista que age em um
sistema de receptores diferente, no qual
produz efeitos biológicos opostos àqueles
produzidos pelo agonista inicial.
■
também conhecidos como fisiológico.
Antagonista Químico
■
Forma uma ligação química com o
agonista, por meio da qual diminui sua
afinidade por seus sítios de ligação nos
receptores.
■
■
Reduz diretamente a concentração do
agonista na biofase.
■
■
concentração e efetividade do agonista é, então,
reduzida.
sulfato de protamina cessa o efeito da heparina
sobre a coagulação sanguínea.
Antagonista Bioquímico
■
Antagonista Metafinoide
Isto pode ser alcançado tanto pela aceleração
da biotransformação ou da excreção do agonista
quanto pela competição com o agonista pelo
transporte até seus receptores.
Muda a conformação dos sítios de ligação
dos receptores utilizados pelos agonistas
influenciando a ocupação do receptor pelo
agonista.
■
No caso de enzimas, é chamado de alostérico.
Receptores Intracelulares
■
■
Mecanismo de ação dos hormônios
esteroides (glicocorticoides)
O processo se inicia pela passagem do
glicocorticoide (GC), lipofílico, pela
membrana plasmática da célula alvo, por
difusão passiva.
Receptores Intracelulares
■
■
No citoplasma, o GC se liga ao seu
receptor glucocorticoid cytosolic receptor
(GCR) que são proteínas citoplasmáticas.
O complexo GC-receptor sofre
transformação estrutural.
Receptores Intracelulares
■
Resulta na indução da síntese de
proteínas anti-inflamatórias como anexina
A1 e IL-10.
Receptores Intracelulares
■
Torna-se capaz de penetrar no núcleo
celular no qual se liga a regiões promotoras
de genes, denominadas elementos
responsivos aos GCs - glucocorticoid
responsive elements (GRE).
Receptores Enzimáticos
■
A maioria dos fármacos que têm enzimas
como alvo agirá para inibir o
funcionamento normal dessas enzimas.
Receptores Enzimáticos
■
Inibir a função da enzima implica em:
■
■
Aumento na concentração do substrato, já que a
ação do catalisador foi removida.
Diminuição na concentração dos produtos da
atividade da enzima.
Receptores Carreadores de
Transporte
■
Alguns fármacos podem ligar-se a
proteínas plasmáticas ou de tecidos,
tornando-as farmacologicamente inativas
em seu estado conectado.
Receptores Enzimáticos
■
■
Aspirina inibe a ciclo-oxigenase.
Sildenafila inibe a fosfodiesterase-5.
Receptores Carreadores de
Transporte
■
Fármacos que se ligam a essas proteínas
carreadoras inibirão o funcionamento
normal dessas proteínas, competindo com
os substratos endógenos que deveriam ser
transportados pelas carreadoras em
questão.
Receptores Carreadores de
Transporte
■
Do ponto de vista farmacológico, essas
proteínas não constituem alvos verdadeiros
de fármacos, mas influenciam a
distribuição dos fármacos em questão.
Receptores Carreadores de
Transporte
■
■
ADTs e cocaína atuam como inibidores do
transportador de NA na membrana.
Omeprazol inibe a bomba de prótons na
mucosa gástrica.
Até a próxima semana!