Uma síntese eficiente para a reação de cicloadição
entre ftalimida-(CH2)n-azidas e alcinos terminais
Fernanda C.G. Barbosa1 e Ronaldo Nascimento de Oliveira2
Introdução
A reação de cicloadição 1,3-dipolar entre alcinos e
azidas é conhecida como a reação de Huisgen [1]. Em
geral, em condições térmicas entre 60-120oC, leva
horas ou dias, produzindo dois regioisômeros do tipo
1,2,3-triazólico (Esquema 1). Desde 2002, este
procedimento vem ganhando destaque na comunidade
química a partir dos trabalhos de Sharpless [2] e
Meldal [3], onde conseguiram com o uso de
catalisadores de cobre (I) a síntese regiosseletiva do
1,4-isômero. Este procedimento vem sendo aplicado
em diversos sistemas [4], com comprovada estabilidade
do grupo funcional 1,2,3-triazólico sob condições
reacionais severas, por exemplo, oxidantes [5].
Neste trabalho, pretendemos sintetizar derivados
1,2,3-triazólicos aplicando uma metodologia eficiente
utilizando CuI/DCM em atmosfera inerte de argônio.
Estes derivados foram desenhados estrategicamente
para formar uma sequência inédita na literatura entre os
blocos heterocíclicos ftalimida-triazol-benzoeterociclo.
Uma análise retrossintética nos leva aos seguintes
reagentes
de
partida:
brometo
propargílico,
benzoeterocíclos, anidrido ftálico e os aminoálcoois,
substâncias de fácil acesso comercial. Como motivação
para este trabalho, destacamos que isoladamente, estes
heterocíclos apresentam diversas atividades biológicas.
Materiais e métodos
Nesta fase do trabalho sintetizamos os reagentes de
partida, os alcinos (Esquema 1) com rendimentos entre
28-61%, e as azidas (Esquema 2) com rendimentos
entre 60-93% utilizando métodos conhecidos da
literatura. A reação de cicloadição 1,3-dipolar foi
realizada utilizando o sistema catalítico CuI/DCM
(Esquema 4).
Procedimento geral para a síntese de 1a-f: 1,5 mmol de
brometo propargílico foram adicionados à 1 mmol do
benzoeterocíclo em 5 mL de DMF, e 1 mmol de
K2CO3. A reação foi deixada sob agitação a
temperatura ambiente por 24h. Os compostos foram
purificados em coluna cromatográfica. Rendimetos
entre 28-61%. Foi realizado o ponto de fusão dos
respectivos
benzoeterocíclos
propargílicos
e
comparado com a literatura.
Procedimento geral para a síntese de 2a-c: 1,5 mmol de
NaN3 são adicionadas à 1 mmol das N-bromo-alquilftalimidas são adicionadas em 2,5 mL DMF. A mistura
foi deixada a 60oC sob atmosfera de argônio por 1820h. Depois da evaporação do solvente obteve-se um
sólido que após análise de IV (2100 cm-1) indicou a
formação do produto desejado. Rendimento bruto da
reação de 60-93%.
Procedimento geral para a síntese de 3a-f: 1 mmol da
ftalimida-azida 2a-c são adicionados à 1,5 mmol do
Alcino 3a-g em 5 mL de diclometano, 10 mol %
relativos ao substrato 3. A reação foi deixada sob
agitação durante 24h. Para a síntese do composto 3f, o
tempo de reação foi 5(cinco) dias. A mistura então foi
purificada em coluna cromatográfica com 5-30% de
acetato de etila em hexano.
Resultados e Discussão
Em nosso procedimento optamos por um sistema
simples, contendo 10% de iodeto de cobre (CuI) em
suspensão, em diclorometano na ausência de oxigênio.
A reação foi processada entre 1 e 2 para formação de
3a-g em rendimento de moderados a excelentes (4292%, Esquema 4). Durante esta reação também
testamos outro sistema Cu(OAc)2/ascorbato de
sódio/H2O/t-BuOH, mas os resultados não foram
reprodutíveis. Como exemplo, descreveremos a
caracterização do composto 3g (n = 4, R= COCH3). O
espectro de RMN 1H (500 MHz, CDCl3) mostra 1
quinteto em 1,72 ppm correspondendo a integral de 2
hidrogênios (2H) e outro quinteto em 1,96 ppm devido
a 2H, estes 4H correspondem ao grupo “-CH2CH2-”.
Em 2,66 ppm está o simpleto relativo a 3H do “-CH3”
carbonílico (-COCH3). Dois tripletos foram registrado
em 3,73 ppm (-CH2-Ntriazólico) e 4,56 ppm (-CH2Nftalimídico). Os hidrogênios aromáticos foram os
seguintes: 7,71 (2H), 7,83 (2H) e 8,04 (1H). Segundo
sua fórmula molecular C16H16N4O3 terá: Calc. C. 61,53;
H.5,16; N: 17,94 e encontramos C. 61,89; H.5,22; N:
17,64.
Conclusões
Concluímos que uma nova série de 1,2,3-triazóis
conjugados com ftalimidas foi preparada através de
________________
1. Aluna PIBIC, Curso de Licenciatura em Plena em Química, Universidade Federal Rural de Pernambuco, Campus Dois Irmãos. Rua Dom Manoel
de Medeiros, s/n, Recife, Pernambuco, CEP 52171-900, e-mail: [email protected]
2. Professor Adjunto do Departamento de Química, Universidade Federal Rural de Pernambuco, Campus Dois Irmãos. Rua Dom Manoel de
Medeiros, s/n, Recife, Pernambuco, CEP 52171-900, e-mail: [email protected]
Apoio financeiro: CNPq.
uma metodologia eficiente para a reação de cicloadição
1,3-dipolar. Os produtos obtidos tiveram de moderados
a bons rendimentos e foram todos caracterizados por
espectros de I.V., RMN e análise elementar.
O
O
OH
N
n
N3
1) HBr 48% /refluxo
N
2) NaN3 /DMF/K2 CO3
n
O
O
2a (n=2)
2b (n=3)
n = 2,3
O
O
Agradecimentos
Br
N
A FACEPE pelo apoio financeiro. Ao CNPq pela bolsa
PIBIC/UFRPE concedia a F.C.G.B. A Central
Analítica da UFPE e UFPB pela obtenção do espectro
de IV, RMN e análise elementar.
[1] Huisgen, R. Pure Appl. Chem., 1989, 61, 613.
[2] Rostovtsev, V. V.; Green, L. G.; Fokin, V. V.;
Sharpless, K. B. Angew. Chem., Int. Ed., 2002, 41,
2596.
[3] Tornøe, C. W.; Christensen, C.; Meldal, M. J. Org.
Chem., 2002, 67, 3057.
[4] Meldal, M.; Tornøe, C. W. Chem. Rev., 2008, 108,
2952.
[5] de Oliveira, R.N.; Sinou, D.; Srivastava, R.M.
Synthesis, 2006, 467.
R2
1
N
+
N
N+
1,4-regioisômero
N
R1
60-120oC
-
R1
N
4
+
R2
:N
N
5
N
R1
1
1,5-regioisômero
N
Esquema 1: Reação de Huisgen
N
DMF
60oC / 24h
Br
Z
Z
NK
O
Y
X
N
O
DMF, r.t.
24h
X
X= NH, S, O
Z= C, N
Y= H, SH
Y
1a-e
1a: Z= C, Y= H, X= NCH2C=CH
1b: Z= C, X= NH, Y= SCH2C=CH
1c: Z= C, X= S, Y= SCH2C=CH
1d: Z= C, X= O, Y= SCH2C=CH
O
N3
DMF/K2CO3
4
O
O
2c (n=4)
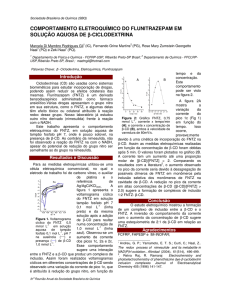
Esquema 3. Síntese das ftalimida-azidas (2a-c)
O
Referências
R2
NaN3
N
4
1e: Z= N, X= NCH2C=CH
N
O
1f
Esquema 2. Síntese dos benzoeterociclos propargílicos
(1a-f)
N3
N
n
O
CuI/DCM
20-24h
R1
N
N
N
2b (n=3)
3c (77%)
3g (92%)
2c (n=4)
3a (49%)
3b (60%)
3d (68%)
3e (49%)
3f (42%)
Esquema 4. Síntese dos 1,2,3-triazóis (3a-g)
R2