SÍNTESE E CARACTERIZAÇÃO DA ACETONA
1- INTRODUÇÃO
O produto formado a partir da oxidação de álcoois depende do agente
oxidante empregado e da natureza do álcool de partida (álcool primário,
secundário ou terciário).
Álcoois primários, por oxidação controlada, produzem aldeídos. A oxidação
é feita com uma solução de dicromato de potássio (K 2Cr2O7) em água e meio
ácido. Uma vez que aldeídos são facilmente oxidados aos ácidos carboxílicos
correspondentes, deve-se remover o mais rápido possível o aldeído que vai sendo
formado, através de uma destilação.
RCH2OH
+
O
H+
Cr2O72-
R
Álcool primário
H
+
Cr 3+
Aldeído
Uma oxidação mais energética utilizando uma solução aquosa de
permanganato de potássio com aquecimento e meio ácido produz o ácido
carboxílico correspondente.
RCH2OH
Álcool primário
+
KMnO4
H+
RCOO- K+
+
Sal do Ácido
Carboxílico
H+
MnO2
+
KOH
(precipitado
marrom)
RCOOH
Os álcoois secundários sofrem oxidação, produzindo cetonas. Como agente
oxidante normalmente se utiliza uma solução de K 2Cr2O7 + H2SO4 (mistura
sulfocrômica). Pode-se utilizar, alternativamente, CrO3 em ácido acético glacial,
CrO3 em piridina ou ainda uma solução de KMnO4 a quente.
OH
R C R1
+
K2Cr2O7
O
H2SO4
R
H
Álcool Secundário
R1
Cetona
+
Cr 3+
+
H2O
(cor verde)
Os álcoois terciários não se oxidam em condições alcalinas ou em presença
de ácido. Estes álcoois são rapidamente desidratados formando alcenos, e estes
então são oxidados.
2- METODOLOGIA
A acetona será preparada a partir do álcool isopropílico, através de uma
reação de oxidação. Esta reação poderá ser observada pela mudança de
coloração, onde o dicromato de potássio (K2Cr2O7) é alaranjado e se reduz a Cr+3,
de coloração verde.
OH
H3C
CH3
O
Na2Cr2O7
H3C
CH3
H2SO4
isopropanol
acetona
Sendo a acetona um solvente volátil, o refluxo dificulta a saída de seus
vapores, à medida que esta é sintetizada (Figura 1).
A purificação de líquidos, como é o caso da propanona, pode ser feita
através da destilação fracionada, observando-se a temperatura de ebulição deste
solvente (56C).
Figura 1: Aparelhagem para reação sob refluxo.
A maior parte das reações de caracterização de cetonas baseia-se na
formação de um derivado, a partir da reação de condensação com aminas
substituídas. As reações ocorrem entre o grupo carbonila e o grupo -NH2 da amina
substituída (serve também para identificar aldeídos). O nucleófilo, que nesta
experiência será a 2,4-dinitrofenilidrazina 1, ataca o carbono carbonílico em 2,
formando compostos cristalinos (3) de ponto de fusão bem definidos e, portanto,
úteis para a identificação e caracterização.
O2N
O
+
R
2
R1
H2N
NO2
R
N
H
O2N
-H2O
1
N
R1
NO2
N
H
3
3- PROCEDIMENTO EXPERIMENTAL
3.1- SÍNTESE DA ACETONA:
Em um balão de 3 bocas de 500 mL, coloque 7,5 g de álcool isopropílico e
30 mL de água. Adapte um funil de adição em uma das bocas do balão, e na outra
um condensador ascendente. Coloque alguns fragmentos de porcelana porosa no
interior do balão.
Paralelamente, em um béquer, prepare uma solução oxidante dissolvendo
14,5 g de K2Cr2O7 em 75 mL de água, sobre a qual são adicionados,
cautelosamente e vagarosamente, 22,5 g de H2SO4 concentrado. Resfrie a
solução e transfira-a para o funil de adição adaptado ao balão.
Adicione lentamente a mistura oxidante ao álcool contido no balão, de tal
forma que se mantenha a ebulição no balão sem que haja destilação. Quando
toda a mistura oxidante tiver sido adicionada, remova o funil de adição e tampe
esta boca do balão (cuidado ao trabalhar com a solução sulfocrômica. Evite o
contato com a pele, pois pode provocar queimaduras). Refluxe suavemente por 15
minutos.
3.2- SEPARAÇÃO E PURIFICAÇÃO DA ACETONA:
Monte um aparelho de destilação simples e destile vagarosamente,
recolhendo todo produto até uma temperatura de 90C. Despreze o resíduo do
balão de destilação. Receba o destilado na proveta imersa em cuba de água
gelada para evitar perdas de acetona por evaporação.
Transfira o destilado contendo acetona para um balão de destilação de
fundo redondo de 50 mL e adapte uma coluna de destilação para o fracionamento.
Coloque fragmentos de porcelana porosa no balão e destile, vagarosamente,
recolhendo o destilado em água gelada. O ponto de ebulição da acetona é 56 oC.
3.3- TESTE DE CARACTERIZAÇÃO DO GRUPO CARBONILA:
Dissolva 1 mL do composto carbonilado em 5 mL de etanol e adicione 1 mL
de uma solução alcoólica de 2,4-dinitrofenilidrazina. Se não se formar um
precipitado imediatamente, dilua com um pouco de água. Colete o derivado e
proceda à recristalização. Determine o seu ponto de fusão.
4- QUESTIONÁRIO
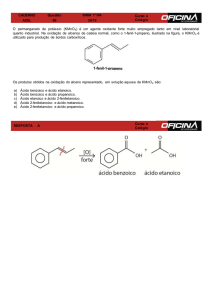
1- Quais os produtos formados na reação de oxidação com K2Cr2O7/H+ dos
seguintes compostos:
a) 1-propanol
b) 2-pentanol
c) 1,4-hexanodiol
d) ácido 4hidroxioctanóico
2- Na oxidação de um álcool primário à aldeído, por quê o produto formado deve
ser removido da reação por destilação?
3- Justifique o fato de que a oxidação de álcoois secundários resulta em melhores
rendimentos do que a oxidação de álcoois primários:
4- Escreva as equações balanceadas para a oxidação do formaldeído e
propionaldeído com KMnO4, em solução neutra e em solução ácida:
5- Desenhe os aparelhos utilizados nesta experiência para:
a) a síntese da acetona (qual a função do funil de adição?);
b) refluxo (explique seu funcionamento).
6- O que é um derivado? O que se pretende nesta experiência com a formação do
derivado?
7- Qual o objetivo de se determinar o ponto de fusão do derivado de 2,4dinitrofenilidrazina, nesta experiência?
8- Nesta experiência, qual o objetivo de se fazer uma destilação simples e depois
uma destilação fracionada?
9- Além da oxidação de álcoois secundários, escreva outros dois métodos para a
preparação de cetonas:
10- Porque a indústria emprega a técnica de desidrogenação catalítica na
oxidação de álcoois primários e secundários?