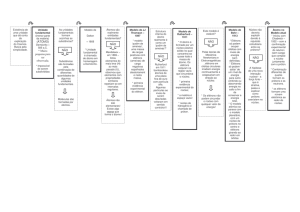
Átomos, moléculas e da Tabela Periódica.
Descrição: Construindo um Composto usando camadas de eletrons
Questão 1:
Um elemento (X) tem a configuração eletrônica
1s22s22p63s23p3. Qual é a fórmula do composto mais
provável que este elemento irá formar com Ca?
Ca2X3
CaX2
Ca3X2
CaX
Ca2X
Descrição: Configuração de elétrons do estado fundamental
Questão 2:
Qual é a configuração de elétrons do estado fundamental para Fe3+?
(Ar)183d5
(Ar)183d34s2
(Ar)183d44s
(Ar)183d64s2
(Ar)183d6
Descrição: Princípio da Exclusão de Pauli
Questão 3:
A Exclusão de Pauli princípio exige que:
A velocidade de toda a radiação eletromagnética é igual à velocidade da luz.
Não há dois elétrons no mesmo átomo pode ter o mesmo conjunto de quatro números
quânticosn, l, ml,e ms.
Uma partícula de massa m, movendo-se com uma velocidade v, tem um comprimento de onda λ=hmv.
Eletrons degenerado em orbitais atômicos têm spin paralelo.
Se a posição de um Eletro for conhecido com exatidão, a sua velocidade pode não ser simultaneamente
conhecido com precisão.
Descrição: Solubilidade dos sais da água
Questão 4:
Qual dos seguintes sais não é solúvel em água?
SrCl2
Rb2SO4
NaIO3
K2CO3
BaCO3
Descrição: Compostos com cores
Questão 5:
Qual dos seguintes compostos que você esperaria ter cor (não branca)?
Cu(NO3)2
Sc2O3
CdCl2
HgS
RhF3
SrO
PdBr2
AlCl3
RaBr2
Tl2S
Descrição: Elétrons desemparelhados na configuração de elétrons do Estado terroso
Questão 6:
Os elementos que estão no quarto período da tabela periódica.
Ca, V, Co, Zn, As
Dos listados, os que têm elétrons desemparelhados na configuração de eletrons do estado fundamental
são:
Zn, Ca, e As
V, Co, e As
Ca, V, e Co
V, Co, e Zn
Ca, Zn, e As
Descrição: Preenchendo 3d Shell
Questão 7:
Qual dos seguintes é o átomo com o menor número atômico que preenche totalmente
3d shell?
Cu
Ar
Zn
Cr
Kr
Descrição: Denominações do Estado Quântico
Questão 8:
n=3, l=2, ml=−2
II n=3, l=0, ml=−1
III n=3, l=1, ml=& ;0
IV n=3, l=3, ml=−2
V n=3, l=2, ml=& ;0
I
Das designações estado quântico listados acima, que não descreve um estado permitido para um elétro
em um átomo?
II e V
I e II
III e IV
II e IV
IeV
Descrição: Nomes dos Ácidos
Questão 9:
Combine os seguintes diagramas de Lewis para o nome correto, selecionando o nome correspondente às
letras abaixo.
A:
B:
C:
A
D:
B
C
D
Tipos de
Descrição: ligações em
compostos
Questão 10:
Selecione uma das seguintes moléculas que se encaixa na descrição.
A:
CS2
B:
RaCl2
C:
HCN
D:
F2
E:
C2Cl4
(a)
tem apenas uma ligação pi.
(b)
tem duas ligações duplas.
(c)
tem uma ligação tripla.
(d)
exibe ligação iónica.
(e)
consiste de moléculas polares, discretas, à temperatura ambiente.
(f)
tem uma ligação simples apolar.
(g)
é uma temperatura ambiente de um sólido.
Descrição: Estrutura de Lewis
Questão 11:
Na melhor estrutura de Lewis para
ICI3 , qual é a carga na forma em I?
+2
−1
0
−2
+1
Descrição: Ligações Polares
Questão 12:
Qual dos seguintes não é polar, mas contém ligações polares?
H2O
HCl
SO2
SO3
NO2
Descrição: estrutura geométrica
Questão 13:
Qual é a estrutura geométrica da molécula
trigonal bipiramidal
quadrado plano
tetraédrico
trigonal plano
piramidal trigonal
PF3?
Descrição: Formar ligações com híbridos orbitais atômicos
Questão 14:
Em qual uma das seguintes moléculas faz o uso átomo central
formação de ligações?
sp2 orbitais atômicos híbridos na
H2S
NH3
SO2
Cl2O
CS2
Descrição: Imagens de orbitais híbridos
Questão 15:
Indique o nome de cada um dos orbitais híbridos comumente utilizados abaixo.
Descrição: Determine as Séries
Questão 16:
Se o eletro em um hidrogênio atômico vai do n=6 para o n=1 em nível de energia , a radiação emitida
em cada séria de linha no espectro de um hidrogênio atômico?
Lyman
Balmer
Pfund
Brackett
Paschen
Descrição: Energia necessária para remover o Eletro do seu estado fundamental
Questão 17:
A quantidade de energia necessária para remover o eletro de um Be3+ ion no seu estado
fundamental é o número de vezes maior do que a quantidade de energia necessária para
remover o eletro de um H átomo em seu estado fundamental?
[No.]
Descrição: Segunda Linha mais intensa na Série Lyman
Questão 18:
Click on the image and select the highlighted arrow that represents the second most intense
line in the "Lyman Series" for a given electron.
Note: There are 5 choices.
Descrição: Números quânticos em Séries
Questão 19:
Quais são os valores de nH e nLpara a linha fourth nas series Brackett no especto de hidrogénio
atómico?
nL =
[No.]
nH =
[No.]
Descrição: Propriedades da Onda
Questão 20:
Qual das seguintes propriedades de onda é proporcional à energia para a radiação eletromagnética?
Velocidade
Numero de Onda
Amplitude
Comprimento da Onda
Período
Descrição: Magnitude de energia liberada entre níveis de energia
Questão 21:
É liberada a energia entre os níveis de energia com n=3 e n=4 do que a energia liberada entre os níveis
de energia com n=8 e n=9, para o átomo de hidrogénio.
Digite a sua resposta com duas casas decimais.
[No.] vezes maior
Descrição: Nomeando Compostos Inorgânico
Questão 22:
Combine cada um dos itens numerados na lista com os números nos menus :
iron(I
II)
hydro
xide
1.
2.
3.
4.
5.
6.
7.
KHSO3
Fe(OH)2
Cu2CO3
Fe(OH)3
CrO
CuCO3
(NH4)2C2O4
potass
ium
hydro
gen
sulfat
e
coppe
r(I)
carbo
nate
coppe
r(II)
carbo
nate
ammo
nium
oxalat
e
iron(I
I)
hydro
xide
chromiu
m(II)
oxide
Descrição: Nome da Fórmula Dada
Questão 23:
Escolha a fórmula correta para o estanho (II) de sulfato.
SnSO3
TiS
SnS
TiS2
SrSO3
Descrição: As soluções que conduzem eletricidade
Questão 24:
Uma solução aquosa do que um dos seguintes compostos não irá conduzir eletricidade?
Ba(OH)2
CH3OH
SrBr2
Ca(NO3)2
AgClO4
Descrição: Mais pobre condutor elétrico
Questão 25:
No estado líquido, qual das seguintes é a mais pobre condutor elétrico?
NaI
CBr4
SrSO3
SrBr2
KCN
Descrição: Classifique compostos como Iônicos ou Molecular
Questão 26:
Classificar cada composto como iônico ou molecular.
Rb2S=
H2Se=
NH3=
CCl4=
BaI2=
OF2=
BrF5=
SrS=
CO=
Descrição: Metais de transição
Questão 27:
Selecione cada elemento que é um metal de transição.
Gd
Pt
Rb
Zn
P
Sr
Ag
Mg
Hg
U
Li
Th
Mo
Al
Fe
Cu
Sb
Mn