MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
MINISTÉRIO DA SAÚDE
SECRETARIA DE ASSISTÊNCIA À SAÚDE
CONSULTA PÚBLICA Nº 1, DE 18 DE JULHO DE 2001
DO 140-E, de 20/7/01
O Secretário de Assistência à Saúde, no uso de suas atribuições legais, adota a
seguinte Consulta Pública e determina a sua publicação, considerando:
a necessidade de adotar mecanismos capazes de permitir o acesso dos pacientes
usuários do Sistema Único de Saúde - SUS a medicamentos considerados excepcionais;
a necessidade de estabelecer Protocolos Clínicos e Diretrizes Terapêuticas para as
diversas patologias em que estejam indicados tratamentos com os medicamentos já citados, que
contenham critérios de diagnóstico e tratamento, observando ética e tecnicamente a prescrição
médica, racionalizem a dispensação dos medicamentos preconizados para o tratamento das
doenças, regulamentem suas indicações e seus esquemas terapêuticos e estabeleçam mecanismos
de acompanhamento de uso e de avaliação de resultados, garantindo assim a prescrição segura e
eficaz;
a necessidade de que os Protocolos e Diretrizes Terapêuticas a serem
estabelecidos sejam fruto de consenso técnico e científico, que sejam formulados dentro de
rigorosos parâmetros de qualidade, precisão de indicação e posologia, que sejam respaldados por
estudos clínicos de fase 3, meta-análises de ensaios clínicos nacionais e/ou internacionais, e
a necessidade de se promover ampla discussão destes Protocolos e Diretrizes,
possibilitando a participação efetiva da comunidade técnico científica, sociedades médicas,
profissionais de saúde e gestores do Sistema Único de Saúde na sua formulação, resolve adotar a
presente Consulta Pública, determinando sua publicação. Assim:
Art. 1º - Submete à consulta pública o Protocolo Clínico e Diretrizes Terapêuticas
- Acne - Isotretinoína oral o correspondente Termo de Consentimento Informado contidos,
respectivamente, em seus Anexos I e II.
Art. 2º - Estabelece o prazo de 60 (sessenta) dias, a contar da data da publicação
desta Consulta, para que sejam apresentadas sugestões, devidamente fundamentadas, relativas à
proposta de Protocolo Clínico e Diretrizes Terapêuticas de que trata o Artigo 1º.
§ 1º - As sugestões deverão ser encaminhadas por escrito e em meio magnético
para o endereço - Secretaria de Assistência à Saúde - Departamento de Sistemas e Redes
Assistenciais/DSRA - Assessoria Farmacêutica - Ministério da Saúde, Esplanada dos Ministérios
- Bloco G - sala 912 - CEP 70.058-900 - Brasília- DF, ou para o seguinte endereço eletrônico [email protected];
§ 2º - As sugestões enviadas deverão, obrigatoriamente, estar fundamentadas por:
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
a - Estudos Clínicos de fase 3 - realizado no Brasil ou exterior;
b - Meta-análises de Ensaios Clínicos.
§ 3º - As sugestões deverão ser acompanhadas por cópia dos documentos que as
fundamentem, conforme previsto no § 2°, sendo que no caso de publicações estrangeiras, as
mesmas deverão ser enviadas na versão original, sem tradução.
Art. 3º - Informa que o Departamento de Sistemas e Redes Assistenciais/DSRA
procederá à avaliação das proposições apresentadas, elaborando a versão final consolidada do
Protocolo Clínico e Diretrizes Terapêuticas ora submetido à Consulta Pública, para que, findo o
prazo estabelecido, seja publicado em ato da Secretaria de Assistência à Saúde/SAS/MS e entre
em vigor em todo o território nacional.
RENILSON REHEM DE SOUZA
ANEXO I
PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS
ACNE
Medicamento: Isotretinoína
1. Introdução:
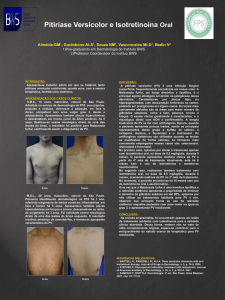
A acne vulgar ou juvenil é uma das dermatoses mais freqüentes. Seu tratamento
justifica-se tanto pela possibilidade de evitar lesões cutâneas permanentes quanto por evitar o
aparecimento ou agravamento de transtornos psicológicos, oriundos do abalo à auto-estima
ocasionado pelas lesões, que freqüentemente acometem face e tronco(1 - 3). É uma doença
originada por queratinização anômala do infundíbulo folicular associada à hipersecreção sebácea.
Com a retenção sebácea há proliferação de bactérias e formação de processo inflamatório que dá
origem às lesões(4). É classificada como não-inflamatória e inflamatória e subdividida em
graus(1).
Acne não-inflamatória: Acne comedônica (grau I)
Acne inflamatória: Pápulo-pustulosa (grau II)
Nódulo-cística (grau III)
Conglobata (grau IV)
Fulminante (grau V)
A isotretinoína é um análogo sintético da vitamina A. Seu exato mecanismo de
ação não é conhecido. Sabe-se que diminui o tamanho das células das glândulas sebáceas,
aumenta a separação das células foliculares pilossebáceas e diminui a produção de sebo. Afeta o
processo de queratinizacao, diminui o número de precurssores da queratina, torna os
desmossomos menores e menos desenvolvidos; o estrato córneo se torna menos organizado e
mais fino pela perda de camadas superficiais(5). Por esses efeitos, reduz significativamente o
crescimento do Propionibacterium acnes nas lesões(6).
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
2. Critérios de Inclusão no Protocolo(6-7):
Devido ao grande potencial teratogênico e às várias reações adversas possíveis, o
tratamento com Isotretinoína oral para acne deve ser restrito aos casos mais graves e refratários a
outras medidas terapêuticas, bem como àqueles pacientes em que se espera ótima adesão aos
cuidados necessários durante o tratamento.
Para segurança dos pacientes e para um melhor controle do gestor do SUS, este
deverá indicar Centros de Referência aos quais será limitada a prescrição e acompanhamento do
uso da isotretinoína, em conformidade com o presente Protocolo.
Para ser incluído neste Protocolo de tratamento o paciente deverá apresentar pelo
menos um dos itens (2.1 e 2.2) abaixo e necessariamente o item 2.3:
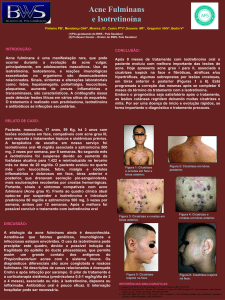
2.1 Acne nodulocística (grau III);
2.2 Acne conglobata (grau IV);
2.4 Ausência de resposta satisfatória ao tratamento convencional, incluindo
antibióticos sistêmicos administrados por um período de pelo menos 02 (dois) meses.
3.1. Classificação CID 10:
L70.0 (Acne Vulgar);
L 70.1 (Acne conglobata), e
L70.8 Outras formas de Acne.
4. Critérios de exclusão:
4.1. Gestação;
4.2. Hipersensibilidade à isotretinoína ou parabenos (conservante na formulação);
4.3. Amamentação;
4.4 Insuficiência hepática;
4.5. Crianças (menores de 15 anos). Esses casos, quando requererem tratamento,
só poderão ser tratados em Serviços Universitários de Referência.
4.6. Pacientes com alteração no metabolismo das gorduras, expressa no nível
sérico de triglicerídeos acima de 800 mg/dl, e nível sérico de colesterol acima de 250 mg/dl por
mais de 06 anos (8).
4.7. Paciente com história de pancreatite
5. Situações especiais:
5.1. Em mulheres com possibilidade de gravidez o uso é contra-indicado, exceto se
TODAS as condições a seguir forem satisfeitas (7):
5.1.1 Apresentar lesões císticas severas, refratárias à terapia usual;
5.1.2 Mostrar-se confiável para compreender e executar as orientações feitas;
5.1.3 Tenha recebido orientações verbais e por escrito sobre os riscos do uso de
isotretinoína durante a gestação e riscos de possíveis falhas dos métodos contraceptivos
utilizados;
5.1.4 Ter teste sorológico negativo para gravidez nas duas semanas anteriores ao
início da terapia;
5.1.5 Iniciar o tratamento no segundo ou terceiro dia do ciclo menstrual regular;
5.1.6 Ter assinado termo de consentimento informado.
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
5.2. Outras situações especiais:
Devido aos possíveis efeitos adversos da droga, a relação entre o risco e o
benefício deve ser cuidadosamente avaliada nos pacientes com predisposição a desenvolver
alterações nos seguintes órgãos ou sistemas abaixo:
5.2.1. Sistema nervoso central: fadiga, cefaléia, pseudotumor cerebral (hipertensão
intracraniana), alterações visuais e depressão;
5.2.2. Pele e mucosas: ressecamento de pele e mucosas (xerose, conjuntivite,
queilite, uretrite); fotossensibilidade;
5.2.3. Fígado: elevação de enzimas hepáticas e hepatite medicamentosa;
5.2.4. Trato gastrointestinal: boca seca, náuseas, vômitos e dor abdominal, doença
inflamatória intestinal, sangramento e inflamação gengival;
5.2.5. Trato genitourinário: proteinúria, leucocitúria, hematúria;
5.2.6. Sistema musculoesquelético: artralgia, dor muscular e hiperostose;
52.7. Olhos: conjuntivite, opacidade corneana, neurite óptica, fotofobia,
intolerância a lentes de contato e diminuição da visão noturna;
5.2.8. Sistema hematopoiético: anemia, leucopenia, trombocitopenia e
trombocitose;
5.2.9. Sistema endócrino: Pacientes com alterações no metabolismo lipídico,
expressa por triglicerídeos séricos acima de 200 mg/dl , e nivel sérico de colesterol acima de 250
mg/dl devem ser seguidos, do ponto de vista clínico e laboratorial com avaliações trimensais.
5.2.10. Possibilidade de interações medicamentosas em usuários de:
carbamazapina: diminuição do nível sérico de carbamazapina; tetraciclina e minociclina:
aumentam a incidência de pseudotumor cerebral e papiledema; Vitamina A: potencializa os
efeitos tóxicos da isotretinoína; Álcool: reação semelhante ao dissulfiran.
6. Administração(6,7):
A dose varia de 0,5 a 2 mg/kg/dia, em uma ou dividida em duas tomadas diárias,
ingerida(s) com os alimentos durante a refeição, por 15 a 20 semanas. Dose preconizada 0,5 a 1,0
mg/kg/dia (dose total cumulativa de 120 a 150 mg/kg).
Pacientes com lesões muito avançadas ou preponderantemente no tronco podem
receber doses de até 2 mg/kg/dia.
A dose pode ser ajustada conforme a resposta clínica e a ocorrência de efeitos
adversos.
Se o número total de lesões císticas for reduzido em mais de 70% durante o
tratamento, este pode ser interrompido.
Um segundo período de tratamento pode ser iniciado 2 meses após a interrupção
do anterior se as lesões persistirem ou houver recorrência de lesões severas.
7. Monitorização do tratamento/cuidados:
A resposta terapêutica esperada é a redução do número e da gravidade das lesões,
em graus variáveis de intensidade, que na grande maioria dos casos chegam à remissão completa.
Em mulheres com possibilidade de engravidar que preencham as condições acima,
recomenda-se o uso de dois métodos anticoncepcionais desde 01 (um) mês antes do tratamento
até 1 mês após seu final.
Não doar sangue até 01 (um) mês após o término do tratamento.
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Dosar antes do início do tratamento: enzimas hepáticas (AST, ALT, LDH e
Fosfatase alcalina), triglicerídios, glicemia, hemograma, plaquetas, provas de coagulação.
Repetir após 30 (trinta) dias e a cada 03 (três) meses de tratamento: triglicerídios e
transaminases hepáticas.
Realizar inspeção oftalmológica antes do tratamento e vigiar o aparecimento de
alterações visuais.
A secura dos lábios e das mucosas dos olhos pode ser prevenida e tratada com o
uso de umectantes labiais e colírios apropriados.
8. Consentimento Informado:
É obrigatória a cientificação do paciente, ou de seu responsável legal, dos
potenciais riscos e efeitos colaterais relacionados ao uso do medicamento preconizado neste
protocolo, o que deverá ser formalizado por meio da assinatura de Termo de Consentimento
Informado, de acordo com o modelo em anexo.
Bibliografia
1. Sampaio S, Rivitti EA. Dermatologia 2a ed, São Paulo, Artes Médicas 2000:
291-300.
2. Minelli L, Neme LC. Acne Vulgar - Como Diagnosticar e Tratar. Rev Bras
Med. 1997; 54.
3. Layton AM, Seukeran D, Cunliffe WJ. Scarred for life? Dermatology 1997; 195
(1):15-21.
4. Orfanos C, Zouboulis C, Almond-roesler B, Geilen C. Current Use and Future
Potential Role of Retinoids in Dermatology. Drugs 1997; 53 (3):358-88.
5. Gollnick HM, Zouboulis CC, Akamatsu H, Kurokawa I, Schulte A.
Pathogenesis and Pathogenesis related Treatment of Acne. J Dermatol 1991; 18: 489-99.
6. USP DI 2000 - Information for Health Care Proffessional. 20ed. Englewood.
Micromedex Inc. 2000. v.1
7. Drug Facts and Comparisons 2000. 54ed. St.Louis. Facts and Comparisons,
2000.
8.Giannini SD. Aterosclerose e Dislipidemias: Clínica e Terapêutica: Fundamentos
Práticos. Editora BG 1998; 6:27. E 4:16.
9. Marsden JR. Lipid Metabolism and Retinoid Therapy. Pharmac. Ther. 1989;
40(1): 55-65
10. Marsden JR. Hyperlipidaemia due to Isotretinoin and Etretinate: Possible
Mechanisms and Consequences. British Journal of Dermatology 1986; 114: 401-7
11. Lestringant GG et al. Variations in Lipid and Lipoprotein Levels during
Isotretinoin Treatment for Acne Vulgaris with Special Emphasis on HDL-Colesterol.
International Journal of Dermatology 1997; 36: 859-62
12. McCarter TL et al. Marked Hyperlipidaemia and Pancreatitis Associated with
Isotretinoin Therapy. The American Journal of Gastroenterology 1992; 87: 12
ANEXO II
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
TERMO DE CONSENTIMENTO INFORMADO
ISOTRETINOÍNA
Eu _________________________________________(nome do paciente), abaixo
identificado e firmado, declaro ter sido informado claramente sobre todas as indicações,
benefícios, cuidados e riscos relacionados ao uso do medicamento ISOTRETINOÍNA para o
tratamento de acne, principalmente sobre o risco de defeitos graves sobre o bebê em caso de
gravidez durante ou até um mês após o tratamento. Os termos médicos foram explicados e todas
as minhas dúvidas foram resolvidas pelo médico_____________________(nome do médico que
prescreve).
Expresso também minha concordância e espontânea vontade em submeter-me ao
referido tratamento, assumindo a responsabilidade e os riscos pelos eventuais efeitos indesejáveis
decorrentes.
Declaro estar ciente de que o uso deste remédio está indicado somente nos casos
mais graves de acne (nodulocística ou conglobata que não melhoraram com outros tratamentos,
inclusive com antibióticos via oral).
Estou ciente dos seguintes benefícios esperados com este tratamento:
1. Redução no tamanho, gravidade e número das lesões, podendo ocorrer
desaparecimento destas (em 80 a 90% dos casos).
2. Possibilidade (cerca de 60%) de as lesões não mais retornarem após o término
do tratamento.
Para mulheres em idade fértil:
Ao assinar o termo, a paciente se compromete definitivamente a adotar todas as
medidas descritas no documento, incluindo cuidados a serem tomados antes, durante e após o
término do tratamento.
Um novo termo de consentimento deverá ser preenchido e assinado apenas se a
paciente iniciar um novo ciclo de tratamento ou passar a fazer uso de outra substância retinóide
sistêmica.
1. Fui informada que esta medicação tem altíssimo risco de causar defeitos
congênitos graves no corpo do bebê se for utilizado pela mãe durante a gravidez. Já nasceram
mais de 250 bebês com graves deformações na face, orelhas, coração ou sistema nervoso devido
ao uso destas substâncias. Este risco persiste por até um mês após ter parado de usá-la.
2. Realizei um teste de gravidez de alta sensibilidade (que detecta a gravidez desde
o primeiro dia de atraso menstrual). Data do teste: ________________ Resultado:
______________ (anexar cópia do exame)
3. Fui orientada a aguardar o início da próxima menstruação para começar o
tratamento no segundo ou terceiro dia do ciclo menstrual.
4. Fui orientada a utilizar método anticoncepcional altamente eficaz. Método em
uso:..._______________________ Data de início: ______________________
5. Fui orientada a comunicar ao médico a ocorrência de qualquer reação adversa,
problema ou dúvida quanto ao método anticoncepcional.
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
6. Caso venha a engravidar no período descrito no item 1, comprometo-me a parar
imediatamente o tratamento e comunicar ao médico.
Declaro ter sido orientado(a) sobre os possíveis efeitos colaterais:
1. Congênitos: Altíssimo risco de defeitos congênitos graves sobre o bebê em caso
de gravidez enquanto estiver usando o remédio e até 02 (dois) meses após seu uso;
2. Neurológicos: fadiga, cefaléia, hipertensão intracraniana, alterações visuais e
depressão;
3. Dermatológicos: ressecamento de pele e mucosas e fotossensibilidade;
4. Hepáticos: hepatite medicamentosa;
5. Gastrointestinais: náuseas, vômitos e dor abdominal, doença inflamatória
intestinal;
6. Renais: proteinúria, leucocitúria e hematúria;
7. Musculoesqueléticos: artralgia, dor muscular e hiperostose;
8. Oculares: conjuntivite, opacidade corneana, neurite óptica, fotofobia,
intolerância a lentes de contato e diminuição da visão noturna;
9. Hematológicos: anemia, leucopenia, trombocitopenia e trombocitose;
10. Endocrinológicos: hipertrigliceridemia, diminuição do colesterol HDL e
hiperglicemia.
Declaro ter sido orientado (a) a:
1. Comparecer às consultas periódicas conforme agendadas e a realizar os exames
e avaliações solicitados pelo médico.
2. Não usar outros remédios sem orientação médica, principalmente: vitamina A,
carbamazepina, tetraciclina e minociclina.
3. Não doar sangue durante e até 01 (um) mês após o término do tratamento.
Fui informado (a) de que este produto somente pode ser utilizado por mim e não
pode ser passado para nenhuma outra pessoa.
Estou ciente que posso suspender este tratamento a qualquer momento, sem que
este fato implique em qualquer forma de constrangimento entre meu médico e eu, sendo que ele
se dispõe a continuar meu tratando em quaisquer circunstâncias.
Assim, o faço por livre e espontânea vontade e por decisão conjunta entre meu
médico e eu.
Local: _____________________ Data: ___________
Paciente:
Nome: ______________ Sexo: _____ Data de nascimento: __
Estado civil____________________ Identidade __________
Profissão: ______________________________________________
Endereço: ________________ Cidade: _______ Telefone: ____
Responsável legal (quando for o caso):
Nome: _____________ Sexo: ____ Data de nascimento: ___
Estado civil__________________ Identidade _______________
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Profissão: _________________________________________
Endereço: ___________ Cidade: __________ Telefone: ____
Médico:
Nome: ________________________________ CRM: ________
Endereço: ________________ Cidade: _______ Telefone: ___.
____________________________ Assinatura e carimbo
____________________ Assinatura do paciente ou seu responsável legal
do
médico
Obs.:
1. O preenchimento completo deste Termo de Consentimento é imprescindível
para o fornecimento da medicação.
2. Este Termo de Consentimento ficará arquivado na farmácia responsável pela
dispensação dos medicamentos.
(Of. El. n.º 140/2001)