3º Bimestre
Química
Autor: Pedro L. S. Dias
Química
Química
SUMÁRIO
UNIDADE III – Química Inorgânica ........................................................................... 5
Capítulo 1..................................................................................................................... 5
1.1 Soluções .............................................................................................................. 5
1.2 Solubilidade......................................................................................................... 8
1.3 Coeficiente de solubilidade e Curva de solubilidade ........................................ 10
1.4 Unidades de concentração ................................................................................. 13
Exercícios Resolvidos: .............................................................................................. 26
Exercícios de Fixação: .............................................................................................. 32
Capítulo 2................................................................................................................... 40
2.1 Diluição e concentração de soluções ................................................................. 40
2.2 Misturas de soluções de mesmo soluto ............................................................. 43
2.3 Mistura de soluções de solutos diferentes sem reação química ........................ 43
2.4 Mistura de soluções de solutos diferentes com reação química ........................ 45
2.5 Propriedades Coligativas ................................................................................... 46
Exercícios Resolvidos: .............................................................................................. 56
Exercícios de Fixação: .............................................................................................. 62
Capítulo 3................................................................................................................... 68
3.1 Introdução à Termoquímica .............................................................................. 68
3.2 Termoquímica ................................................................................................... 68
3.3 Calorimetria....................................................................................................... 70
3.4 Entalpia.............................................................................................................. 72
3.5 Gráficos de Reações Termoquímicas ............................................................... 74
3.5 Equações Termoquímicas ................................................................................. 74
3.6 Entalpia Padrão (H°) e Entalpia de Formação (Hf) ........................................... 75
3.7 Variação de Entalpia a partir de Hf e H° ........................................................... 76
Exercícios Resolvidos: .............................................................................................. 79
Exercícios de Fixação: .............................................................................................. 84
Capítulo 4................................................................................................................... 90
4.1 Energia de Ligação ............................................................................................ 90
4.2 Lei de Hess ........................................................................................................ 92
4.3 Espontaneidade das Reações Termoquímicas ................................................... 95
4.4 Os alimentos e sua energia ................................................................................ 96
Exercícios Resolvidos: .............................................................................................. 99
Exercícios de Fixação: ............................................................................................ 105
UNIDADE IV –Química Orgânica ........................................................................... 110
Capítulo 1................................................................................................................. 110
1.1 Compostos de Função Mista ........................................................................... 110
Química
1.2 Séries Orgânicas .............................................................................................. 111
1.3 Teorias Ácido – Base ...................................................................................... 112
1.4 Acidez de Compostos Orgânicos .................................................................... 115
1.5 Basicidade em Compostos Orgânicos ............................................................. 117
Exercícios Resolvidos: ............................................................................................ 119
Exercícios de Fixação: ............................................................................................ 124
Capítulo 2................................................................................................................. 128
2.1 Introdução a Reações Orgânicas ..................................................................... 128
2.2 Reações de Adição .......................................................................................... 129
Exercícios Resolvidos: ............................................................................................ 140
Exercícios de Fixação: ............................................................................................ 144
Capítulo 3................................................................................................................. 147
3.1 Reações de Eliminação.................................................................................... 147
Exercícios Resolvidos: ............................................................................................ 150
Exercícios de Fixação .............................................................................................. 154
Capítulo 4................................................................................................................. 157
4.1 Reações de Substituição .................................................................................. 157
4.2 Substituição em Anéis Benzênicos substituídos ............................................. 162
Exercícios Resolvidos: ............................................................................................ 165
Exercícios de Fixação: ............................................................................................ 170
Exercícios Complementares – Química I .............................................................. 173
Exercícios Complementares – Química II ............................................................ 184
Química
UNIDADE III – Química Inorgânica
Capítulo 1
1.1 Soluções
Solução é uma mistura de duas ou mais substâncias dando origem a um sistema
uniforme. Uma solução é composta de soluto e solvente. Soluto é a substância presente
em menor quantidade. Exemplos: ácidos, bases, cloreto de sódio (sal), sacarose (açúcar).
Solvente é a substância presente em maior quantidade. Exemplos: água, álcool, éter,
acetona.
Se nós colocamos uma colher de açúcar em um copo com água e agitarmos,
veremos que ele irá se dissolver totalmente. Porém, o mesmo não acontecerá se fizermos
a mesma coisa com a areia. Toda a areia irá se depositar. Podemos, então, dizer que o
açúcar formou uma solução aquosa, ou seja, uma solução em água, ou ainda, uma
dispersão. Onde o açúcar é o soluto (disperso) e a água é o solvente (dispergente).
Podemos definir uma dispersão como sendo um sistema no qual está dissolvida
(disseminada), sob forma de pequenas partículas, numa outra substância. Como em cada
solução, o tamanho das partículas varia de composto para composto, utiliza-se este
método para classificar as dispersões.
5
Sumário
Química
Tipos de
Tamanho médio das
dispersões
partículas
Soluções
verdadeiras
Entre 0 a 1nm
Soluções coloidais
Entre 1 e 100nm
Suspensões
Acima de 100nm
Exemplos
Açúcar e sal em água, álcool comercial.
Geleia, gelatina em água, aerossóis,
neblina.
Leite de magnésia, Terra suspensa em água.
6
Sumário
Química
As soluções podem ser:
Sólidas: ligas metálicas (ouro 18K, bronze, aço)
Líquidas: água e álcool, álcool e gasolina.
Gasosas: ar atmosférico.
Sólido-líquidas: mistura de água com açúcar ou sal.
Líquido-gás: bebidas gaseificadas.
Ainda podemos classificá-las de acordo com a condutibilidade elétrica que
dependerá da natureza química das espécies presentes na solução.
Solução molecular ou não eletrolítica: são soluções aquosas de
substâncias covalentes que se dissolvem liberando moléculas e, por isso, não conduzem
eletricidade. Exemplo: açúcar em água.
Solução iônica ou eletrolítica: são soluções aquosas de substância iônicas
que liberam íons em meio aquoso e por isso conduzem corrente elétrica. Exemplo: sal em
água.
7
Sumário
Química
1.2 Solubilidade
Na química existe uma regra básica para se saber se um soluto vai se dissolver num
determinado solvente:
Semelhante dissolve Semelhante
Substâncias polares (cujas moléculas possuem polos elétricos) dissolvem em
solventes polares como água e substâncias apolares (cujas moléculas não possuem polos
elétricos) dissolvem em solventes orgânicos apolares como benzeno.
A água é o solvente mais importante e é chamada de “solvente universal”. A água
é um solvente polar devido suas moléculas serem eletricamente polarizadas como mostra
a figura abaixo.
Os solventes orgânicos como benzeno são chamados de apolares por não possuírem
polos elétricos como a água.
8
Sumário
Química
# Um caso particular
O álcool é um solvente semi-polar devido a uma parte de sua molécula, a hidroxila
(OH-) apresentar polos elétricos e a outra parte, formada por carbono e hidrogênio não.
Em visão microscópica, temos que:
9
Sumário
Química
1.3 Coeficiente de solubilidade e Curva de solubilidade
É a quantidade máxima de soluto que pode ser dissolvida em 100g de água em uma
determinada temperatura. Exemplo: sal comum (NaCl) Cs = 36g/100g H2O; açúcar
comum (C6H22O11) Cs = 33g/100g.
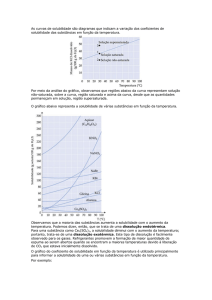
A curva de solubilidade é um gráfico que nos fornece o quanto uma substância é
solúvel em um solvente, geralmente a água a uma determinada temperatura. O gráfico
abaixo se trata da curva de solubilidade do cloreto de amônio (NH4Cl).
10
Sumário
Química
Observa-se que com o aumento da temperatura aumenta a solubilidade das
substâncias. Isso ocorre porque o calor auxilia as moléculas de água na distribuição da
rede cristalina iônica do sal e por consequência aumenta sua solubilidade. Esse
corportamento é característica de muitos sais, contudo há sais que possuem o
comportamento inverso ou que não há aumento significativo da solubulidade. Observe o
gráfico abaixo:
Analisando o gráfico podemos perceber que o Ce2(SO4)3 é um sal que possui sua
solubilidade diminuída com o aumento da tenmperatura. O NaCl é um sal que possui sua
solubilidade levemente aumentada. O KNO3 é um sal que possui sua solubilidade muito
aumentada com o aumento da temperatura.
Observe a curva de solubilidade abaixo:
De acordo com o coeficiente de solubilidade podemos classificar uma solução em:
Solução insaturada: a quantidade de soluto é inferior ao coeficiente de
solubilidade. Solução X
11
Sumário
Química
Solução saturada: a quantidade de soluto é igual ao coeficiente de
solubilidade. Solução Y
Solução saturada com corpo de fundo ou supersaturada: a quantidade
de soluto é superior ao coeficiente de solubilidade. Solução Z
Analisando a solubilidade de gases, temos que quanto mair a pressão, maior a
solubilidade dos gases.
Analisando a solubilidade de gases, temos que quanto maior a temperatura, menor
a solubilidade dos gases.
12
Sumário
Química
1.4 Unidades de concentração
Concentração é a quantidade de soluto existente em uma quantidade de solução ou
de solvente. De acordo com a unidade usada para a quantidade de soluto (gramas, litros,
número de mols) e de solvente ou solução (litros, gramas, quilogramas).
Exemplo: Solução 1 – 3g de NaCl dissolvidos em 1L de H2O; Solução 2 – 10g de
NaCl dissolvidos em 1L de H2O
Costuma-se dizer que, nesse caso, a solução 2 é mais concentrada do que a solução
1, uma vez na solução 2 existe uma maior quantidade de soluto dissolvido. Isto equivale
a dizer que a solução 1 é mais diluída que a solução 2.
A seguir teremos algumas formas de expressar a concentração de soluções.
Adotamos a seguinte convenção:
Índice 1: quantidade de soluto
indice 2: quantidade de solvente ou
solução
Concentração comum (C): é o quociente entre a massa do soluto (m1)
em gramas e o volume da solução (v2) em litros. Unidade: g/L
C = m1/v2
13
Sumário
Química
Obs.: Não confunda Concentração comum com densidade. A densidade (d)
relaciona a massa solução e o volume da mesma.
d = m/v
Exemplo 1: Calcule a concentração comum de uma solução de nitrato de potássio,
sabendo que ela possui 60g do sal em 300cm3 de solução.
300cm3 ------------ 60g de KNO3
1.000cm3 ---------
ou
x
C = m1/v2
C = 60/0,3
x = 200g/L
C = 200g/L
Exemplo 2: Qual a massa de íons Na+ existentes em 200mL de solução de NaOH
de concentração igual a 80g/L?
1L = 1.000mL ----------- 80g de NaOH
200mL ------------
x
x = 16g de NaOH
ou
C = m1/v2
80 = m1/0,2
C = 16g
E para o cálculo estequiométrico, chegamos a:
NaOH
Na+ + OH-
40g ------------- 23g
16g ------------- x
x = 9,2g de íons Na+
14
Sumário
Química
Exemplo 3: Qual a concentração comum de uma solução obtida pela dissolução de
6,3g de uma ácido mineral em água suficiente para completar 100mL de solução.
6,3g -------------- 100mL
ou
x-------------1000mL
x=3g/L
C = m1/v2
C = 6,3/0,1
C = 63g/L
A concentração comum é uma unidade de concentração que é utilizada para definir
os efeitos do álcool no nosso organismo. A tabela abaixo retrata sobre isso:
Molaridade (M): é o quociente entre o número de mols do soluto (n1) e o
volume de solução (v2) em litros. Unidade: mol/L, molar ou M.
M = n1/v2
15
Sumário
Química
Exemplo 1: Calcule a massa de hidróxido de sódio (NaOH) necessária para preparar
uma solução de meio litro de solução 0,2 molar. (massas atômicas – H = 1; O = 16; Na =
23)
1L ---------------- 0,2mol
0,5L--------------
ou
x
M = n1/v2
0,2 = n1/0,5
x = 0,1mol
n1 = 0,1mol
1mol------------- 40g
0,1mol----------- y
y = 4g de NaOH
Exemplo 2: Qual a molaridade de uma solução de iodeto de sódio (NaI) que possui
45g de sal em 400mL de solução? (massas atômicas – Na = 23; I = 227)
1mol ------------------- 250g
x
------------------- 45g
x = 0,18mol de NaI
400mL ----------------- 0,18mol
1.000mL --------------y = 0,45mol/L
y
ou
M = n1/v2
M = 0,18/0,4
M = 0,45mol/L
16
Sumário
Química
Exemplo 3: Calcule a molaridade da solução obtida pela dissolução de 0,48mols de
moléculas de ácido acético em água suficiente para completar 800mL.
0,48mol ------------------ 800mL
x
ou
------------------ 1.000mL
M = n1/v2
M = 0,48/0,8
x = 0,6mol/L
M = 0,6mol/L
Relação entre Concentração Comum e Molaridade:
C = m1/v2
e
M = n1/v2 ou M = m1/ MM1 x V
C/M = m1/v/ m1/MM1 x V = M1 = C = M x MM1
Exemplo 1: Calcule a concentração comum de uma solução de 0,2M de ácido
fosfórico (H3PO4).
1mol----------------- 98g
ou
0,2mol--------------- x
C = M x MM1
C = 0,2 x 98
x = 19,6g/L
C = 19,6g/L
Exemplo 2: Uma solução de cloreto de sódio possui concentração 15,0g/L. Qual é
a sua concentração em mol por litro? (massas atômicas – Na = 23; Cl – 35,5)
1mol NaCl ------------------ 58,5g
x
------------------- 15,0g
x = 0,26mol/L
ou
C = M x MM1
15 = M x 58,5
M = 0,26mol/L
17
Sumário
Química
Exemplo 3: Qual a concentração comum de uma solução com volume de 0,5L e
que apresenta 0,25mols de sal de cozinha (NaCl) (massas atômicas – Na = 23; Cl – 35,5)?
0,25mol -------------------- 0,5L
x
ou
-------------------- 1,0L
M = 0,25/0,5
x=0,5mol/L
M = 0,5mol/L
1mol --------------------- 58,5g
0,5mol-------------------
M = n1/v2
ou
y
C = M x M1
C = 0,5 x 58,5
y = 29,25g/L
C = 29,25g/L
As soluções ainda podem ser classificadas de acordo com a quantidade de soluto
em determinada quantidade de solvente:
Solução diluída: a quantidade de soluto é menor ou igual a 1mol/L.
Solução concentrada: a quantidade de soluto é maior que 1mol/L.
Molalidade (W): é o quociente entre o número de mols do soluto (n1) e a
massa do solvente (m2) em quilograma (Kg). Unidade: mol/Kg ou molal.
W = n1/m2 ou W = m1/MM1 x m2
Exemplo 1: Qual é a molalidade de uma solução que contém 40g de brometo de
cálcio em 200g de água?
1mol --------------- 200g
x
---------------- 40g
x = 0,2mol
0,2mol -------------- 200g
y -------------- 1000g
y=1mol/Kg
ou
W = n1/m2
W = 0,2/0,2
W = 0,1molal
18
Sumário
Química
Exemplo 2: Uma solução contém 184g de glicerina (C3H8O3) em 800g de água e
apresenta densidade igual a 1,044g/cm3 (massas atômicas: H = 1; C = 12; O = 16).
Calcule:
a) a molalidade da solução
b) a molaridade da solução
a) W = m1/MM1 x m2
W = 184/92 x 0,8
W = 2,5 molal
b) d = m/v
1,044 = 984/v
v = 942,5mL
M = m1/MM1 x m2
M = 184/92 x 0,9425
M = 2,1mol/L
Exemplo 3: Qual a massa molecular de um soluto dissolvido numa solução 4molal
que possui meio litro de volume e 126g de soluto?
W = m1/MM1 x m2
4 = 126/MM1 x 0,5
MM1 = 63g/mol
Fração Molar (X): é o quociente entre a quantidade de soluto (n1) e a
quantidade total de mols na solução (n1 + n2).
X1 = n1/n1 + n2 (soluto)
X2 = n2/n1 + n2
19
Sumário
Química
Exemplo1: Uma solução contém 230g de álcool comum (C2H5OH) e 360g de água
(H2O). Calcule as frações molares do álcool e da água na solução. (massas atômicas: H =
1; C = 12; O = 16)
X1 = n1/n1 + n2
X1 = 5/25
X1 = 0,2 (álcool)
1mol álcool ----------------- 46g
x
----------------- 230g
x = 5mol de C2H5OH
X2 = n2/n1 + n2
X2 = 20/25
X2 = 0,8 (água)
1mol água ------------------ 18g
y
------------------ 360g
y = 20mol de H2O
Exemplo 2: Uma solução contém 60g de NaI, 24g de NaOH e 702g de água. Calcule
as frações molares de NaI e NaOH e água.
1mol NaI ----------------- 150g
x
------------------ 60g
x = 0,4mol NaI
1mol NaOH -------------- 40g
y
-------------- 24g
y = 0,6mol
1mol H2O ---------------- 18g
z
---------------- 702g
z = 39mol
XNaI = nNaI/ntotal
Xágua = nágua/ntotal
XNaI = 0,4/40
XNaI = 0,01
Xágua = 39/40
XNaOH = nNaOH/ntotal
Xágua = 0,975
XNaOH = 0,6/40
XNaOH = 0,015
20
Sumário
Química
Partes por Milhão (ppm): é o quociente entre uma parte do soluto em
1.000.000 de partes de solução. Geralmente o soluto em mg e a solução em Kg ou L ou
dm3. Unidade: mg/L ou mg/Kg.
ppm = m1/1.000.000
Essa unidade de concentração é muito utilizada para expressar soluções que
possuem pouca quantidade de soluto em relação a quantidade de solvente. Na tabela
abaixo se encontram as concentração de cálcio na forma de carbonato de cálcio presente
na água. De acordo com a concentração, a água pode ter várias classificações:
Partes por Bilhão (ppb): é o quociente entre uma parte do soluto em
1.000.000.000 de partes de solução. Geralmente o soluto em mg e a solução em tonelada
ou m3.
ppb = m1/1.000.000.000
21
Sumário
Química
Exemplo 1: Na crosta terrestre existem, em média, 70ppb (m/m) do metal prata.
Qual será a massa de prata existente em 100Kg da crosta terrestre.
70mg --------------------- 1.000.000.000mg
x
ou
--------------------- 100.000.000mg
ppb = m1/m2
70 = m1/0,1
x = 7mg
m1 = 7mg
Exemplo 2: A água potável não pode conter mais do que 5 x 10-4mg de mercúrio
(Hg) por grama de água. Expresse essa concentração em ppm.
5 x 10-4mg ------------------- 1ml
x
ou
ppm = m1/m2
ppm = 5 x 10-4/0,001
------------------- 1000mL
x = 0,5ppm
ppm = 0,5
Exemplo 3: A concentração de magnésio em amostras de água de um lago é de,
aproximadamente, 4 x 10-4mol/L. Qual a concentração em ppm? (Mg = 24g)
1mol ----------------- 24g
4 x 10-4 mol--------- x
x = 9,6 x 10-3g
1g ---------------------- 1000mg
9,6 x 10-3g-------------
ou
y
Y = 9,6ppm
ppm = m1/m2
ppm = 9,6/1
ppm = 9,6
Título(τ) ou porcentagem em massa (%m/m): é o quociente entre a
massa de soluto em gramas (m1) e a massa da solução.
τm/m = m1/m1 + m2 ou %m/m =(m1/m1 + m2) x 100
22
Sumário
Química
Exemplo1: Uma solução contém 8g de cloreto de sódio e 42g de água. Qual a
porcentagem em massa da solução?
%m/m = (m1/m1 + m2) x 100
ou
50g --------------- 8g
%m/m = (8/50) x 100
100g-------------- x
%m/m = 16%
x = 16% m/m
Exemplo2: Qual o título em massa e o título percentual de uma solução de 20g de
cloro dissolvidos em 980g de água?
τ = m1/m1 + m2
τ% = τ x 100
20g --------------------- 1000g
τ =x20/1000
--------------------- τ%
100g= 0,02 x 100
τ = 0,02 x = 2% τ% = 2%
Exemplo3: Uma solução de cloreto de sódio em água contém 40g de NaCl
dissolvidos em 460g de H2O, formando uma solução de 500g de massa. Qual a
porcentagem em massa da solução?
%m/m = (m1/m1 + m2) x 100
%m/m = (40/40 + 460) x 100
40g ------------------ 500g
x ------------------- 100g
%m/m = 8%
x = 8%
Título (τ) ou porcentagem massa/volume (%m/v): é o quociente entre a
massa de soluto em gramas (m1) e o volume da solução (v2).
τm/v = m1/v2 ou %m/v = (m1/v2) x 100
A quantidade de sal presente em soros fisiológicos hospitalares são expressos em
título massa/volume ou porcentagem massa/volume.
23
Sumário
Química
Exemplo 1: Qual a %m/v de uma solução preparada usando 10g de NaOH em
2000mL de solução?
%m/v = (m1/v2) x 100
ou
10g --------------- 2000mL
%m/v = (10/2000) x 100
x
%m/v = 0,5%
---------------- 100mL
x = 0,5%
Exemplo2: Qual a massa de C12H22O11 presente em 600mL de solução de 3%m/v?
%m/v = (m1/v2) x 100
ou
3 = (m1/600) x 100
m1 = 18g
3g --------------- 100mL
x --------------- 600mL
x = 18g
Título (τ) ou porcentagem em volume (%v/v): é o quociente entre o
volume do soluto (v1) e o volume da solução.
τv/v = v1/v1 + v2 ou %m/v = (v1/v1 + v2) x 100
Para estipular e determinar a quantidade de álcool presente na gasolina comercial
é expresso em título em volume ou porcentagem volume/volume:
24
Sumário
Química
Exemplo1: A análise de um vinho revelou que ele contém 18mL de álcool em cada
corpo de 120mL. Qual é o título em volume desse vinho.
18mL ------------------- 120mL
ou
τv/v = v1/v1 + v2
x --------------- 100mL
τv/v = 18/120
τv/v = 0,15
x=15%
Exemplo2: Qual a quantidade de álcool necessária para a produção de 10L de álcool
70%v/v que é utilizado na esterilização de matérias hospitalares?
70mL --------------------- 100mL
x
--------------------- 10.000mL
x = 7.000mL ou 7L
Relação entre %m/m e %m/v
%m/m x d = %m/v
Exemplo1: No rótulo de um frasco de ácido clorídrico (HCl) encontram-se as
seguintes informações: título percentual em massa = 36,5%; densidade = 1,18g/mL. Qual
a sua molaridade? (H = 1; Cl = 35,5)
%m/v = %m/m x d
3,07g --------------- 100mL
%m/v = 36,5 x 1,18
x
%m/v = 43,07
x = 430,7g/L
---------------- 1000mL
C = M x MM1
430 = M x 36,5
M = 11,8mol/L
Exemplo2: Uma solução de 20% em massa de hidróxido de sódio apresenta
densidade 1,2g/mL. Qual a concentração comum dessa solução? (massas atômicas – Na
= 23; O = 16; H = 1)
%m/v = %m/m x d
24g -------------------- 100mL
%m/v = 20 x 1,2
x -------------------- 1000mL
%m/v = 24
x = 240g/L
25
Sumário
Química
Exercícios Resolvidos:
1) (UNIFICADO) A curva de solubilidade de um sal hipotético é:
A quantidade de água necessária para dissolver 30 gramas do sal a 35°C será, em
gramas:
a) 45
b) 60
c) 75
d) 90
e) 105
2) (UNIFICADO) A concentração de cloreto de sódio na água do mar é, em média,
de 2,95g/L. Assim sendo, a concentração molar deste sal na água do mar é
aproximadamente:
a) 0,050
b) 0,295
c) 2,950
d) 5,000
e) 5,850
3) (UNIRIO) A amônia vendida nas farmácias é uma solução aquosa de NH3,
conforme o equilíbrio a seguir:
N2 + 3 H2
NH4+ + OH-
26
Sumário
Química
A densidade desta solução concentrada, que contém 28% em peso de NH3, é de
0,90g/mL. A concentração molar aproximada de solução é: (Massas atômicas: H = 1g; N
= 14g)
a) 1.482,3
b) 741,2
c) 14,8
d) 7,41
e) 0,0148
4) (UFF) A massa de butanol necessária para preparar 500,0mL de solução 0,20M
é:
a) 14,8g
b) 7,4g
c) 3,7g
d) 37,7g
e) 18,5g
5) (UERJ) Para limpeza de lentes de contato, é comum a utilização de solução
fisiológica de cloreto de sódio a 0,9% (massa por volume). Um frasco contendo 0,5 litro
desta solução terá uma massa de NaCl em gramas, igual a:
a) 1,8
b) 2,7
c) 4,5
d) 5,4
6) (UNIFICADO) Analise abaixo a curva de densidade absoluta de soluções
aquosas de NaOH a diferentes concentrações.
27
Sumário
Química
Sabendo-se que a densidade de uma solução aquosa de hidróxido de sódio é igual
a 1,12g/mL, está correto afirmar que, em 200g dessa solução, há no máximo a seguinte
massa, em gramas, de NaOH:
a) 10
b) 15
c) 20
d) 25
e) 30
7) (UERJ) Visando determinar a solubilidade de uma substância hipotética X, em
um dado solvente, experiências foram realizadas adicionando-se quantidades crescentes
de X a uma quantidade-padrão do solvente, em temperatura e pressão especificadas. As
concentrações das soluções resultantes foram determinadas por um método analítico
adequado e os resultados obtidos foram apresentados graficamente, obtendo-se a figura a
seguir:
28
Sumário
Química
Sabendo-se que a massa molar de X é igual a 50g/mol e interpretando o gráfico dos
resultados experimentais, conclui-se que a solubilidade de X, na temperatura e pressão da
experiência, é, em mol/L, igual a:
a) 20
b) 10
c) 0,4
d) 0,2
8) (PUC) A tabela abaixo mostra a solubilidade de vários sais, em temperatura
ambiente, em g/100mL:
AgNO3 (nitrato de prata)......................................... 260
Al2(SO4)3 (sulfato de alumínio)................................ 160
NaCl (cloreto de sódio)........................................... 36
KNO3 (nitrato de potássio) ...................................... 52
KBr (brometo de potássio) ...................................... 64
Se 25mL de uma solução saturada de um desses sais foram completamente
evaporados, e o resíduo presou 13g, o sal é:
a) AgNO3
b) Al2(SO4)3
c) NaCl
d) KNO3
e) KBr
9) (UFF) Com intuito de economizar petróleo e estimular a substituição do
combustível de origem fóssil por uma fonte renovável, o governo brasileiro determinou
a adição de álcool de cana-de-açucar à gasolina do petróleo. Para testar o teor de álcool,
separam-se 50mL de gasolina vermelha em uma proveta de 100mL e adicionaram-se
50mL de água. Após agitação, com um bastão de vidro, essa mistura foi deixada em
repoudo por 5 minutos, para separação das fases. Em seguida, verificou-se que a fase
escura foi reduzida a 12,5mL.
29
Sumário