ROTEIRO DE RECUPERAÇÃO BIMESTRAL
3a SÉRIE - 1o BIMESTRE de 2017
Nome: ____________________________________ No ____ Série: 3a ___
Nota: _________
Professor: Edson / Manolo / Priscila
1. APRESENTAÇÃO:
Prezado aluno,
A estrutura da recuperação bimestral paralela do Colégio Pentágono pressupõe uma revisão dos conteúdos
essenciais que foram trabalhados neste bimestre.
O roteiro de recuperação vai auxiliá-lo a planejar e organizar seus estudos. Para isso, sugerimos que:
Anote tudo o que tiver para fazer. Fazer um esquema pode ajudar.
Faça um planejamento de estudos, estabelecendo um horário para desenvolver as diversas tarefas. Planejar
significa antecipar as etapas que você precisa fazer e entregar; não deixe para depois o que pode ser feito hoje...
Estabeleça prioridades: onde você tem mais dúvidas? Como se organizar para resolvê-las?
Para que você aproveite essa oportunidade, é necessário comprometimento: resolva todas as atividades propostas
com atenção, anote em um caderno suas dúvidas e leve-as para as aulas de recuperação.
Sempre que possível, aproveite a monitoria de estudos. Procure esclarecer todas as dúvidas que ficaram
pendentes no bimestre que passou.
Tudo o que for fazer, faça bem feito! Mostre o seu empenho ao professor, entregue um roteiro bem resolvido
e organizado.
2. CONTEÚDOS:
Para ajudar em sua organização dos estudos, vale lembrar quais foram os conteúdos trabalhados neste bimestre:
Temas / Conceitos
FRENTE 1
Reações envolvendo ésteres,
álcoois e alcenos
Cinética Química , equilíbrio
químico e equilíbrio iônico
FRENTE 2
Objetivos para os alunos
Reações de esterificação
Hidrólise ácida e básica
Reações de saponificação e formação de biodiesel
Reações de transesterificação
Oxidação de álcoois
Oxidação de alcenos
Polimerização
Velocidade Média das reações;
Lei das velocidades;
Fatores que influenciam a velocidade da reação;
Energia de ativação;
Equilíbrio químico e as constantes de equilíbrio.
Equilibrio iônico e as constantes de equilíbrio;
Deslocamento de equilíbrio.
3. OBJETIVOS DE APRENDIZAGEM
FRENTE 1
Conteúdos Conceituais (Competências e Habilidades)
Eixos Cognitivos
Reações orgânicas
Reações envolvendo
ésteres
Oxidação de álcoois
Oxidação de alcenos
Representar reações
orgânicas através da
linguagem simbólica da
Química
Utilizar a simbologia
química para
representar reações
de esterificação,
hidrólise e
transesterificação
Reconhecer a
oxidação de álcoois
Identificar os 3 tipos
de oxidação de
alcenos
II – Compreensão de
fenômenos
Entender como ocorre
uma reação orgânica
Compreender a
formação de ésteres e
sua hidrólise
Compreender que
álcoois oxidam
levando à formação
de diferentes produtos
Reconhecer que
oxidações diferentes
de alcenos podem
levar à formação do
mesmo produto
III – Resolução de
situação problema
Utilizar os conceitos na
resolução de situações
do cotidiano
Comparar reações de
hidrólise com reação
de saponificação e
formação do biodiesel
Reconhecer quais
álcoois podem ser
oxidados
Definir o tipo de
oxidação a partir dos
catalisadores e
condições do meio
IV – Capacidade de
Argumentação
Determinar o produto de
diferentes reações
orgânicas
Determinar o produto
de diferentes reações
envolvendo ésteres
Julgar o produto
formado a partir da
classificação do álcool
presente no reagente
Determinar o produto
de diferentes reações
envolvendo oxidação
de alcenos
V – Elaboração de
propostas
Extrapolar o
conhecimento para
determinação de
reagentes e produtos em
uma reação química
Utilizar os conceitos
na resolução de
situações do
cotidiano, como a
utilização de gordura
para fazer sabão
Explicar a oxidação do
vinho
Extrapolar o
conhecimento para
determinação de
reagentes e produtos
em uma reação
química
I – Domínio de
Linguagens
FRENTE 2
Conteúdos Conceituais (Competências e Habilidades)
Eixos Cognitivos
Cinética Química
Equilíbrio Químico
I – Domínio de
Linguagens
Compreender os fenômeno
da velocidade média de uma
reação química.
Identificar e compreender os
fenômenos que concorrem para
que uma reação química seja
reversível ou não.
II – Compreensão de
fenômenos
Entender como funciona a
teoria das colisões.
III – Resolução de
situação problema
Utilizar os conceitos de
fatores que influenciam a
velocidade das reações nas
situações do cotidiano
IV – Capacidade de
Argumentação
V – Elaboração de
propostas
Equilíbrio Iônico
Compreender os fenômenos de
de ionização e dissociação dos
ácidos e bases ,
respectivamente.
Reconhecer o equilíbrio químico
nas reações químicas e fazer
previsões sobre sua mudança.
Entender como funciona o
equilíbrio de uma dissociação e
de uma ionização
Utilizar tabelas de constantes de
equilíbrio para identificar ou
fazer previsões sobre o
comportamento de substâncias
nas reações químicas.
Utilizar tabelas de constantes de
equilíbrio para identificar ou
fazer previsões sobre o
comportamento de substâncias
nas reações químicas.
Determinar a lei da
velocidade
Prever o sentido do
deslocamento de um equilíbrio
químico, aplicando o Princípio
de Le Chatelier.
Determinar a lei de Ostwald
Extrapolar o conhecimento
para determinação da lei da
velocidade.
Extrapolar o conhecimento para
determinação do sentido do
deslocamento de equilibrio
Extrapolar o conhecimento para
determinação da lei de Ostwald
4. MATERIAL:
Livro didático;
Listas de estudos;
Anotações de aula feitas no próprio caderno;
Prova bimestral;
Simulados.
5. ETAPAS E ATIVIDADES
Veja quais são as atividades que fazem parte do processo de recuperação:
a) refazer a prova mensal e bimestral para identificar as dificuldades encontradas e aproveitar os
momentos propostos para esclarecer as dúvidas com o professor ou monitor da disciplina.
b) refazer as listas de estudos.
c) revisar as atividades realizadas em aula, bem como as anotações que você fez no caderno.
d) fazer os exercícios do roteiro de recuperação.
6. TRABALHO DE RECUPERAÇÃO
- Após fazer as atividades sugeridas para o processo da recuperação paralela, entregue os exercícios do
roteiro de estudos em FOLHA DE BLOCO.
- O Trabalho de recuperação vale 1 ponto.
- Para facilitar a correção, organize suas respostas em ordem numérica. Não apague os cálculos ou a
maneira como você resolveu cada atividade; é importante saber como você pensou!
- É muito importante entregar o Trabalho na data estipulada.
7. QUESTÕES
ATENÇÃO!
Entregar as Partes 1 e 2 em blocos separados.
Parte 1 - FRENTE 1
Todas as questões de múltipla escolha devem apresentar a resolução
QUESTÃO 1. Complete as duas reações de esterificação e indique os nomes corretos de A e B:
QUESTÃO 2. (FUVEST) Deseja-se obter, a partir do geraniol (estrutura A), o aromatizante que tem o odor
de rosas (estrutura B):
Estruturas do geraniol e de aromatizante que tem odor de rosas
Com qual substância o geraniol deve reagir para formar o aromatizante com odor de rosas?
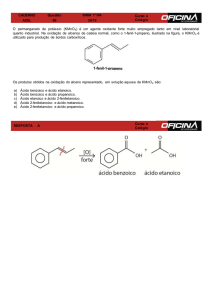
QUESTÃO 3. (UFC) A "aspirina tamponada" (estrutura II), medicamento mundialmente utilizado como
analgésico, antitérmico, antiinflamatório e anti-reumático, pode ser obtida através da transformação
química do ácido salicílico (estrutura I).
Assinale a alternativa que indica corretamente as reações químicas de transformação do ácido salicílico
em "aspirina tamponada".
a) hidratação e combustão;
b) combustão e hidrólise;
c) salificação e esterificação;
d) hidrogenação e ozonólise;
e) redução e descarboxilação.
QUESTÃO 4. (FUVEST) Na reação de saponificação CH3COOCH2CH2CH3 + NaOH → X + Y, os produtos
X e Y são:
a) álcool etílico e propionato de sódio.
b) ácido acético e propóxido de sódio.
c) acetato de sódio e álcool propílico.
d) etóxido de sódio e ácido propanóico.
e) ácido acético e álcool propílico.
QUESTÃO 5. (FUVEST) Reações de fermentação, saponificação e polimerização dão origem
respectivamente aos produtos:
a) teflon, glicerol e etanol.
b) teflon, etanol e glicerol.
c) etanol, teflon e glicerol.
d) etanol, glicerol e teflon.
e) glicerol, teflon e etanol.
QUESTÃO 6. (Fgv) Considere as seguintes equações:
I. C6H12O6 → 2 C2H5OH + 2 CO2
II. C2H5OH + O2 → CH3COOH + H2O
III. CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O
As equações I, II e III representam importantes reações orgânicas conhecidas, respectivamente, pelos
nomes de a) fermentação, oxidação e esterificação.
b) fermentação, combustão e hidrólise.
c) condensação, combustão e hidrólise.
d) combustão, fermentação e condensação.
e) combustão, oxidação e esterificação.
QUESTÃO 7. (FUVEST) O uísque contém água, etanol e pequenas quantidades de outras substâncias,
dentre as quais ácido acético e acetato de etila. Estas duas últimas substâncias teriam se formado, a partir
do etanol, escreva as duas possíveis reações que ocorreram com o etanol para formação dos produtos
citados.
QUESTÃO 8. Faça a reação de oxidação do 2-metil propan-1-ol e do propan-1-ol indicando as fórmulas e
nomes de todos os compostos envolvidos nessas reações
QUESTÃO 9. Mostre as reações e os nomes dos compostos envolvidos na oxidação branda, ozonólise e
oxidação enérgica dos compostos abaixo:
a) Eteno
b) 2-Metil-Propeno
c) But-2-eno
QUESTÃO 10. (FUVEST) Uma mistura aquosa de dicromato de potássio e ácido sulfúrico oxida os álcoois
primários a aldeídos e os álcoois secundários a cetonas. Por outro lado, tanto os álcoois primários quanto
os secundários, tratados apenas com ácido sulfúrico a quente, poderão formar alcenos.
a) Escreva a fórmula estrutural do produto da oxidação do 1-butanol.
b) Escreva as fórmulas estruturais dos possíveis alcenos formados pela desidratação do 2-butanol.
Parte 2 - FRENTE 2
Todas as questões de múltipla escolha devem apresentar a resolução
QUESTÃO 11.
(UESC-BA) O NO2 proveniente dos escapamentos dos veículos automotores é também responsável pela
destruição da camada de ozônio. As reações que podem ocorrer no ar poluído pelo NO2, com o ozônio,
estão representadas pelas equações químicas I e II, e pela equação química global III.
I - NO2(g) + O3(g) → NO3(g) + O2(g) (etapa lenta)
II - NO3(g) + NO2(g) → N2O5(g) (etapa rápida)
III - 2NO2(g) + O3(g) → N2O5(g) + O2(g) (equação química global)
Com base nessas informações e nos conhecimentos sobre cinética química, pode-se afirmar:
a) A expressão de velocidade para a equação química global III é representada por V = k[NO2][O3].
b) A adição de catalisador às etapas I e II não altera a velocidade da reação III.
c) Duplicando-se a concentração molar de NO2(g) a velocidade da reação quadruplica.
d) A velocidade das reações químicas exotérmicas aumentam com a elevação da temperatura.
e) A equação química III representa uma reação elementar.
QUESTÃO 12.
A água oxigenada é empregada, freqüentemente, como agente microbicida de ação oxidante local. A
liberação do oxigênio, que ocorre durante a sua decomposição, é acelerada por uma enzima presente no
sangue. Na limpeza de um ferimento, esse microbicida liberou, ao se decompor, 1,6 g de oxigênio por
segundo. Nessas condições, a velocidade de decomposição da água oxigenada, em mol/min, é igual a:
a) 6,0
b) 5,4
c) 3,4
d) 1,7
QUESTÃO 13.
Um prego de ferro foi colocado em uma solução aquosa ácida e aconteceu a reação representada pela
equação:
Fe(s) + 2H+(aq) → Fe2+(aq) + H2(g)
Para tornar essa reação mais rápida, pode-se repetir o experimento fazendo o seguinte:
I. aquecer a solução de ácido
II. usar solução de ácido mais diluída
III. triturar o prego
A rapidez SOMENTE é aumentada quando se realiza
a) I
b) II
c) III
d) I e II
e) I e III
QUESTÃO 14.
(Cesgranrio-RJ - Adaptada)
Foram obtidos os seguintes dados experimentais para a reação X + Y↔ Z:
[x] (mol / L)
[y] (mol / L)
v (mol / L . s)
0,15
0,15
9
0,15
0,30
18
0,30
0,15
36
a)
Qual a expressão da lei de velocidade da reação?
b)
Qual o valor da constante de velocidade dessa reação?
QUESTÃO 15.
. (UECE) – São colocados 8,0 mol de amônia num recipiente fechado de 5,0 litros de capacidade. Acima
de 450 ºC, estabelece-se, após algum tempo, o equilíbrio: 2 NH3 (g) 3 H2 (g) + N2 (g)
Sabendo que a variação do número de mol dos participantes está registrada no gráfico, podemos afirmar
que, nestas condições, a constante de equilíbrio, KC, é igual a:
a)
27,00. b) 5,40. c) 1,08. d) 2,16.
QUESTÃO 16.
. (UNESP) – Na precipitação de chuva ácida, um dos ácidos responsáveis pela acidez é o sulfúrico. Um
equilíbrio envolvido na formação desse ácido na água da chuva está representado pela equação:
2 SO2 (g) + O2 (g) ↔2 SO3 (g)
a) Calcule o valor da constante de equilíbrio nas condições em que reagindo-se 6 mol/L de SO2 com 5
mol/L de O2, obtêm-se 4 mol/L de SO3 quando o sistema atinge o equilíbrio.
b) Construa um gráfico para este equilíbrio representando as concentrações em mol/L na ordenada e o
tempo na abscissa, e indique o ponto onde foi estabelecido o equilíbrio.
QUESTÃO 17.
(ITA-SP) As opções a seguir se referem a equilíbrios químicos que foram estabelecidos dentro de
cilindros providos de êmbolo. Se o volume interno em cada cilindro for reduzido à metade, a temperatura
permanecendo constante, em qual das opções a seguir o ponto de equilíbrio será alterado?
a)H2(g) + I2(g)↔ 2 HI(g)
b) CaCO3(s) ↔ CaO(s) + CO2(g)
c) PbS(s) + O2(g) ↔ Pb(s) + SO2(g)
d) CH4(g) + 2 O2(g) ↔ CO2(g) + 2 H2O(g)
e) Fe2O3(s) + 3 CO(g) ↔ 2 Fe(s) + 3 CO2(g)
QUESTÃO 18
Uma solução 0,05 M de um ácido fraco HX apresenta uma constante de equilíbrio de ionização igual a
5.10-6. Determine, a partir dos dados fornecidos, o grau de ionização do ácido em questão.
a) 1 % b) 2 % c) 3 % d) 4 % e) 5 %
QUESTÃO19
(Cesgranrio –RJ) Com base na tabela de graus de ionização apresentada a seguir,
podemos concluir que o ácido mais forte é o:
e.
HF. b.HCℓ. c. HCN.
d. H2SO4. e) H3PO4.
QUESTÃO 20
UECE-CE) Considere os seguintes ácidos, com seus respectivos graus de ionização (a 18°C) e usos:
I. H3PO4 (α = 27%), usado na preparação de fertilizantes e como acidulante em bebidas refrigerantes;
II. H2S (α = 7,6 . 10-2%), usado como redutor;
III. HCℓO4 (α = 97%), usado na medicina, em análises químicas e como catalisador em explosivos;
IV. HCN (α = 8,0 . 10-3%), usado na fabricação de plásticos, corantes e fumigantes para orquídeas e
poda de árvores.
Podemos afirmar que são corretas:
a) HCℓO4 e HCN são triácidos.
b) H3PO4 e H2S são hidrácidos.
c) H3PO4 é considerado um ácido semiforte.
d) H2S é um ácido ternário.