PROTOCOLOS
MICROBIOLOGIA
Observação de bactérias - colorações
Como o índice de refração do protoplasma bacteriano difere muito pouco do meio
circundante, é difícil o exame direto de preparações não coradas, a não ser que se
utilizem técnicas especiais de iluminação. Também, o tamanho da maioria das
bactérias está muito próximo do limite de resolução (capacidade de distinguir dois
pontos muito próximos como separados) do microscópio óptico. Com o intuito de
facilitar a observação de material com o microscópio óptico, normalmente utilizam-se
corantes, que aumentam o contraste entre as células e o meio.
Os corantes são compostos com capacidade de formar iões (catiões ou aniões) que
são atraídos pelos componentes celulares com carga elétrica. Uma vez que os
diferentes componentes celulares têm diferentes cargas elétricas, os corantes a utilizar
dependem da estrutura que se pretende evidenciar. Há corantes ácidos ou aniónicos
que coram as componentes das células com cargas positivas como é o caso das
proteínas. Os corantes básicos são catiónicos e coram as componentes celulares com
mais cargas negativas como são algumas componentes das paredes celulares
bacterianas e os ácidos nucleícos.
As colorações podem ser de 3 tipos:
1. Colorações simples: em que é utilizado apenas um corante.
2. Colorações diferenciais: que são utilizadas para diferenciar grupos taxonómicos
•
Gram
3. Colorações de estruturas: em que os corantes evidenciam um componente
celular em particular:
AS Duarte
•
Endósporos
•
Cápsulas
•
Flagelos
•
Material Nuclear
1
PROTOCOLOS
Quando se faz uma coloração, há determinados procedimentos comuns, quaisquer
que sejam os corantes utilizados:
•
Preparação da lâmina
•
Preparação do esfregaço: Espalhar as células
•
Coloração
•
Lavagem
•
Coloração secundária ou de contraste
•
Lavagem
•
Secagem
Secar
Fixar
A. Preparação da lâmina
1. Para que as colorações funcionem, as lâminas devem estar escrupulosamente
limpas. Na sua bancada vai encontrar frascos com lâminas previamente
lavadas e que se encontram numa solução de álcool:éter (altamente
inflamável).
2. Deve utilizar uma pinça para remover as lâminas do recipiente que se encontra
na sua bancada.
3. Flameje as lâminas. Tenha muito cuidado pois o líquido em que as lâminas estão
mergulhadas é muito inflamável. Por favor, mantenha o recipiente afastado da
chama. Esta operação limpa a lâmina de gorduras e destrói as partículas
aderentes.
4. A partir de agora, pegue sempre na lâmina com uma pinça ou pelas arestas.
B. Preparação do esfregaço
Antes de fazer as colorações é necessário fazer um esfregaço das células a visualizar.
A técnica a utilizar depende de se utilizarem células provenientes de um meio líquido
ou de um meio sólido. Em qualquer dos casos, tem de utilizar métodos assépticos de
remoção dos microrganismos do meio de cultura.
AS Duarte
2
PROTOCOLOS
1. Esfregaço a partir de Meio Líquido (caldos, saliva, leite, etc.)
•
Na parte fosca da lâmina escreva as iniciais ou uma abreviatura do nome
da cultura que vai utilizar. Na parte inferior central da lâmina faça um
círculo com cerca de 1 cm (diâmetro) com a caneta de acetato.
•
Agite a cultura e transfira 1 ansa de cultura bacteriana para a superfície
marcada da lâmina. Espalhe o líquido dentro da área marcada.
•
Deixe secar ao ar
•
Depois da lâmina seca, segure-a com uma pinça e passe rapidamente
pela chama três vezes. Não deixe a lâmina sobre a chama por muito
tempo. Isso pode deformar as bactérias que pretende observar ou
interferir com a reação espera que aconteça.
2. Esfregaço a partir de Meio Sólido (agar ou amostra sólida)
•
Na parte fosca da lâmina escreva as iniciais ou uma abreviatura do nome
da cultura que vai utilizar.
•
Na parte inferior central da lâmina faça um círculo com cerca de 1 cm de
diâmetro com a caneta de acetato.
•
Com uma ansa, espalhe um pouco de soro fisiológico (ou água, ou soluto
de Ringer) sobre a área marcada da lâmina.
•
Depois de esterilizada a ansa transfira uma colónia da cultura e misture
com o soro fisiológico na lâmina.
•
Deixe secar ao ar
•
Depois da lâmina seca, segure-a com uma pinça e passe rapidamente
pela chama três vezes. Não deixe a lâmina sobre a chama por muito
tempo. Isso pode deformar as bactérias que pretende observar ou
interferir com a reação espera que aconteça.
AS Duarte
3
PROTOCOLOS
Figura 1 – Procedimento a utilizar para preparar um esfregaço a partir de uma cultura
em meio sólido e uma cultura em meio líquido.
AS Duarte
4
PROTOCOLOS
C. Coloração Simples (Azul de metileno)
O Azul de Metileno que é um corante básico ou catiónico. Este corante é fixado,
principalmente, pelas estruturas mais negativas da célula, como os ácidos nucleicos e
a parede celular das bactérias.
Procedimento:
1. Retire uma colónia de bactérias de uma das placas inoculadas na aula anterior.
2. Prepare um esfregaço de acordo com o protocolo B.
3. Cubra o esfregaço obtido com uma solução de azul de metileno e deixe corar
durante 1 minuto.
4. Lave com água destilada.
5. Seque com uma toalha de papel sem esfregar de modo a não remover células.
6. Observe ao microscópio.
7. Recolha imagens do que observou e envie, ao docente, um ficheiro com estas
devidamente legendadas.
Figura 2 – Procedimento para preparar uma coloração simples com azul de metileno.
~
AS Duarte
5
PROTOCOLOS
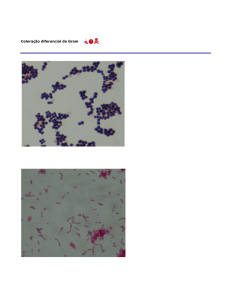
D. Coloração de Gram
A coloração de Gram é a mais utilizada em bacteriologia. Esta técnica de coloração
permite identificar dois tipos de bactérias que correspondem a grupos taxonómicos: as
bactérias Gram positivas e as Gram negativas. Estes dois grupos diferem na
composição química da parede celular. A denominação de positiva e negativa nada
tem que ver com cargas eléctricas mas sim com o facto das bactéria Gram+ reterem
o corante primário (cristal violeta) e ficarem violeta após a coloração, e das bactérias
Gram- não reterem o corante primário mas sim o secundário (safranina) e por isso se
apresentarem cor-de-rosa após a coloração. As bactérias Gram+ têm uma parede
celular com bastante peptidoglicano (cerca de 80 a 90%) da parede celular e baixo
teor lipídico. Pelo contrário as bactérias Gram- têm muito pouco petidoglicano e um
alto teor em lípidos.
Nesta técnica de coloração procede-se primeiro à coloração com cristal violeta e
depois com lugol que vai formar um complexo insolúvel com o cristal violeta. Todas as
células ficam coradas de violeta após este passo. De seguida, as células são lavadas
com álcool, o que faz com que as células Gram- percam os lípidos bastante
abundantes na parede celular e deste modo libertem o complexo cristal violeta-lugol
formado. Pelo contrário as células Gram+ como têm menos lípidos mantêm a sua
estrutura retendo o complexo cristal violeta-lugol. Finalmente, procede-se a uma
segunda coloração com safranina. As células Gram+ como já estão coradas de
violeta não são afectadas, mas as células Gram- como perderam a cor violeta ficam
deste modo coradas de cor-de-rosa.
A capacidade de reter o complexo cristal violeta-lugol não tem apenas dois
resultados possíveis mas sim uma gradação de resultados. Há vários factores que
podem fazer com que células Gram+ percam a capacidade de reter o complexo.
Esses factores são:
A técnica utilizada: Se deixar a lâmina sobre a chama durante muito tempo, se
deixar o álcool actuar durante mais tempo que o recomendado.
A idade da cultura: Culturas com mais de 24 horas podem perder a sua
capacidade para reter o complexo cristal violeta-lugol.
AS Duarte
6
PROTOCOLOS
Microrganismo: Há algumas bactérias Gram (+) com maior capacidade de reter
o complexo cristal violeta-lugol que outras.
Assim
é
essencial
que
tenha
bastante
cuidado
especialmente
durante
a
descoloração com álcool de modo a não obter falsos negativos nesta coloração.
Procedimento:
1. Utilize uma amostra obtida das placas/tubos inoculados na aula anterior e
prepare um esfregaço de acordo com os protocolos B1 e B2, respectivamente.
2. Core com violeta de cristal durante 30-60 segundos
3. Lave com água destilada
4. Core com Lugol durante 1 minuto
5. Descore com álcool durante 30-60 segundos (Este passo é crítico. Se deixar o
álcool actuar durante demasiado tempo terá um falso negativo)
6. Lave com água destilada
7. Core com safranina durante 30-60 segundos
8. Lave com água destilada
9. Seque com uma toalha de papel sem esfregar e observe ao microscópio (100x).
10. Recolha imagens do que observou e envie, ao docente, um ficheiro com estas
devidamente legendadas.
Figura 3 – Procedimento a utilizar para a coloração de Gram.
AS Duarte
7