
Química Orgânica
prof. Eduardo
Reações de oxidação
de alcenos
Módulo QO 11 – Apst. 3
Oxidação Branda
• Agente oxidante:
KMnO4 (diluído, a frio, meio neutro) → Reagente de Baeyer.
2 KMnO4 → K2O + 2 MnO2 + 3 [O]
Há oxidação, quando Baeyer passa de violeta para incolor.
Processo de diferenciação entre alcenos de ciclanos isômeros.
Propeno C3H6, descora Baeyer - Ciclopropano C3H6, não descora.
Na oxidação branda de alcenos, há formação de diois vicinais:
Oxidação Banda
ALCENOS
ALCENOS
VIOLETA
H2C = CH – CH3 + [O]
INCOLOR
Reag. Baeyer
+ H2O
HC – CH – CH3
│
│
OH OH
Propeno – C3H6
1,2 - Propanodiol
CICLANOS
CICLANOS
VIOLETA
+ [O]
Ciclopropano – C3H6
VIOLETA
Reag. Baeyer
+ H2O
NÃO REAGE
Oxidação Enérgica
• Agente oxidante:
KMnO4 (concentrado, a quente, meio ácido)
2 KMnO4 + 3 H2SO4 → K2SO4 + 2 MnSO4 + 3 H2O + 5 [O]
Em alcenos → QUEBRA A LIGAÇÃO DUPLA
Pode formar (dependendo do alceno):
ÁCIDOS CARBOXÍLICOS e CETONAS
GÁS CARBÔNICO E ÁGUA
Oxidação Enérgica
ALCENOS
ALCENOS
R – C = C – R + [O]
3
│ │
R H
ALCENO
KMnO4, conc, H+
R – C =O
│
R
CETONA
+
O= C – R
│
OH
ÁCIDO
CARBOXÍLICO
Oxidação Enérgica (cuidado)
ALCENOS
ALCENOS
H3C – C = C – H + [O]
│ │
H H
PROPENO
KMnO4, conc, H+
H3C – C = O + O = C – OH
│
│
OH
OH
Ac. Carboxílico
Ácido Carbônico
H2CO3
DUPLA NO
CARBONO DA
PONTIIIIIIIIIIIINHA...
CO22 ++ H
H22O
O
CO
Ozonólise
Reação entre um alceno e ozônio [O3(g)], onde forma um composto
instável, denominado ozonídeo ou ozoneto, que hidrólisz,
produzindo aldeídos e/ou cetonas e água oxigenada
R
C
C
R
O3
H2O/Zn
R H
alceno
R
C
R
cetona
O
+
O
C
H
aldeído
R + H2O2



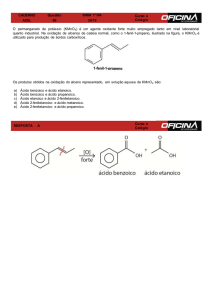



![A B ÁCIDO HEXANÓICO [O] [O] X [O] PENTAN-2-ONA Y 3](http://s1.studylibpt.com/store/data/005175326_1-e3b7b0d195d078a9e664a5fbbc00c029-300x300.png)


