Química – Exercícios complementares – 2ª série – 1º período/2017
Questão 1.
Considere as seguintes afirmações, referentes à evolução dos modelos atômicos:
I.
No modelo de Dalton, o átomo é dividido em prótons e elétrons.
II.
No modelo de Rutherford, os átomos são constituídos por um núcleo muito
pequeno e denso e carregado positivamente. Ao redor do núcleo estão
distribuídos os elétrons, como planetas em torno do Sol.
III.
O físico inglês Thomson afirma, em seu modelo atômico, que um elétron,
ao passar de uma órbita para outra, absorve ou emite um quantum (fóton)
de energia. Das afirmações feitas, está (ão) correta(s):
a) apenas III.
b) apenas I e II.
c) apenas II e III.
d) apenas II.
e) apenas I e III.
Questão 2.
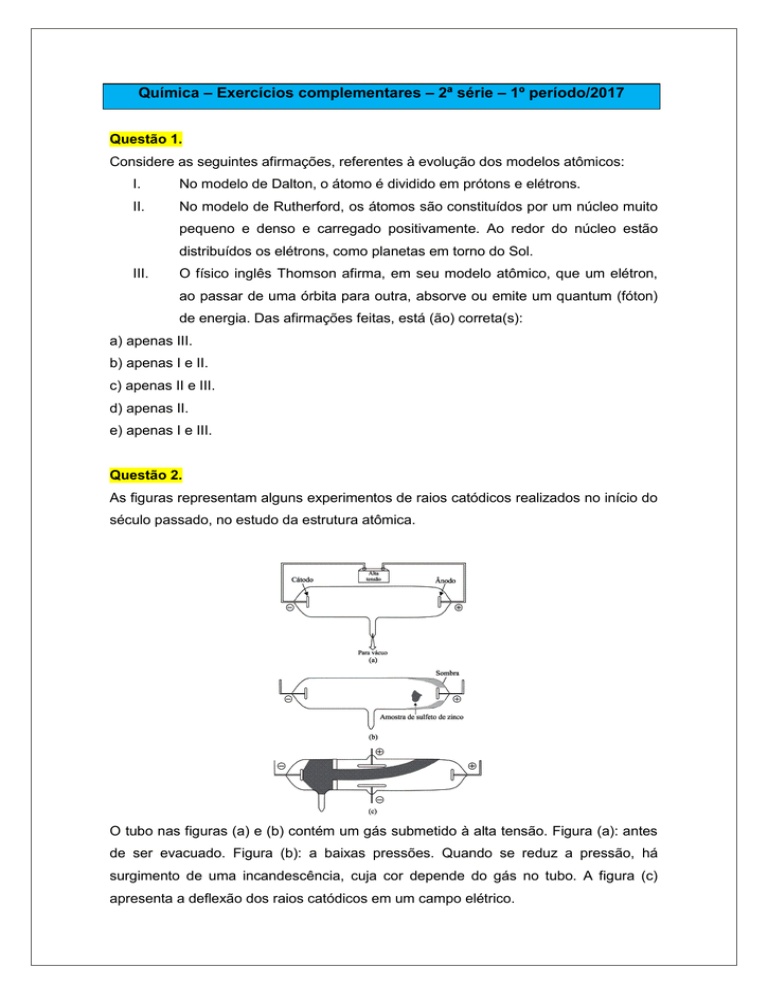
As figuras representam alguns experimentos de raios catódicos realizados no início do
século passado, no estudo da estrutura atômica.
O tubo nas figuras (a) e (b) contém um gás submetido à alta tensão. Figura (a): antes
de ser evacuado. Figura (b): a baixas pressões. Quando se reduz a pressão, há
surgimento de uma incandescência, cuja cor depende do gás no tubo. A figura (c)
apresenta a deflexão dos raios catódicos em um campo elétrico.
Em relação aos experimentos e às teorias atômicas, analise as seguintes afirmações:
I.
Na figura (b), fica evidenciado que os raios catódicos se movimentam numa
trajetória linear.
II.
Na figura (c), verifica-se que os raios catódicos apresentam carga elétrica
negativa.
III.
Os raios catódicos são constituídos por partículas alfa.
IV.
Esses experimentos são aqueles desenvolvidos por Rutherford para propor
a sua teoria atômica, conhecida como modelo de Rutherford. As afirmativas
corretas são aquelas contidas apenas em:
a) I, II e III.
b) II, III e IV.
c) I e II.
d) II e IV.
e) IV.
Questão 3.
De acordo com o modelo atômico de Bohr, elétrons giram ao redor do núcleo em
órbitas específicas, tais como os planetas giram em órbitas específicas ao redor do
Sol. Diferentemente dos planetas, os elétrons saltam de uma órbita específica para
outra, ganhando ou perdendo energia. Qual das afirmações abaixo está em
discordância com o modelo proposto por Bohr?
a) Ao saltar de uma órbita mais próxima do núcleo, para outra mais afastada, o elétron
absorve energia.
b) Ao saltar de uma órbita mais afastada do núcleo para outra mais próxima, o elétron
emite energia.
c) Dentro de uma mesma órbita, o elétron se movimenta sem ganho ou perda de
energia.
d) O processo no qual o elétron absorve energia suficiente para escapar
completamente do átomo é chamado ionização.
e) O modelo proposto é aplicado com êxito somente ao átomo de hidrogênio.
Questão 4.
Considerando-se um elemento M genérico qualquer, que apresenta configuração
eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d5, pode-se afirmar que:
I.
É isóbaro do elemento M2+;
II.
Seu número atômico é 25;
III.
Possui 7 elétrons na última camada;
IV.
Apresenta 5 elétrons desemparelhados;
Estão corretas as afirmações:
a) I, II e III somente
b) I e III somente
c) II e III somente
d) I e IV somente
e) II e IV somente
Questão 5.
Considerando as partículas constituintes do íon O-2 e a posição do elemento no quadro
periódico (8O), são feitas algumas afirmações sobre esse íon:
I.
Tem a mesma configuração eletrônica do átomo de 9F;
II.
Apresenta dois níveis completamente preenchidos;
III.
Tem um núcleo com 8 prótons.
IV.
Apresenta números iguais de prótons e elétrons.
V.
Se um átomo desse elemento apresentar 8 nêutrons, então ele será isótopo
do elemento 8X16.
São corretas apenas:
a) I, II, III e V;
b) II, III, IV e V;
c) II e III;
d) I, IV e V;
e) II, III e IV.
Questão 6.
Dentre os conjuntos de números quânticos {n,ℓ,m,s} apresentados nas alternativas a
seguir, um deles representa números quânticos NÃO permitidos para os elétrons da
subcamada mais energética do
2+
26Fe (II),
um íon indispensável para a sustentação da
vida dos mamíferos, pois está diretamente relacionado com a respiração desses
animais. Esse conjunto descrito corresponde a:
a) {3, 2, 0, 1/2}
b) {3, 2, - 2, -1/2}
c) {3, 2, 2, 1/2}
d) {3, 2, - 3, -1/2}
e) {3, 2,1, -1/2}
Questão 7.
O cério (58Ce) é um elemento metálico prateado, pertencente a série química transição
interna, conhecido como terra rara ou lantanídio, sendo usado em algumas ligas terras
raras. Assemelha-se ao ferro na cor e no brilho, mas é macio, maleável e dúctil. Sobre
o Cério é CORRETO afirmar que:
a) Esse elemento possui um total de 4 elétrons em subnível f.
b) O primeiro nível de energia com elétrons em orbitais d é o n = 5.
c) Se um de seus isótopos tiver número de massa 142, o número de nêutrons
desse isótopo é 82.
d) Seu elétron de diferenciação possui número quântico magnético igual a -2.
e) Um de seus elétrons pode apresentar o seguinte conjunto de números
quânticos: n = 4, ℓ = 3, m = +1, s = +1/2.
Questão 8.
Os números quânticos descrevem as energias dos elétrons nos átomos e são de
enorme relevância quando se trata de descrever a posição dos elétrons nos átomos.
Existem quatro números quânticos: número quântico principal; número quântico de
momento angular ou azimutal (secundário); número quântico magnético e número
quântico de spin. Estes quatro números quânticos, além de se complementarem, nos
permitem fazer uma descrição completa dos elétrons nos átomos, pois eles dizem
o nível principal de energia do elétron, o subnível de energia, a orientação espacial da
nuvem eletrônica e a orientação do próprio elétron na nuvem. Cada combinação dos
quatro números quânticos é única para um elétron. Com relação aos números
quânticos e assuntos correlatos assinale a alternativa falsa:
a) Os números quânticos servem para identificar cada elétron de um átomo.
b) Teoricamente, um átomo apresenta infinitos níveis e infinitos subníveis de energia.
c) O quinto nível de um átomo possui 6 subníveis reais.
d) Um elétron sempre apresentará um spin quando em sua posição normal em relação
ao núcleo.
e) Orbital é a região de maior probabilidade para se localizar um elétron.
Questão 9.
É difícil imaginarmos, em nosso cotidiano, até que ponto somos banhados por
radiações eletromagnéticas das variadas frequências do espectro. Podemos dizer que
o sol é uma das fontes de radiações predominantes que definem o meio ambiente no
qual nós, como uma espécie, temos evoluído e nos adaptado. Somos também
banhados por radiações de rádio, televisão, micro-ondas de sistema de radar e de
sistemas de telefonia, bem como radiações provenientes de lâmpadas, máquinas de
raios X, relâmpagos, ondas provenientes de motores aquecidos, de estrelas distantes,
de materiais radioativos e de outras galáxias. Com os fundamentos das teorias sobre
ondas eletromagnéticas, são feitas algumas afirmações:
I.
Uma onda eletromagnética pode ser desviada por um campo magnético.
II.
Em um meio não dispersivo, a frequência da luz depende da velocidade.
III.
No vácuo, a velocidade da luz não depende do comprimento de onda e
nem da frequência.
IV.
Em meio dispersivo, a velocidade da luz depende da frequência.
V.
No vácuo, a velocidade da luz depende da velocidade da fonte.
São corretas apenas:
a) III e IV;
b) I e V;
c) II, III e IV;
d) II, III e V;
e) I, III, IV e V;
Questão 10.
A música de Gilberto Gil fala do átomo, das partículas subatômicas e algumas de suas
características. Segundo a evolução dos modelos atômicos e os conceitos de estrutura
atômica, assinale a alternativa correta.
a) O elétron possui carga negativa (–1,602.10-19 C) e sua massa e tão pequena
que não pode ser medida.
b) Segundo Planck, a energia só pode ser emitida ou absorvida pelos átomos
em pacotinhos. Cada pacotinho contém certa quantidade de energia.
c) Diferentemente dos elétrons e dos prótons, os nêutrons não possuem carga
e tem massa cerca de 10.000 vezes maior que a do próton.
d) De acordo com a física moderna, a radiação eletromagnética é uma partícula
e não uma onda.
e) Segundo o princípio de Linus Pauling os elétrons são posicionados no orbital
em ordem decrescente de energia.
Gabarito
1
D
2
C
3
E
4
C
5
C
6
B
7
D
8
C
9
A
10
B












