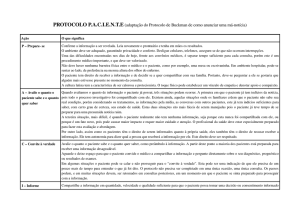
Metodologia estatística usada nos modelos de prognóstico em
cuidados intensivos
Trabalho realizado pelo grupo 1 da turma 10 do 1º ano do curso de medicina da
Faculdade de Medicina da Universidade do Porto:
Azeredo, M.A.; Ferreira, L.M.; Morgado, M.P.; Nunes, M.A.; Pires, M.F.; Rego, M.H.;
Sousa, L.M.
1
Abstract
O objectivo deste trabalho é apresentar
a metodologia inerente à construção de modelos
de
prognóstico
utilizados
em
Abstract
Unidades
Cuidados Intensivos.
This
Os modelos de prognóstico utilizados
em Unidades de Cuidados Intensivos (UCI’s)
começaram a ser utilizados na segunda metade
os resultados esperados em doentes internados
numa
UCI
(modelos
para
pacientes
traumáticos). Posteriormente, foram criados
novos modelos (segunda e terceira geração SAPS; APACHE; MPM) que, numa primeira
fase,
tinham
como
objectivos
satisfazer
necessidades de carácter ético e económico,
juntando mais tarde a estes objectivos o de
is
centered
in
the
methodology used in the construction of a
prognostic model used in I.C.U.’s.
The prognostic models for Intensive
da década de 60 e tinham como principal
objectivo comparar os resultados obtidos com
work
Care Units (I.C.U.’s) were first used in the
second half of the sixtieth decade and their main
goal was to compare the given results whit the
expected results in an interned patient of an
I.C.U.
(models
for
traumatic
patients).
Posteriorly, new models have been created.
These second and third generation models
satisfied, at the beginning, the ethic and
economic needs; later, they became truly
important in comparing results of the same or
comparar resultados intra e entre UCI’s.
Na formulação, desenvolvimento e
different I.C.U’s.
validação de um modelo de prognóstico é
In the formulation, development and
necessário seguir alguns passos elementares.
São eles: seleccionar as variáveis de resultado,
seleccionar a população de pacientes a estudar,
seleccionar as variáveis que são factores de
risco, recolher e analisar os dados disponíveis,
desenvolver o modelo estatisticamente (técnicas
regressão logística múltipla) e validar o modelo
(testes de discriminação - two-by-two table e
curva ROC; testes de calibração - técnica de
follow some elementary steps. They are:
outcome
variables
selection,
patient’s
population selection, risk factors selection,
available data collection and analyses, statistic
development of the model (multiple logistic
regression tecnics) and validation of the model
(discrimination tests – two-by-two table and
ROC curves; calibration tests – Hosmer-
Hosmer-Lemeshow).
Embora
validation of a prognostic model is necessary to
mantenham
algumas
limitações (dificuldade de acesso a informações
dos pacientes, fiabilidade nas previsões dos
resultados, entre outras), toda esta metodologia
inerente à formação de um modelo de
prognóstico, faz com estes estejam a ganhar
uma maior validade e credibilidade entre a
classe médica e observa-se actualmente um
Lemeshow tecnics).
Although they keep having some
limitations (the patient’s information access is
difficult, the predicted results are not so trustful
in the eyes of the entire medical society, among
others) all the methodology used in the creation
of a prognostic model is leading to a higher
utilization of the models.
aumento gradual na sua utilização.
2
Introdução
O que são modelos de prognóstico em Unidades de Cuidados Intensivos ?
Os modelos de prognóstico em Unidades de Cuidados Intensivos (U.C.I.’s) são
baseados em princípios matemáticos estatísticos, que consistem na atribuição de um
índice de gravidade a doentes das unidades, sendo que este se apresenta frequentemente
sob a forma de uma probabilidade de morte. Estes modelos partem normalmente de
características do paciente e da medição de variáveis fisiológicas aquando da entrada na
U.C.I., sendo estas posteriormente relacionadas através da construção de uma equação
matemática utilizando essencialmente a técnica de regressão logística. Como resultado
obtém-se um determinado valor percentual que prevê o desenvolvimento e conclusão do
internamento dos pacientes.1,2,3
É também de referir que existem outras técnicas intimamente relacionadas com
os modelos de prognóstico, mas estas intervêm na validação destes. A aplicação destes
métodos, como as curvas ROC4 (Receiving Operating Characteristic) e testes de
goodness-of-fit5, tem como principal objectivo avaliar a qualidade dos modelos
estabelecendo relações entre os valores previstos e os observados.1
Antes de se passar à explicação da metodologia estatística inerente ao
desenvolvimento de um modelo de prognóstico é absolutamente necessário conhecer
algo mais sobre eles. De seguida são apresentadas as respostas a algumas questões que
resumem aquilo que é conveniente saber acerca de um modelo de prognóstico para
melhor entender os princípios que estão subjacentes à sua criação.
Para que servem e por quem são utilizados estes modelos?
Enquanto que os primeiros modelos de prognóstico foram criados com um único
objectivo, o de comparar os resultados obtidos com os resultados esperados, alguns
modelos mais recentes, nomeadamente os de segunda e terceira geração, convergiram
para satisfazer duas necessidades que se fizeram sentir, especialmente, em U.C.I.’s.1,6
Uma é de carácter ético, pois tem a haver com o facto de direccionar, ou não, ao
acaso, pacientes severamente doentes para U.C.I.’s. Como tal, o seu uso tem sido vital
3
na triagem clínica, ou seja, na determinação do estado de gravidade dos doentes que são
posteriormente tratados por ordem dessa gravidade.1,7
A outra é de natureza económica, estando relacionada com a redução dos custos.
Uma vez que os recursos disponíveis para a saúde são escassos, torna-se fundamental
racionalizar ao máximo a ocupação das camas nas U.C.I.’s. Para isso, muito contribuem
os modelos de prognóstico na selecção e admissão de doentes para as U.C.I.’s.2,8,9
Na posse da informação, o clínico pode mais fácil e rigorosamente escolher as
técnicas disponíveis a utilizar no tratamento dos seus pacientes mediante a comparação
com casos semelhantes previamente tratados, juntamente com a probabilidade relativa
de que o tratamento escolhido venha a ser eficaz no doente em causa.2,10,11
A qualidade do tratamento do paciente é outra área na qual os modelos de
prognóstico parecem ter impacto. Isto é feito através de uma pesquisa de resultados,
abrindo a possibilidade de comparação inter-U.C.I.’s com a eventual identificação dos
componentes organizativos e administrativos responsáveis por uma melhoria ou
agravamento verificado em qualquer delas.2
Utilizados apropriadamente estes modelos podem então: ajudar os médicos na
decisão clínica, facilitada pela estratificação das classes de gravidade, e na atitude
terapêutica; possibilitar a comparação entre populações de estudo e entre diferentes
U.C.I.’s, levada a cabo pelos investigadores da saúde; racionalizar a utilização de
recursos, objectivo dos administradores da saúde. 2
Para além disso, são importantes em diversos estudos epidemiológicos, são
usados como um meio de grande disponibilidade de informação referente aos doentes
internados e possibilitam os estudos de outras variáveis sem ser a mortalidade, como
por exemplo, a qualidade de vida a longo prazo depois de um internamento numa
U.C.I.1,2,6
Que tipos de modelos existem actualmente?
Os modelos de prognóstico nas unidades de cuidados intensivos podem ser
específicos ou genéricos. Os modelos específicos são usados para certos tipos de
pacientes enquanto os genéricos podem abranger todos ou quase todos os tipos de
pacientes independentemente das doenças. Os modelos também podem ser anatómicos
(atingem a extensão da lesão) ou fisiológicos (relacionados com o impacto da lesão na
4
função). Os resultados dos modelos anatómicos são fixos enquanto os fisiológicos
podem variar à medida que a resposta fisiológica à lesão ou doença varia.6
Os primeiros modelos foram criados para pacientes traumáticos e eram do tipo
anatómico e específico. Mais recentemente, os modelos de prognóstico têm sido
genéricos. Actualmente têm sido utilizados dois métodos:6
- medição do risco pelo tratamento:
O TISS (Therapeutic Intervention Scoring System)12,13, publicado em 1974, é
um exemplo. Quanto mais doente estiver o paciente, maior o número e complexidade de
tratamentos recebidos por ele. Ao contabilizar isto, pode-se obter um valor do risco que
o paciente tem.
- medição do risco pelas características do paciente e pelas medidas
fisiológicas.6
O primeiro modelo genérico desenvolvido para quantificar a doença do paciente
de acordo com as suas características fisiológicas foi o APACHE (Acute Physiology Age
and Chronic Health Evaluation)2,14,15. No entanto, o modelo original era muito
complexo, tendo sido desenvolvidas 2 novas derivações do original: o SAPS (Simplified
Acute Physiology Score)16 e o APACHE II14. Posteriormente ambos foram adaptados a
SAPS II17 (1993) e a APACHE III15 (1991), respectivamente. Um modelo alternativo é
o MPM II (Mortality Probability Model)18,19
A que princípios deve um modelo de prognóstico obedecer?
Qualquer modelo de prognóstico deve ter credibilidade (credibility), precisão
(accuracy) e efectividade (effectiveness) e deve ser generalizável (generality). 20
Embora os melhores modelos de prognóstico tenham um forte suporte
estatístico, os médicos estarão relutantes à sua utilização enquanto não acreditarem nas
suas previsões. Alguns pré-requisitos para aumentar a sua credibilidade clínica são:
- todos os dados clínicos relevantes referentes aos pacientes deverão ser testados
a fim de serem integrados no modelo, não devendo nunca serem sonegados dados
importantes;20
- a obtenção de dados deverá ser um processo simplificado, que não ocupe
demasiado tempo e recursos (computorização de todo o modelo). Os dados deverão ser
gerados particularmente a partir de classes de doentes cujas previsões do modelo irão
servir futuramente;20
5
- os construtores dos modelos deverão evitar limites bruscos para variáveis
contínuas. Por exemplo, é pouco provável que o prognóstico para uma mulher com um
melanoma úlcero de 3,9 mm de espessura seja muito diferente do prognóstico para 4
mm de espessura.20
Os modelos deverão prever com rigor acentuado um evento que irá ocorrer, para
que a confiança da classe médica aumente e para que os modelos possam representar
uma ajuda preciosa aos profissionais de saúde.20 Mas se a percentagem de sobreviventes
for maior que a prevista, não quer dizer que o modelo esteja mal calibrado e que não
seja exacto. Talvez a U.C.I. em questão, diferente daquela(s) na qual o modelo foi
desenvolvido, tenha melhores condições.
Quanto à efectividade clínica, pode-se referir que os médicos deverão recorrer
tanto ao seu senso clínico (ditado por vezes por muitos anos de prática e experiência
médica), bem como a resultados ditados por ensaios clínicos e a estudos de comparação.
Torna-se de vital importância neste contexto, validar as previsões com base em modelos
com resultados em ensaios clínicos bem delineados (máxima eliminação de factores de
erro).20
Alguns médicos acreditam que os prognósticos baseados em modelos cujos
dados provêm de uma determinada população de doentes, não são aplicáveis a outra
população diferente. De acordo com alguns especialistas, os modelos poderão ser
generalizadamente aplicados com segurança, quando:
- são testados com independência e separadamente, no tempo e no lugar com
outro arranjo, recorrendo a várias técnicas estatísticas;20
- cada variável introduzida no modelo é claramente definida, utilizando critérios
universalmente aceites;20
- o desenvolvimento e a validação do modelo são feitos prospectivamente, de
acordo com um protocolo com premissas pré-definidas, e não retrospectivamente,
recorrendo a bases de dados gerais com as suas incorrecções, susceptíveis de induzirem
em erro.20
A descrição e discussão de todos os modelos de prognóstico ultrapassa este
trabalho. Apenas nos referiremos aos modelos de risco gerais, isto é, aplicáveis a todas
as doenças críticas. Embora os modelos específicos para uma doença tenham sido
desenvolvidos acreditando que cada patologia teria um conjunto de variáveis predictivas
próprias e, de uma maneira geral, se tenham revelado eficazes e úteis, interessa-nos
6
discutir sobretudo os modelos gerais, aplicáveis a qualquer doente que é admitido a uma
U.C.I. com um qualquer diagnóstico, ainda que referenciados brevemente pois este
trabalho estará focado na metodologia estatística base usada no desenvolvimento de
qualquer modelo de prognóstico.
7
Desenvolvimento
Os passos ou elementos essenciais necessários para a formulação e
desenvolvimento de um modelo de prognóstico são:1
1 - seleccionar as variáveis de resultado (outcome);
2 - seleccionar a população de pacientes a estudar;
3 - seleccionar as variáveis que são os factores de risco;
4 - recolher e analisar os dados disponíveis;
5 - desenvolver o modelo estatisticamente;
6 - validar o modelo
Para uma melhor compreensão dos processos que levam à formação de um
modelo, iremos então dissecar cada um dos pontos acima numerados.
SELECÇÃO DO RESULTADO A ESTUDAR
A mortalidade é o outcome que mais fácil e objectivamente avalia um
desempenho das U.C.I.’s, uma vez que apenas existem duas possibilidades finais:
morrer e não morrer. A relação custo-eficiência21 dos cuidados médicos e o prognóstico
(de longa duração) da qualidade de vida após internamento nas U.C.I.’s representam
outros resultados que podem ser estudados nos modelos de prognóstico. No entanto,
estes resultados são mais difíceis de quantificar uma vez que são de maior
complexidade que a mortalidade.1,
No entanto, em termos do estudo da qualidade de vida dos pacientes, têm sido
desenvolvidos um razoável número de instrumentos, incluindo: the Sickness Impact
Profile22, the Functional Status Questionnaire23 e the Duke-UNC Health Profile19. No
entanto, estes instrumentos são muito morosos de aplicar num grande número de
pacientes.1
Os resultados diferem de acordo com o método usado e o tipo de pacientes
estudado. A idade e severas condições clínicas preexistentes parecem afectar
grandemente a qualidade de vida depois de uma estadia numa U.C.I. Qualquer variável
medida depende do equipamento, da equipa médica, do processo de tratamento (tipo,
qualidade e o momento em que é feito o tratamento) e da convivência com pessoas que
sofrem de outros males.6
8
SELECÇÃO DA POPULAÇÃO DE PACIENTES A ESTUDAR
Quando se desenvolve um modelo de prognóstico ou quando se utiliza um
instrumento já desenvolvido para uma determinada pesquisa ou clínica, devemos ter em
conta qual o grupo de pacientes sobre o qual ele visa (quais as suas tendências). Por
exemplo, o estudo de Fowler identificou que modelos de prognóstico para pacientes
com ARDS (síndroma do distress respiratório adulto) não são um modelo válido para
avaliar pacientes com COPD (doença crónica da obstrução pulmonária) ou com a
doença da artéria coronária. Outros instrumentos, como os descritos por Menzies para
pacientes com COPD e por Norris para indivíduos com doença da artéria coronária
seriam mais eficientes na população referida.1,25,26,27
Os modelos de prognóstico gerais (APACHE, SAPS, MPM,...) têm tentado
evitar viéses nas populações seleccionadas usando contínuas entradas de pacientes para
as U.C.I.’s e desenvolvimento das suas bases de dados. Ainda assim, os construtores
destes modelos reconhecem que o conhecimento do diagnóstico de pacientes específicos
frequentemente influencia a eficácia do modelo. Desta forma, certos subgrupos de
pacientes foram excluídos dos modelos gerais (o APACHE III, o SAPS e o MPM
excluem pacientes queimados e com enfarte de miocárdio) limitando o seu raio de
prognóstico.1
Quando um modelo de prognóstico vai ser usado, a sua eficácia deve ser
validada na população-alvo e os médicos e pesquisadores devem estar conscientes das
tendências do grupo de pacientes para o poderem utilizar. Isto é verdade tanto para o
médico que pretende dar uma estimativa da possibilidade de morte ao paciente como
para o pesquisador que está a investigar o efeito de uma nova terapia nas U.C.I.’s.1
Podemos assim concluir que os modelos de prognóstico só devem ser utilizados
em populações semelhantes àquelas que serviram como base para a construção do
modelo. Sempre que se prova que a eficácia de um modelo é inadequada para a
população a que se destina deve ocorrer uma modificação ou uma actualização do
mesmo.1
SELECÇÃO DAS VARIÁVEIS QUE SE CONSTITUEM COMO FACTORES DE
RISCO
9
Pacientes de uma U.C.I. têm grande parte das vezes centenas de dados
individuais criados diariamente, reflectindo sinais vitais, valores laboratoriais, resposta
a terapias específicas e resultados de procedimento de diagnóstico.1
A selecção das variáveis que se apresentam como factores de risco geralmente
ocorre de um ou dois métodos:
- algumas vezes, equipas de estudiosos, “experts” na matéria, seleccionam
variáveis relevantes da previsão para o doente em causa.1 Este tipo de selecção foi
usado no desenvolvimento do modelo APACHE;14
- o outro método envolve o uso de técnicas estatísticas como a análise da função
de discriminação linear, para reduzir uma lista inicial de variáveis para uma mais
profunda análise.1,28,29 Este tipo de aproximação foi usado no desenvolvimento do
MPM, no qual de 377 variáveis se passou a ter 12 e no desenvolvimento do
SAPS.16,17,18,19
Em geral, e esquecendo o método de obtenção da variável, esta tem de ser
objectiva (não sujeita a julgamentos individuais) e facilmente obtida durante a
hospitalização na U.C.I.1
RECOLHA E ANÁLISE DOS DADOS DISPONÍVEIS
A colecção dos dados do paciente pode ocorrer prospectivamente ou
retrospectivamente.
A primeira é a aproximação preferida para assegurar que os dados sejam
precisos e completos. Permite-nos uma análise contínua do método de colecção de
dados para minimizar viéses ou erros na sua medição que possa diminuir a confiança
nos resultados que eles geram. Falta de dados sob a forma de valores anormais de
laboratório ou resultados de testes, torna problemático o acesso às disfunções do sistema
orgânico.1,3
Uma investigação retrospectiva pode apresentar dificuldades na reaquisição de
dados importantes. Isto pode levar a uma inapropriada associação da mortalidade com
um pequeno número de desarranjos orgânicos.1,3
Depois dos factores de risco serem identificados, eles usualmente são analisados
ou apresentados em dois formatos:
10
- uma escala cumulativa pode ser criada usando os factores de risco
identificados. Uma única escala derivada da soma do peso relativo dos factores
individuais é usada no APACHE, SAPS e TISS;
- métodos estatísticos directos podem ser empregues. O MPM, assim como
outros novos modelos, usa técnicas estatísticas.1,30
À medida que as ciências da informática médica e investigação de resultados
neste campo das U.C.I.’s se desenvolvem, novos métodos de computadores são
formulados para facilitar a junção destes dados e oferecerem aproximações alternativas
para a sua análise.1,31
DESENVOLVIMENTO ESTATÍSTICO DE UM MODELO DE PROGNÓSTICO
Na análise de regressão linear, é possível testar se duas variáveis estão
linearmente relacionadas e calcular a força da sua relação, quando essa relação é
descrita na forma y=+x (A) onde y é a variável dependente (a ser prevista), x é a
variável independente (cujos valores são usados para prever y), representa o valor de
y quando x é zero e representa a variação em y associada a uma unidade de acréscimo
em x.32
A
forma
usual
de
um
modelo
multivariável
é
a
equação
linear
y=b0+b1x1+b2x2+...+bkxk (B) onde y é a variável dependente, x1 até xk são as variáveis
independentes e b1 até bk e b0 são constantes com o mesmo significado que e
respectivamente.1
No caso de um modelo de prognóstico os factores de risco não estão
linearmente relacionados com a variável independente, normalmente a mortalidade (é
com esta que vamos trabalhar), por isso, são feitas transformações para que modelos
como o descrito na equação B possam ser usados. A técnica de análise de transformação
logística é comummente usada quando lidando com pontos de determinação binários,
como a mortalidade, e tem a propriedade de transformar uma curva em S numa linear.
(figura 1)1
Uma possível transformação pode ser feita na variável dependente. Isto é
conseguido adicionando 1 à variável e depois calculando o seu logaritmo natural. A
equação de regressão fica na forma ln (y+1) = +x. Também se podem fazer
transformações a nível de uma ou mais variáveis independentes.32
11
Para múltiplas variáveis, que é o que acontece nos modelos de prognóstico, este
método de análise é chamado de regressão logística múltipla, descrita pela seguinte
equação: P = eLT /(1+eLT) (C), em que P é a probabilidade do evento, e LT é a soma
linear das variáveis significativas da equação de regressão B.1
O APACHE, o MPM e o SAPS são os modelos mais reconhecidos que usam
esta técnica para desenvolver equações que relacionam o resultado com factores de risco
específicos de modo a obterem o valor da variável dependente a partir da relação com as
variáveis independentes.
Mas a regressão logística múltipla também tem sido usada com o objectivo de
identificar factores de risco adicionais que não tenham sido previamente incluídos nos
instrumentos de previsão geral. Isto faz-se porque é possível determinar quais as
variáveis de um conjunto que melhor prevêem a variável dependente e qual a extensão
da sua influência, e porque também se pode estudar a relação de uma única variável
controlando o efeito das outras na equação.1,33
De seguida apresentam-se alguns exemplos práticos para melhor se compreender
como tudo funciona, nomeadamente a escolha das variáveis, a relação entre as escalas
cumulativas e a regressão logística múltipla, e o emprego de outras técnicas estatísticas
usadas no desenvolvimento de um modelo de prognóstico.
SAPS
É possível melhorar um modelo alterando as variáveis, modificando os seus
pesos e incluindo informação acerca de estados de saúde e diagnóstico anteriores.
O SAPS foi desenvolvido a partir de um modelo pré–existente chamado APS
(Acute Physiology Score), calculado a partir de 34 variáveis fisiológicas e no qual um
valor de zero a quatro é atribuído a cada variável de acordo com o grau de anormalidade
e a soma de todos os valores dá-nos a pontuação final na escala predictiva do APS para
um determinado paciente.16 (tabela 1)
No final do desenvolvimento deste modelo, obteve-se uma ferramenta muito
mais barata e que consome muito menos tempo. Enquanto que no APS demorava-se
cerca de seis minutos a recolher os dados, no SAPS uma enfermeira treinada dispende
apenas um minuto. E isto porque as novas variáveis são em menor número,
nomeadamente as biológicas, tornando-se menos desconfortante para o paciente, e
muito mais fáceis de medir.16
12
Das 34 variáveis passou-se para 13 através da análise de discriminação linear
que serviu para testar a influência delas na mortalidade usando uma regressão linear
múltipla. Muitos subgrupos de cinco ou seis variáveis tinham o mesmo poder
discriminatório. No entanto, cada um destes subgrupos reflectia apenas um ou dois
modelos fisiológicos pelo que se escolheu as 13 mais facilmente medidas que cobriam
quase todos os modelos.16
A escolha das variáveis foi acertada também pelo facto de dados complexos
estarem presentes numa maior percentagem de pacientes (50% em vez de 30%) e um
máximo de três valores faltarem nos restantes 50%. Também o novo conjunto de
variáveis aumenta o espectro de patologias sobre o qual o modelo é aplicável.16
A introdução da idade como uma décima quarta variável foi também muito
importante pois constatou-se haver uma relação entre esta e a mortalidade: a maior parte
das mortes em pessoas com uma pontuação pequena dá-se em pessoas idosas.16
SAPS II
O SAPS entretanto também já foi melhorado e é o SAPS II que é actualmente
mais utilizado pelo que vamos dar mais atenção à metodologia estatística deste.
No desenvolvimento do SAPS II também foi utilizada a análise de regressão
logística. Esta assistiu na (1) selecção de variáveis que constituíram o novo SAPS, (2)
na decisão dos grupos apropriados e atribuição de pontos para variáveis e (3) na
conversão da pontuação SAPS II numa probabilidade de morte hospitalar.17
A recolha de dados inclui informação demográfica do paciente, todas as
variáveis que constituem o SAPS original, um conjunto de novas variáveis e o estado
vital à entrada na U.C.I.. As variáveis fisiológicas foram recolhidas como o pior valor
nas primeiras 24 horas na U.C.I. Como em qualquer modelo baseado em medições
clínicas, muitas vezes pode não ser possível recolher todos os dados. Este problema foi
ultrapassado assumindo que os valores não calculados estão dentro dos limites
normais.17
As novas variáveis foram independentemente avaliadas pela sua relação com a
mortalidade hospitalar e foram destacadas aquelas com uma maior relação utilizando-se
a já referida função de discriminação linear. Como resultado, das 37 variáveis estudadas
apenas 17 foram incluídas no SAPS final.17
13
A técnica LOWESS34 foi um método utilizado para produzir valores de y para
valores de x identificando os chamados cut points (valores de corte) que definem os
limites de uma amplitude de valores de x associados a mudanças nos valores de y.17
Para associar pontuações aos intervalos de x usou-se a análise de regressão
múltipla. Os coeficientes resultantes desta análise foram multiplicados por dez e
arredondados ao integral mais próximo. Assim, calculou-se o valor correspondente a
cada variação de x. Depois foi usada a equação de regressão logística que vimos atrás
para converter o score final numa probabilidade de morte. O LT neste caso calcular-seia da seguinte maneira: 0+1 (SAPS II score)+ 2 [ln (SAPS II score +1)].17
MPM
Como o ambiente numa U.C.I. não é estático, os modelos têm de ser
continuamente actualizados. O MPM não foi excepção e agora consiste de um conjunto
de quatro modelos: o MPM0, MPM24, MPM48 e o MPM72., sendo os números referentes à
hora a partir da qual se faz a recolha de dados.18,19
Como exemplo, apresenta-se a descrição do desenvolvimento estatístico do
MPM0 para mostrar outras técnicas estatísticas usadas.
Associações de variáveis independentes categóricas (tabela 2) com a mortalidade
hospitalar foram alcançadas com testes 2 (qui quadrado), e a significância de variáveis
contínuas foi conseguida com testes t de student principalmente.33,35 As variáveis foram
então consideradas na regressão logística múltipla se estivessem significativamente
relacionadas com a mortalidade num valor de probabilidade P menor que 0,1 (resultado
do teste) e se pelo menos dois por cento da população exibisse esse factor. Outro
método, a estatística Kappa36, foi usada para avaliar a concordância das variáveis.19
Usando o método maximum likelihood32, os coeficientes de regressão estimados e os
seus Ses foram calculados. Variáveis foram eliminadas do modelo a partir também deste
método.19
A tabela 3 apresenta as variáveis independentes, os coeficientes de regressão
logística estimados, os Ses estimados, as odds ratios32 ajustadas e intervalos de 95% de
confiança para estas, no MPM0 final. Como se pode constatar, as variáveis que melhor
parecem conseguir prever a mortalidade hospitalar são o estado de coma ou o torpor
profundo e insuficiência renal, cada uma tendo uma odds ratio de 4,4, o que significa
que um paciente nestas condições, terá uma probabilidade 4,4 vezes maior de morrer
que um outro que não sofra de nenhuma destas condições.19
14
O cálculo da probabilidade de morte com este modelo está ilustrado na tabela 4.
Note-se que cada variável, excepto a idade (cujo valor entra directamente nos cálculos),
recebe um valor de zero ou um, conforme não está ou está presente, respectivamente. O
logit é calculado da maneira que já se viu para o SAPS e a sua transformação em
probabilidade também é igual. O que diferencia este modelo dos outros, principalmente,
é que não entra com uma escala cumulativa no cálculo da probabilidade de morte.19
O desenvolvimento dos MPM seguintes foi feito a partir dos mesmos princípios
matemáticos e caracterizam-se por serem modelos com variáveis do modelo anterior
mas também novas variáveis ,mais facilmente medidas, (tendência constante na
actualização dos modelos) sendo as medições destas feitas após 24, 48 e 72 horas de
estadia numa U.C.I.3
VALIDAÇÃO DOS MODELOS DE PROGNÓSTICO
O número de modelos de prognóstico disponíveis cria muitas vezes confusões
sobre qual o método que será mais apropriado e eficaz para o uso pretendido. Assim, é
de extrema importância saber se um modelo foi validado ou não, uma vez que o
objectivo principal da validação é verificar a relação correcta que existe entre a previsão
e o resultado obtido. A comparação directa entre os vários modelos e também com um
modelo perfeito representam uma aproximação da sua validação. No entanto, esses
estudos comparativos não foram realizados e até ao momento não existe nenhum
“modelo de ouro” para as U.C.I.’s. Outras técnicas foram desenvolvidas para saber da
eficácia dos modelos, algumas das quais são referidas ao longo deste trabalho.1
Duas considerações devem ser levadas em conta durante a validação de um
modelo – a discriminação e a calibração do instrumento de previsão. A discriminação
define a qualidade com que o modelo descrimina entre os pacientes (aqueles que irão
morrer contra aqueles que irão sobreviver) e é comummente representada pelas curvas
ROC. A calibração refere-se à actual correlação entre a previsão e o resultado actual
para a inteira amplitude de risco e é avaliada através das estatísticas goodness-of-fit.1
Discriminação
Uma two-by-two table permite uma apresentação detalhada de cada cut point
usado na construção de uma curva ROC. Estas tabelas (tabela 5) são usadas para
comparar os resultados obtidos com os previstos e assim determinar a sensibilidade, a
15
especificidade, os valores de previsão e as correctas classificações de avaliação para o
modelo. A tabela 5 ilustra um exemplo no qual um valor de corte de 50% (isto é,
valores iguais ou acima de 50% são considerados como prevendo a morte e valores
abaixo de 50% são tomados como prevendo a sobrevivência) foi escolhido para obter a
mortalidade como resultado. Se em 100 pacientes assumimos que 50 têm uma previsão
de mortalidade superior a 50% e se concluirmos que desses 50 apenas 25 realmente
morrem, então a avaliação da falsa classificação será de 25% uma vez que estava
previsto que todos esses 50 pacientes morressem, segundo a escolha de um ponto
notável de 50%. 1
Deste modo, as curvas ROC (figura 2) desenham a razão de “verdadeiros
positivos”- TP - (isto é, uma expressão de sensibilidade igual a [TP*1 / (TP + FN)], onde
FN são previsões falsas negativas) no eixo vertical contra razões de falsos positivos
(isto é, [FP*2 / (TN + FP)] igual a [1 – especificidade] e onde TN = previsões
verdadeiras negativas) no eixo horizontal. As curvas ROC também dão informação
quanto à eficácia do modelo poder atingir 100% de sensibilidade*3 e 100% de
especificidade*4. À medida que a área abaixo da curva ROC se aproxima de 1.0 torna-se
mais discriminante; à medida que a área se aproxima de 0,5 ele torna-se mais falível nas
suas determinações.1
Calibração
Para a calibração de um modelo utilizam-se as estatísticas goodness-of-fit
(técnica de Hosmer-Lemeshow).1 A técnica de Hosmer-Lemeshow (tabela 6) é baseada
no cálculo da mortalidade esperada em grupos formados usando intervalos de
probabilidade iguais, normalmente de 10%, os quais são comparados com a mortalidade
observada. Dentro de cada decil o número previsto de mortes é calculado ao somar a
probabilidade de mortalidade para cada paciente naquele decil. Se a diferença entre os
resultados observados e esperados nalgum(s) grupo(s) for significativa, isso significa
que o modelo está mal calibrado.17,37
*1 – TP = true positive = verdadeiro positivo = número de mortes previstas / número de mortes
*2 – FP = false positive = falso positivo = número de mortes previstas / número de sobreviventes
*3 – Sensibilidade é a proporção de verdadeiros positivos
*4 – Especificidade = (um menos a proporção de falsos positivos) 7
SAPS II
16
Para um melhor conhecimento da validação nos modelos de prognóstico nada
melhor que dar um exemplo da sua aplicação num dos mais conceituados.
No SAPS II, para avaliar a performance do modelo realizaram-se testes formais
de goodness-of-fit (Hosmer-Lemeshow) tanto na série de dados do desenvolvimento
como na série de dados da validação para avaliar a calibração. O valor da probabilidade
para o teste de goodness-of-fit foi 0,883. Uma vez que este valor é largo
(consideravelmente maior que 0,05), o modelo reflecte muito proximamente a
verdadeira experiência de mortalidade na série de dados do desenvolvimento. Na série
de dados da validade, o valor da probabilidade para o teste de goodness-of-fit foi 0,104,
sugerindo que o modelo reflecte a possibilidade de mortalidade num grupo de pacientes
independente daqueles no qual o modelo foi desenvolvido.17
As áreas abaixo das curva ROC para o SAPS II foram 0.88 (95% de intervalo de
confiança, 0,87 a 0,90) no conjunto de dados do desenvolvimento e 0,86 (95% de
intervalo de confiança, 0,84 a 0,88) na série de dados da validação. Áreas desta largura
são geralmente reconhecidas como constituindo uma excelente discriminação.17
O SAPS anterior (14 variáveis) foi calculado para cada paciente na série de
dados da validação. Os resultados mostram que o SAPS II (17 variáveis) oferece uma
melhoria significativa em todos os aspectos. A área abaixo da curva ROC foi 0,80 para
o SAPS anterior enquanto foi 0,86 para o SAPS II. Para além disso, o coeficiente de
correlação entre o SAPS e o SAPS II foi 0,79, o que prova que apenas 62% da
variabilidade no SAPS II pode ser explicado pelo modelo antigo.17
A performance do SAPS II demonstra de que é um modelo extremamente
efectivo para estimar a probabilidade de morte para os pacientes das U.C.I.’s.17
17
Conclusão
Estes modelos, pertencentes ao novo ramo da ciência biomédica – a
prognosticação – apesar de ainda relativamente desconhecidos têm vindo a ganhar uma
crescente importância, nomeadamente nas U.C.I.’s.2
No entanto ainda apresentam várias limitações:
Apesar de se basearem em medidas prospectivas, há a necessidade de
haver um fácil acesso de dados relativos ao historial do paciente. O
problema reside no facto das informações não estarem disponíveis e
organizadas, sendo frequente a perda de dados-chave.3,20
Muitos investigadores reconhecem que alguns modelos não são tão
fiáveis na previsão de risco de morte individual como na previsão
relativa a grupos de pacientes.21
A sua aplicabilidade é também posta em causa quando se trata da
generalização do modelo para outras populações, além daquela onde
se desenvolveu o modelo.20
Para resolver estas limitações, certos investigadores crêem que para assegurar a
segurança do uso dos modelos é necessária a realização de testes que assegurem a sua
eficiência.20 No entanto verifica-se que, apesar dos métodos de avaliação já estarem
bem desenvolvidos, estes não são extensivamente utilizados, o que resulta na
desvalorização da informação, que os modelos pouco avaliados e usados produzem.3
Como consequência destas e outras limitações, como a complexidade funcional
inerente ao uso de modelos e a falta de credibilidade, os médicos encontram-se ainda
muito indecisos, como se observa na seguinte afirmação:
“... médicos estarão reticentes em usá-lo (o modelo) para informar os seus
pacientes de decisões a menos que acreditem no modelo e suas previsões.”20
Outra limitação relativamente ao uso destes modelos no apoio à decisão clínica é
a questão ética, inerente á decisão de quais indivíduos deverão ou não beneficiar de
determinados recursos. Esta situação confronta os pacientes e familiares, que querem o
direito e autoridade para escolher entre todas as alternativas terapêuticas com a
necessidade de gestão dos recursos, uma vez que esta é cada vez mais uma questão
pertinente na área da saúde.21
18
Em relação a desenvolvimentos futuros destes modelos, verifica-se que estes
passarão essencialmente pela avaliação das fontes de viéses mais importantes como por
exemplo: os critérios de internamento e alta dos doentes das U.C.I.’s, a qualidade de
cuidados prestados, protocolo de recolha de dados e a incorporação nestes modelos de
colheita automatizada de dados. Esta última evolução permitiria a facilitação do
trabalho de recolha manual de variáveis e poupança a nível de recursos económicos
(como por exemplo, o acesso a análises recentes, por registo electrónico, evita
realizações desnecessárias de novas análises).2
Conclui-se que se, apesar de todas as suas limitações, estes modelos forem
sujeitos a sérias avaliações e consequentes desenvolvimentos, podem tornar-se
ferramentas extremamente úteis nas U.C.I.’s fundamentalmente no(a):
No auxílio a decisões clínicas.2
A melhorar o uso de recursos.2
Permitindo comparações entre U.C.I.’s.5
Em relação a este último ponto as coisas não são assim tão lineares pois as
diferentes U.C.I.’s não recebem o mesmo tipo de pacientes em relação à gravidade do
seu estado e variedade de causas de internamento, nomeadamente devido à sua área de
localização, e as U.C.I.’s também não são uniformes quanto aos equipamentos e pessoal
de trabalho o que pode ter uma grande influência nos resultados do internamento dos
pacientes.2
19
Bibliografia
1. Kollef, M.H.; Schuster, D.P.; Predicting intensive care unit outcome with
scoring systems. Underlying concepts and principles; Critical care clinics;
1994 Janeiro; 10(1); pp. 1-18
2. Carneiro, A.V.; Girão, J.; Ivo, M.; Lopes, M.G.; de Pádua, F.; Prognostic
systems in intensive care: general principles, development and clinical
applications; Acta Med. Port.; 1993 Fevereiro; 6(2); pp. 87-93
3. Rue, Montse; Statistical issues related to applying severity models; Critical
Care Medicine; 1997; 3; pp. 175-178
4. Hanley, J.A.; McNeil, B.J; The meaning and use of the area under a receiver
operating characteristic (ROC) curve; Radiology; 1982; 143; pp. 29-36
5. Hosmer, D.W.; Lemeshow, S.; A review of goodness of fit statistics for use
in the development of logistic regression models; Am J Epidemiol; 1982;
115; pp. 92-106
6. Gunning, Kevin; Rowan, Kathy; ABC of intensive care. Outcome data and
scoring systems; BMJ;1999 Julho; 319; pp. 241-244
7. Hellman, S; Hellman D.S.; Of mice and man – problems of the randomised
clinical trial; N. Engl. J. Med.; 1991; 324; pp. 1589-1991
8. Evans, R.W.; Health care technology and the inevitability of resource
allocation and rationing decisions; JAMA; 1983; 249; pp. 2047-2053
9. Daly, B.; Henning, R.J.; McClish D.K; Clinical characteristics and resource
utilization of ICU patients; implementation for organization of intensive
care; Critical Care Medicine; 1987; 15; pp. 264-269
10. Kassirer, J.P.; Diagnostic Reasoning; Ann. Int. Med.; 1989; 110; pp. 893-900
20
11. Goldmann, L.; Neff, R.K.; Sox, H.C.; Wasson, J.H.; Clinical prediction
rules: application and methodological standards; N. Engle. J. Med.; 1985;
313; pp. 793-799
12. Briggs, B.A.; Civetta, J.M.; Cullen, D.J.; Therapeutic intervention scoring
system: a method for quantitative comparison of patient care; Critical Care
Medicine; 1974; 2; pp. 57-60
13. Cullen, D.J.; Keene, A.R.; Therapeutic intervention scoring system: update
1983; Critical Care Medicine; 1983; 11; pp. 1-3
14. Draper, Elizabeth A.; Knaus, William A.; Wagner, Douglas P.; Zimmerman,
Jack E.; APACHE II: A severity of disease classification system; Critical
Care Medicine; 1985; 13 (10); pp. 818-829
15. Draper, E.A.; Knaus, W.A.; Wagner, D.P.; The APACHE III prognostic
system; Risk prediction of hospital mortality for critically ill hospitalized
adults; 1991; 100; pp. 1619-1636
16. Alperovitch, Annick; Glaser, Paul; Granthil, Claude; Le Gall, Jean-Roger;
Loirat, Philippe; Mathieu, Daniel; Mercier, Philippe; Thomas, Remi; Villers,
Daniel; A simplified acute physiology score for ICU patients; Critical Care
Medicine; 1984 Novembro; 12 (11); pp. 975-977
17. Le Gall, Jean-Roger; Lemeshow, Stanley; Saulnier, Fabienne; A New
Simplified Acute Physiology (SAPS II) based on a European/North
American Multicenter Study; Jama; 1993 Dezembro; 270 (24); pp. 29572962
18. Avrunin, Jill Spitz; Gehlbach, Stephen H.; Klar, Janelle; Lemeshow, Stanley;
Rapoport, John; Rué, Montse; Teres, Daniel; Mortality probability models
for patients in the intensive care unit for 48 or 72 hours: a prospective
multicenter study; Critical Care Medicine; 1994; 22 (9); pp. 1351-1358
21
19. Avrunin, Jill Spitz; Gehlbach, Stephen H.; Klar, Janelle; Lemeshow, Stanley;
Rapoport, John; Teres, Daniel; Mortality Probability Models (MPM II) based
on an International Cohort of Intensive Care Units Patients; Jama; 1993
Novembro; 270 (20); pp. 2478-2485
20. Altman, D.G.; Wyatt, J.C.; Commentary: Prognostic models: clinically
useful or quickly forgotten?; BMJ; 1995 Dezembro; 311; pp. 1539-1541
21. Glance, G.; Laurent, K.; Tamotsu, Shinozaki; Turner, O.; Intensive care units
prognostic scoring systems to predict death: A cost-effectiveness analysis;
Critical Care Medicine; 1998; 26 (11); pp 1842-1849
22. Berger, M.; Bobbitt, R.A.; Carter, W.B.; The Sickness Impact Profile:
development and final revision of a health status measure; Medical Care;
1981; 19; pp. 787-806
23. Cleary,
P.D.;
Davies,
A.R.;
Jette,
A.M.;
The
Functional
Status
Questionnaire: Reliability and validity when used in primary care; J. Gen.
Intern. Medicine; 1986; 1; pp. 143-149
24. Gehlbach S.H.; Parkerson, G.R.; Wagner, E.H.; The Duke-UNC health
profile: an adult health status instrument for primary care; Medical Care;
1981; 19; pp. 806-823
25. Fowler, A.A.; Hamman, R.F.; Zerbe, G.O.; Adult respiratory distress
syndrome. Prognosis after onset; Am. Rev. Respir. Dis.; 1985; 132; pp. 472478
26. Gibbons, W.; Goldberg, P.; Menzies, R.; Determinants of weaning and
survival among patients with COPD who require mechanical ventilation for
acute respiratory failure; 1989; pp. 398-405
27. Brandt P.W.T.; Caughy D.E.; Norris, R.M.; A new coronary prognostic
index; Lancet; 1969; 1; pp. 274-278
22
28. Avrunin, J,S.; Lemeshow, S.; Teres, D.; Refining intensive care unit
outcome prediction by using changing probabilities of mortality; Critical
care Medicine; 1988; 16; pp. 470-477
29. Pastides, H; Lemeshow, S.; Teres, D.; A method for predicting survival and
mortality of ICU patients using objectively derived weights; Critical Care
Medicine; 1985; 13; pp. 519-525
30. Ferraris, V.A.; Propp, M.E.; Outcome in critical care pacients. A multivariate
study; Critical Care Medicine; 1992; 20; pp. 967-976
31. Kahn, K.L.; How well does the patient’s burden of illness explain differences
in outcome?; Mayo Clin. Proc.; 1992; 67; pp. 1203-1205
32. Menard, Scott; Applied logistic regression analysis; Sage publications; 1995;
série 7; número 106; pp. 1-17
33. Petrie, Aviva; Watson, Paul; Statistics for Veterinary and Animal Science;
Blackwell Science; 1999; pp. 114-137
34. Cleveland, W.S.; Robust locally weighted regression and smoothing
scatterplots; J Am Stat Assoc.; 1979; 74; pp. 829-836
35. Haiger, Alfred; Métodos Biométricos em Produção animal; Instituto
Universitário de Trás-os-Montes e Alto Douro; Vila Real; 1983; 1ª edição;
pp. 77-96
36. Haynes, R.B.; Sackett, D.L.; Tugwell, P; .The clinical examination; In
Clinical Epidemiology: A Basic Science for Clinical Medicine; Boston:
Little Brown and Company; 1985; pp. 17-45
37. Hosmer, D.W.; Lemeshow, S.; Applied logistic regression; WilleyInterscience; 1989; pp. 135-145
23
Agradecimentos
Ao Dr. Armando Teixeira Pinto pela sua colaboração e disponibilidade na
orientação do nosso trabalho e na resolução das nossas dúvidas.
Aos Serviços de Bioestatística e Informática Médica, Serviço de
Anestesiologia, Serviço de Pediatria e Serviço de Cirurgia 2, pela
disponibilização de artigos, livros e revistas necessárias na realização do
trabalho.
Ao Vice-Presidente da Secção Regional do Centro da Ordem dos Médicos,
Dr. João Paulo A. Sousa, pelas informações prestadas.
24
Fig. 11
Tabela 1: Valores dos resultados para as 14 variáveis do SAPS16
25
Tabela 2: Variáveis categóricas do MPM0 para o estado vital na saída do hospital19
Tabela 3: Variáveis do MPM0 com os seus coeficientes estimados, SEs, odds ratios ajustadas e 95% de
intervalos de confiança para as odds ratios ajustadas19
26
Tabela 4: Cálculo da probabilidade da mortalidade hospitalar19
Tabela 5: Tabela two-by-two para uma hipotética validação de um modelo 1
Fig.2 : Exemplo de uma hipotética curva de ROC demonstrando 3 diferentes pontos de corte: X (mais
específico para minimizar a previsão de um resultado positivo quando ele realmente não ocorre), Y e Z
(mais sensível para prever o resultado quando ele realmente ocorre) 1
27
Tabela 6: Teste de goodness-of-fit para a amostra de desenvolvimento do SAPS II em 8369 pacientes 17
28