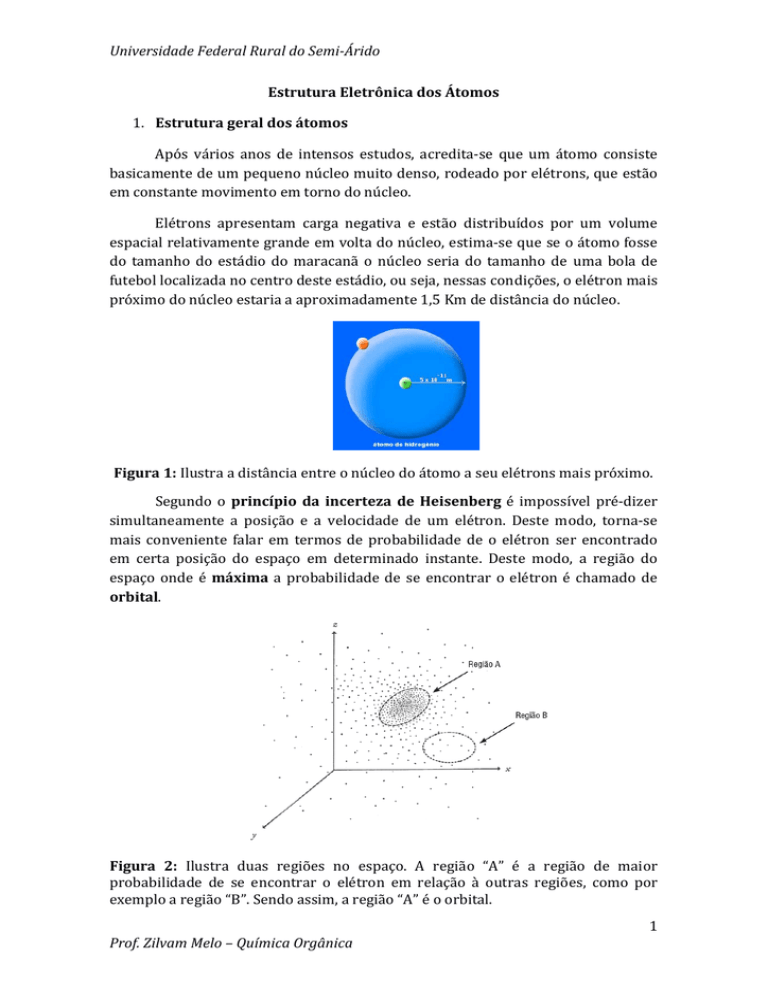
Universidade Federal Rural do Semi­Árido Estrutura Eletrônica dos Átomos 1. Estrutura geral dos átomos Após vários anos de intensos estudos, acredita‐se que um átomo consiste basicamente de um pequeno núcleo muito denso, rodeado por elétrons, que estão em constante movimento em torno do núcleo. Elétrons apresentam carga negativa e estão distribuídos por um volume espacial relativamente grande em volta do núcleo, estima‐se que se o átomo fosse do tamanho do estádio do maracanã o núcleo seria do tamanho de uma bola de futebol localizada no centro deste estádio, ou seja, nessas condições, o elétron mais próximo do núcleo estaria a aproximadamente 1,5 Km de distância do núcleo. Figura 1: Ilustra a distância entre o núcleo do átomo a seu elétrons mais próximo. Segundo o princípio da incerteza de Heisenberg é impossível pré‐dizer simultaneamente a posição e a velocidade de um elétron. Deste modo, torna‐se mais conveniente falar em termos de probabilidade de o elétron ser encontrado em certa posição do espaço em determinado instante. Deste modo, a região do espaço onde é máxima a probabilidade de se encontrar o elétron é chamado de orbital. Figura 2: Ilustra duas regiões no espaço. A região “A” é a região de maior probabilidade de se encontrar o elétron em relação à outras regiões, como por exemplo a região “B”. Sendo assim, a região “A” é o orbital. Prof. Zilvam Melo – Química Orgânica 1 Universidade Federal Rural do Semi­Árido O núcleo de um átomo contém prótons carregados positivamente e nêutrons que não apresentam carga. Sendo assim, o núcleo é carregado positivamente. Como a quantidade de carga positiva em um próton é igual à quantidade de carga negativa em um elétron, um átomo neutro tem o mesmo número de prótons e elétrons. Átomos podem ganhar elétrons e tornarem‐se carregados negativamente, ou podem perder elétrons para se tornarem carregados positivamente. Entretanto, o número de prótons em um átomo não muda. Figura 3: Ilustra o núcleo do átomo contendo prótons e neutros e os elétrons na eletrosfera. O que realmente define um átomo não é seu número de elétrons nem número de nêutrons e muito menos sua massa atômica (como se achava antigamente), mas sim o número de prótons. Assim, átomos diferentes apresentam números de prótons diferentes e, inclusive, a tabela a própria periódica atualmente é organizada de acordo com o número de prótons de cada elemento, pois observou‐se que organizando os elementos desta maneira eles apresentavam propriedade que se repetiam dentro de uma mesma família ou período (propriedades periódicas) Prótons e nêutrons têm aproximadamente a mesma massa e são aproximadamente 1.800 vezes Tabela 1: Constituintes do átomo. Partícula Elétron Próton Neutron Localização Eletrosfera Núcelo Núcleo Carga ‐ 1 + 1 0 Massa 1/1800 1 1 2. Estrutura Eletrônica dos Átomos 2.1 Números Quânticos São números que descrevem o elétron. Estes levam em consideração, dentre outras propriedades, sua energia, sua localização e sua rotação. Prof. Zilvam Melo – Química Orgânica 2 Universidade Federal Rural do Semi­Árido 2.1.1 Primeiro Número Quântico ou Número Quântico Principal (n): O número quântico principal nos dá a informação do nível de energia que o elétron apresenta. À medida que n aumenta, o orbital torna‐se maior, e o elétron passa mais tempo mais distante do núcleo. Um aumento de n significa também que o elétron tem energia mais alta e, por isso está menos fortemente preso ao núcleo. Todos os orbitais com mesmo valor de n estão na mesma camada, ou seja, apresentam o mesmo nível de energia; O número quântico principal pode assumir qualquer valor inteiro positivo (n = 1, 2, 3 ... ∞). Cada número representa um determinado nível de energia (também chamado de camada). As camadas podem ser identificadas por letras latinas maiúsculas, começando por K, para a primeira camada (n = 1). Daí em diante as letras seguem a ordem alfabética. 2.1.2 Segundo Número Quântico, Número Quântico Secundário ou Número Quântico Azimutal (ℓ) O número quântico secundário divide as camadas em grupos menores, denominadas subcamadas (ou subníveis), definindo o formato do orbital. Para um dado valor de n, ℓ pode variar de 0 a n – 1. Ou seja o número máximo de ℓ permitido é: ℓ = n – 1 (Eq. 1)
Os subníveis associados com os valores de ℓ = 0, 1, 2 e 3 são designados pelas letras: s, p, d e f, respectivamente; Tabela 2: Designação dos orbitais. Valor de n Valor de ℓ Designação dos orbitais 1 0 s 2 1 P 3 2 d 4 3 f Ordem de energia s < p < d < f ­ Energia crescente Prof. Zilvam Melo – Química Orgânica 3 Universidade Federal Rural do Semi­Árido Figura 4: Diagrama aproximado dos níveis de energia. 2.1.3 Terceiro Número Quântico, Número Quântico Terciário ou Número Quântico Magnético (mℓ) O número quântico magnético dá a orientação dos orbitais atômicos no espaço. Cada subnível consiste em um número específico de orbitais. Cada orbital corresponde a diferentes valores permitidos de mℓ. Os valores de mℓ são números inteiros que assumem diferentes valores dependendo do nível e subnível em questão. Para determinado valor de ℓ, existem 2ℓ + 1 valores permitidos de mℓ, variando de – ℓ a + ℓ. Portanto, cada subnível s (ℓ=0) consiste de um orbital; cada subnível p (ℓ=1) consiste em três orbitais; cada subnível d (ℓ=2) consiste em cinco orbitais; cada subnível f (ℓ=3) consiste de sete orbitais, e assim por diante. Orbitais de um mesmo subnível (ℓ = 2, por exemplo) apresentam a mesma energia e, por isso, são chamados de orbitais degenerados. Exemplos de orbitais: • Para ℓ = 0: corresponde ao orbital s, onde existe somente uma orientação permitida (mℓ = 0). Prof. Zilvam Melo – Química Orgânica 4 Universidade Federal Rural do Semi­Árido Figura 5: Ilustra o formato do orbital s • Para ℓ = 1: corresponde ao orbital p, onde existem três orientações permitidas (mℓ = ‐1, 0, 1) que coincidem com os três eixos cartesianos; Figura 6: Ilustra o formato do orbital p. • Para ℓ = 2: correspondem aos orbitais d onde existem cinco orientações permitida (mℓ = ‐2, ‐1, 0, 1, 2); Figura 7: Ilustra o formato do orbital d. Prof. Zilvam Melo – Química Orgânica 5 Universidade Federal Rural do Semi­Árido • Para ℓ = 3: correspondem aos orbitais f, onde existem sete orientações permitidas (mℓ = ‐3, ‐2, ‐1, 0, 1, 2, 3); Figura 8: Ilustra o formato do orbital f. Tabela 3: Capacidades dos quatro primeiros níveis. N ℓ 1 0 0 0 0 1 ‐1, 0, 1 0 0 1 ‐1, 0, 1 2 ‐2, ‐1, 0, 1, 2 0 0 1 ‐1, 0, 1 2 ‐2, ‐1, 0, 1, 2 3 ‐3, ‐2, ‐1, 0, 1, 2, 3 2 3 4 mℓ Subnível Elétrons máximos no subnível Elétrons máximos no nível 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 2 2 6 2 6 10 2 6 10 14 2 8 18 32 Prof. Zilvam Melo – Química Orgânica 6 Universidade Federal Rural do Semi­Árido 2.1.4 Quarto Número Quântico, Número Quântico Quaternário ou Número Quântico Magnético de Spin do Elétron (ms) O número quântico magnético de spin não está relacionado com o orbital, mas sim com o elétron. O ms está associado com a rotação do elétron em torno de seu próprio eixo. Os elétrons giram em rotação igual, porém em sentidos contrários. Para representá‐los convencionou‐se atribuir os valores +1/2 a um sentido de rotação e ‐1/2 ao outro sentido de rotação. Outra forma de representar os elétrons em orbitais seria como setas. Onde uma seta voltada para cima seria um sentido de rotação e uma seta voltada para baixo seria o outro sentido de rotação. Figura 9: Ilustra o modo de usar as setas para indicar a rotação do elétron. • Quando dois elétrons estão ocupando o mesmo orbital de um mesmo subnível diz‐se que seus elétrons estão emparelhados. Com spins opostos. Figura 10: Ilustra o emparelhamento de dois elétrons. 2.2 Principio da Exclusão de Pauli O princípio da exclusão de Pauli estipula que: a) Não mais que dois elétrons podem ocupar cada orbital; b) Em um átomo não pode existir dois elétrons com os quatro números quânticos iguais. Prof. Zilvam Melo – Química Orgânica 7 Universidade Federal Rural do Semi­Árido Assim, para não ferir este princípio, se quisermos colocar mais de um elétron dentro de um mesmo orbital a única opção é assinalar diferentes valores de ms para os elétrons. Como só existem dois valores de ms, concluímos que um orbital pode comportar no máximo dois elétrons, e eles devem apresentar spins opostos (+1/2 e ‐1/2). 2.3 Configuração Eletrônica A maneira na qual os elétrons estão distribuídos entre os vários orbitais de um átomo é chamada de configuração eletrônica. A mais estável configuração eletrônica de um átomo é aquela na qual os elétrons estão nos estados mais baixos de energias possíveis. Como o princípio da exclusão diz que pode haver no máximo dois elétrons no mesmo orbital, devemos preencher os orbitais em ordem crescente de energia. O preenchimento dos diagramas de orbitais de cada subnível segue a Regra de Rund. Regra de Rund: quando orbitais de mesma energia (degenerados) estão sendo preenchidos, a menor energia será atribuída quando o maior número de elétrons com mesmo spin permaneça maximizado, ou seja, maior número de elétrons com mesmo ms. Diz­se que os elétrons dessa forma têm spins paralelos ou, ainda, emparelhados. Notações: A
Z
Onde: X simboliza o elemento químico; A é o número de massa (no prótons + no nêutrons); Z é o número atômico (no prótons) Z é numericamente igual ao no elétrons) X
onde: C é o símbolo que representa o átomo de carbono 12 é número de massa (no prótons + no nêutrons) 12
6 é o número atômico, ou seja é o n prótons, que é 6
numericamente igual ao n
elétrons. C
o
o
Prof. Zilvam Melo – Química Orgânica 8 Universidade Federal Rural do Semi­Árido 2.4 Diagrama de Energia de Pauling O cientista americano Linus C. Pauling apresentou a teoria até o momento mais aceita para a distribuição eletrônica. Pauling apresentou esta distribuição dividida em níveis e subníveis de energia. A distribuição eletrônica, conforme Pauling, não era apenas uma ocupação pelos elétrons dos espaços vazios nas camadas da eletrosfera. Os elétrons se distribuem segundo o nível de energia de cada subnível, numa seqüência crescente em que ocupam primeiro os subníveis de menor energia e, por último, os de maior. O diagrama de energia de Pauling define a ordem de energia crescente que é também a seqüência de distribuição dos elétrons: Figura 11: Ilustra como ocorre a distribuição eletrônica. Na Figura 11, as setas indicam a ordem crescente dos níveis de energia, concordando com o diagrama de energia na Figura 4, veja: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 … Note que como a energia de 4s2 é menor, esta posição vem antes do 3d10. Assim, seguindo o diagrama de Pauling, podemos montar a distribuição eletrônica de qualquer elemento químico. Prof. Zilvam Melo – Química Orgânica 9 Universidade Federal Rural do Semi­Árido Exemplos: • Para 9F, temos: 1s2, 2s2, 2p5 • Para 20Ca, temos: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2 • Para 40Zr, temos: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 Com o diagrama de Pauling pode‐se fazer a distribuição eletrônica de vários compostos. Uma observação cuidadosa nos mostra que há umas poucas exceções para estas regras. Duas exceções dignas de nota são o cromo e o cobre. Seguindo as regras que estudamos esperaríamos que suas configurações fossem: 24Cr: 1s
2 2s2 2p6 3s2 3p6 4s2 3d4 29Cu: 1s
2 2s2 2p6 3s2 3p6 4s2 3d9 No entanto, as distribuições eletrônicas determinadas experimentalmente são: 24Cr: 1s
29Cu: 1s
2 2s2 2p6 3s2 3p6 4s1 3d5 2 2s2 2p6 3s2 3p6 4s1 3d10 Os diagramas de orbitais correspondentes são: Cr
24
4s
3d
3d
Cu
29
4s
Note que, no caso do cromo, um elétron foi “emprestado” pelo subnível 4s para um subnível 3d que ficou exatamente com metade de sua “população” de elétrons máxima. Já no caso do cobre, este mesmo elétron 4s é utilizado para preencher completamente uma subcamada 3d. 3. Ligações Químicas As ligações químicas que ocorrem naturalmente a fim de se formar compostos mais estáveis, ou seja, de menor energia. 3.1 Estruturas de Lewis As ligações ocorrem usando os elétrons presentes na última camada, ou seja, na camada de valência. Elétrons presentes na camada de valência são 10 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido chamados elétrons de valência. Para representar um átomo usando uma estrutura de Lewis deve‐se representar o átomo por seu símbolo químico, os elétrons de valência por pontos e as ligações por traços. Veja os exemplos abaixo: Tabela 4: Estruturas de Lewis 3.2 A Regra do Octeto Por muito se estudou os gases nobres devido poderem ser encontrados na natureza na sua forma atômica, ou seja, não necessitam de fazer ligações para se estabilizarem. Quando estudaram suas estruturas observaram que, com exceção do Hélio, todos os gases nobres apresentam oito elétrons em sua última camada. Assim, concluíram que qualquer os átomos tendem a se ligar ganhando, perdendo ou compartilhando elétrons para alcançar a configuração de um gás nobre, ou seja, oito elétrons em sua camada de valência. Fazendo isso os átomos alcançariam sua estabilidade. Deste modo, surgiu a Regra do Octeto que dá base para que se possa montar uma infinidade de estrutura de moléculas. H
+
O
+
H O H
H
ou
H
O
H
H
H
H C H
H
Li
+
H
C
H
F
H
Li + F
Alguns compostos fogem a Regra do Octeto como, por exemplo, o pentacloreto de fósforo, PCl5, no qual o átomo de fósforo é ligado covalentemente cinco átomos de cloro. Prof. Zilvam Melo – Química Orgânica 11 Universidade Federal Rural do Semi­Árido Cl
Cl
Cl
P
Cl
Cl
Deste modo, a camada de valência do fósforo possui 10 elétrons. Neste caso, dizemos que a camada de valência se expandiu. Algumas vezes a camada de valência de um átomo numa molécula contém menos elétrons do que o octeto. Este é o caso do trifluoreto de boro, BF3,: F
F
B
F
Neste composto a camada de valência do boro é ocupada por apenas três pares de elétrons, pois o número total de elétrons de valência é insuficiente para atingir o octeto. Novamente a regra do octeto é desrrespeitada. 3.3 Ligações Iônicas Na ligação iônica ocorre a formação de íons devido a transferência de elétrons, que residem na camada mais externa (camada de valência), de um átomo para o outro. Normalmente, nesta ligação, existe um elemento que tende a ceder elétrons (metal ‐ cátion), e outro que tende a receber elétrons (não metal ‐ ânion). Observação: A ligação iônica é a única em que ocorre a transferência de elétrons. A ligação se dá devido à atrações eletrostáticas fortes que se estabelecem entre os íons. Este tipo de ligação são não direcionadas, ou seja, podem ocorrer com dois ou mais átomos, como pode‐se ver na Figura 12. Exemplos Para 11Na, temos: 1s2, 2s2, 2p6, 3s1 Para 17Cl, temos 1s2, 2s2, 2p6, 3s2, 3p5 Prof. Zilvam Melo – Química Orgânica 12 Universidade Federal Rural do Semi­Árido Temos: 10Na+: 1s2, 2s2, 2p6, 3s0 Temos: 18Cl‐ : 1s2, 2s2, 2p6, 3s2, 3p6 Na
+
Cl
Na+ Cl
Figura 12: Ilustra o retículo cristalino do cloreto de sódio. 3.4 Ligações Covalentes Ligação covalente é aquela onde os átomos possuem a tendência de compartilhar os elétrons de sua camada de valência. Neste tipo de ligação não há a formação de íons, pois as estruturas formadas são eletronicamente neutras. Figura 13: Ilustra como se dá a atração entre dois átomos numa ligação covalente. As ligações covalentes são mais fracas que as ligações iônicas. Estas ligações são orientadas, ou seja, cada ligação envolve apenas dois átomos. Exemplos: Prof. Zilvam Melo – Química Orgânica 13 Universidade Federal Rural do Semi­Árido Figura 14: Ilustra exemplos de compostos com ligações covalentes. 3.4.1 Tipos de Ligações Covalentes 3.4.2 Ligação Normal ou Ligação Sigma (σ) Nas ligações covalentes que consideramos até aqui, está concentrada simetricamente ao redor da linha que une os núcleos (eixo intermolecular). Em outras palavras a ligação se dá pela sobreposição frontal desses orbitais ao longo do eixo de ligação. Essas ligações são chamadas ligações sigma (σ). Figura 15: Ilustra a sobreposição frontal para formação de ligação σ. Entre dois átomos ligados por ligação covalente só pode existir uma ligação sigma; Cada átomo que participa da ligação colabora com um elétron para a formação da ligação. Os orbitais possuem uma simetria cilíndrica ao longo do eixo de ligação; Exemplos de compostos com ligação σ: 3.4.3 Ligações Pi (π) – Ligações Múltiplas (Duplas ou Triplas) Prof. Zilvam Melo – Química Orgânica 14 Universidade Federal Rural do Semi­Árido Os eixos dos orbitais da ligação π ficam orientados perpendicularmente aos da ligação σ (acima e abaixo do eixo imaginário). Só pode formar uma ligação π (ligação dupla) onde já existir uma ligação σ. Se entre dois átomos existirem duas ligações π (ligação tripla), então elas serão perpendiculares entre si. Figura 16: Ilustra a sobreposição lateral para formação de ligação π. Exemplos de compostos com ligação π: 3.4.4 Ligação Covalente Coordenada ou Dativa Na ligação covalente coordenada o par de elétrons da ligação é proveniente de um único átomo. H
H
Cl
N
B
H
Cl
Cl
O
S
O
3.4.5 Ligação Covalente Polar É gerada quando átomos de diferentes eletronegatividades se ligam. Eletronegatividade: É a habilidade relativa de um átomo em atrair, com maior ou menor intensidade, para si elétrons que estão sendo compartilhados em uma ligação covalente. Prof. Zilvam Melo – Química Orgânica 15 Universidade Federal Rural do Semi­Árido O cloreto de hidrogênio possui uma extremidade parcialmente positiva e outra parcialmente negativa, está molécula apresenta um dipolo e possui um momento dipolo (μ). O momento dipolo pode ser calculado pela equação abaixo: μ=e x d Momento dipolo = carga (em Coulomb) x distância (em metro) A unidade dos momentos dipolos normalmente são dadas em debey (D): 1 D = 3,33 x 10‐30 C x m Figura 17: Ilustra a tabela periódica com valores de eletronegatividade de todos os elementos. 3.4.6 Ligação covalente Apolar Quando dois ou mais átomos da mesma ou de eletronegatividades similares reagem, não ocorre uma transferência completa de elétrons. Nesses casos, os átomos alcançaram configurações de gás nobre compartilhando elétrons. Prof. Zilvam Melo – Química Orgânica 16 Universidade Federal Rural do Semi­Árido Ligações covalentes se formam entre os átomos, e seus produtos são chamados de moléculas. H
H
C
N
H
H
N
Exemplo de compostos polares e apolares Figura 18: Ilustra compostos com ligações polares e apolares. 4. Hibridização e Geometria dos Compostos do Carbono A distribuição eletrônica para o átomo de carbono no estado fundamental é: C
6
1s2
2s2
2px
2py
2pz
Sendo assim só seria possível do carbono formar duas ligações σ, haja vista que o carbono apresenta somente dois elétrons desemparelhados para formarem ligações. No entanto, foi comprovado que o carbono forma diversos compostos com quatro ligações sigma ou com duas ligações σ e uma ligação π ou, ainda uma ligação σ e duas ligações π. Como isso pode ocorrer? A explicação para tal fenômeno vem da teoria de hibridização. A hibridização é a mistura de orbitais. Prof. Zilvam Melo – Química Orgânica 17 Universidade Federal Rural do Semi­Árido Com esta mistura os o átomo de carbono pode assumir três estados de hibridização (sp3, sp2 e sp) e cada estado de hibridização tem suas características intrínsecas. O fenômeno da hibridização só pode ocorrer se os orbitais envolvidos tiverem energias próximas, possibilitando a migração de um elétron de um orbital de menos energético para um mais energético. 4.1 Hibridização sp3 (ligações σ) Quando o carbono está hibridizado em sp3 ocorre a mistura do orbital 2s com os três orbitais 2p. Assim, um dos elétrons do orbital 2s migra para o orbital 2p, que está vazio. C
6
1s 2
sp3
Podemos entender esta hibridização usando um diagrama de energias dos elétrons no estado fundamental e no estado excitado. Figura 19: Diagrama de energia para a hibridização sp3. Neste processo, ocorre a formação de quatro orbitais híbridos sp3 com um elétron desemparelhado em cada. Estes orbitais híbridos ficam orientados a ângulos de 109,5o em relação uns aos outros. Estes ângulos formam uma estrutura tetraédrica. A sobreposição dos quatro orbitais híbridos sp3 é frontal por isso o Prof. Zilvam Melo – Química Orgânica 18 Universidade Federal Rural do Semi­Árido carbono se torna capaz de formar compostos com quatro ligações σ, assumindo estruturas tetraédricas, como exemplifica a Figura 20. Figura 20: Exemplo de estrutura tetraédrica. Abaixo veja como se dá a formação do etano pela sobreposição dos orbitais híbridos sp3 para a formação de quatro ligações σ C−C e C−H. Figura 21: Ilustra a formação de ligações σ pela sobreposição frontal dos orbitais que participam das ligações. Todas as ligações que se formam, tanto C‐C como C‐H são ligações σ. Prof. Zilvam Melo – Química Orgânica 19 Universidade Federal Rural do Semi­Árido 4.2 Hibridização sp2 (ligações σ e ligações π) Quando o carbono está hibridizado em sp2 ocorre a mistura do orbital 2s com dois orbitais 2p. Assim, um dos elétrons do orbital 2s migra para o orbital 2p, que está vazio, restando um orbital p puro que não participou da sobreposição. 6
C
p
1s 2
sp
2
Podemos entender esta hibridização usando um diagrama de energias dos elétrons no estado fundamental e no estado excitado. Figura 22: Diagrama de energia para a hibridização sp2. Neste processo, ocorre a formação de três orbitais híbridos sp2 com um elétron desemparelhado em cada. Os três orbitais híbridos são orientados para os cantos de um triângulo regular, com ângulos de 120o entre si, gerando estrutura trigonal planar, como exemplifica a Figura 23. O orbital p puro (que não sofreu hibridização) fica orientado perpendicularmente ao plano do triângulo formado pelos orbitais híbridos sp2. Prof. Zilvam Melo – Química Orgânica 20 Universidade Federal Rural do Semi­Árido Figura 23: Exemplo de estrutura trigonal planar. Os três orbitais híbridos sp2 podem sofrer sobreposição frontal. Deste modo, o carbono se torna capaz de formar compostos com três ligações σ. Abaixo veja como se dá a formação do eteno pela sobreposição dos orbitais sp2 para formação de ligações σ C−C e C−H. Figura 24: Ilustra a sobreposição dos orbitais sp2 para a formação de ligações σ. Já o orbital p pode sofrer sobreposição perpendicular ao eixo de ligação frontal, gerando assim, uma ligação π. Este tipo de hibridização possibilita o carbono gerar estruturas trigonal planar com uma ligação π, como, por exemplo o eteno, assim como exemplifica a Figura 25. Figura 25: Ilustra a sobreposição de orbitais p para a formação de ligações π. 4.3 Hibridização sp (ligações σ e ligações π) Prof. Zilvam Melo – Química Orgânica 21 Universidade Federal Rural do Semi­Árido Quando o carbono está hibridizado em sp ocorre a sobreposição do orbital 2s com um orbitais 2p. Assim, um dos elétrons do orbital 2s migra para o orbital 2p, que está vazio. C
6
1s 2
sp
p
p
Podemos entender esta hibridização usando um diagrama de energias dos elétrons no estado fundamental e no estado excitado. Figura 26: Diagrama de energia para a hibridização sp. Neste processo, ocorre a formação de dois orbitais híbridos sp, com um elétron desemparelhado em cada. Os dois orbitais híbridos são orientados a um ângulo de 180o em relação um com o outro. Cada um dos dois orbitais p puros (que não sofreu hibridização) ficam orientados perpendicularmente ao eixo frontal de ligação dos dois orbitais híbridos sp. Os dois orbitais híbridos sp podem sofrer sobreposição frontal, gerando a formação de ligações σ, como mostra a Figura 27. Figura 27: Ilustra a sobreposição dos orbitais sp para a formação de ligações σ. 22 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido Já os orbitais p não‐hibridizados podem sofrer sobreposição perpendicular entre si ao eixo de ligação frontal. Este tipo de hibridização possibilita o carbono gerar estruturas lineares com duas ligações σ e duas ligações π. 5. Comprimento de ligações O comprimento de ligação segue a seguinte seqüência: C
C
> C
C
> C
C O princípio geral diz que: quanto maior for o caráter s dos orbitais que participam da ligação menor será o comprimento da ligação. Assim, quando o carbono está hibridizado em sp ele apresenta 50% de caráter s, por isso apresenta menor comprimento de ligação do que os compostos nos quais as átomos de carbono apresentam ligações duplas e este, por sua vez, apresenta menor comprimento do que os compostos que ligações simples. Tabela 5: Mostra as características que os átomos sofrem ao se hibridizarem. Tipo de hibridização sp3 sp2 sp Ligações que se formam 4σ 3σ e 1π 2σ e 2π Caráter s (%) 25 33,3 50 Geometria Tetraédrica Triangular Linear Ângulos das ligações (o) 109,5 120 180 6. Definições Importantes Moléculas diatômicas: São formadas por apenas dois átomos. Ex: H2, N2, O2; Moléculas poliatômicas: São formas por mais de dois átomos. Ex: H2O, C2H6, CH3CH2OH; Prof. Zilvam Melo – Química Orgânica 23 Universidade Federal Rural do Semi­Árido A forma de uma molécula no espaço é altamente influenciada pelos pares de elétrons de valência dos átomos que a constituem. Podem ser de dois tipos: Par de elétrons de ligação: são os elétrons compartilhados entre dois átomos para a formação de uma ligação covalente; Par de elétrons isolados: são os elétrons que ocupam um orbital que pertence somente a um átomo e não foram usados para formar ligações. 7. Referências BROWN, LEMAY e BURSTEN. Química: Ciência Central. 9. ed. São Paulo: Pearson, 2007. SOLOMONS, T. W.; GRAHAM; CRAIG FRYHLE. Química Orgânica. 8. ed. Rio de Janeiro: LTC, 2005. 1 e 2 v. BRUICE, P. Y. Química Orgânica. 4. ed. São Paulo: Pearson, 2006. Prof. Zilvam Melo – Química Orgânica 24












