Reações e Compostos Gerados na Revelação por Cromatografia
em Camada Delgada com Anisaldeído e Vanilina
Gabriel N. N. Silva1*, Mariana M. Virgolino2*, Bruna Z. Costa3, Maria Lair Sabóia3, Lucas G. Martins3 e Anita J. Marsaioli3.
Prof.ª Hercy Moraes. Av. Paulo Provenza Sobrinho, 1450 - JD Campos Elíseos, Campinas-SP , CEP 13060-356 *e-mail: [email protected]
2E.E. Prof.º José Vilagelin Neto. Rua Dom Luiz Antonio de Souza, 89 – JD. Proença, Campinas-SP, CEP13026-370 *e-mail: [email protected]
3 Instituto de Química – UNICAMP. Caixa Postal 6154 , Campinas – SP, CEP 13083-970
1E.E.
Palavras - Chave: cromatografia em camada delgada – reveladores – anisaldeído - vanilina.
INTRODUÇÃO
MATERIAL E MÉTODOS
A Cromatografia em Camada Delgada (CCD) é uma técnica cromatográfica
amplamente utilizada por ser um método rápido, simples e econômico. A CCD é
realizada em uma superfície revestida por uma camada de material adsorvente,
geralmente sílica (fase estacionária), onde é aplicada a amostra. Em seguida, um
solvente ou uma mistura de solventes (fase móvel) é elaborado na placa através da ação
capilar, promovendo a separação dos componentes da mistura devido as diferentes
afinidades dos mesmos pelas fases imiscíveis (Figura 1)
Tabela 1. Condições reacionais utilizadas para a obtenção dos compostos gerados a
partir da reação do fenol ou anilina com as soluções A ou B.
Reagente
Anilina
0,4 mL
(3,3
mmol)
Fenol
0,31 g
(3,3
mmol)
Figura 1. Esquema de uma cromatografia em camada delgada.
Comumente, após esse processo é necessária a utilização de soluções reveladoras
para visualização dos compostos, já que a maioria destes é incolor. Dentre as mais
utilizadas, estão as soluções ácidas alcoólicas de anisaldeído e vanilina.
Neste contexto, o objetivo deste projeto foi identificar os produtos coloridos formados
a partir da reação da anilina ou fenol com as soluções reveladoras de anisaldeído e
vanilina.
Revelador
Reação
O
Anisaldeído
0,29 mL
(3,3 mmol)
?
Silica, H2SO 4, CH3 CO 2H
+
Metanol, 150°C, 1h
O
NH 2
O
Anisaldeído
0,29 mL
(3,3 mmol)
?
Silica, H2SO 4, CH3 CO 2H
+
Metanol, 150°C, 20min
O
OH
O
Anilina
0,75 g
(5 mmol)
Extração com
metanol e análise
por CG-EM.
Vanilina
0,5 mL
(5 mmol)
?
Silica, H2SO4
O
+
OH
Etanol, 150°C, 1h
NH2
RESULTADOS E DISCUSSÃO
A Figura 2 apresenta os cromatogramas correspondentes as análises por CG-EM dos
extratos metanólicos das reações apresentadas na Tabela 1.
Produto I
A.
A’.
B.
B’.
Anisaldeído
Na Figura 3 são apresentados os espectros de massas dos produtos I, II e III
utilizados para identificação dos possíveis compostos coloridos formados nas reações em
estudo.
A.
B.
N
Produto III
C.
O
4-methoxibenzoato de f enila
Fórmula Molecular: C14H 12 O3
Massa Molecular: 228,24
N-(4-methoxibenzilideno)anilina
Fórmula Molecular: C14H 13 NO
Massa Molecular: 211,26
Fenol
Anisaldeído
O
O
Produto II
Anilina
O
C.
C’.
O
N
OH
Anilina
2-metoxi-4-((fenilimino)metil)fenol
Fórmula Molecular: C14H 13 NO 2
Massa Molecular: 227,26
Vanilina
Figura 3. Espectros de massas dos produtos A) I B) II C) III
Figura 2. Cromatogramas de CG-EM e extratos metanólicos das reações entre A e A’) Anilina e solução A; B e B’) Fenol
e solução A; C e C’) Anilina e solução B.
CONCLUSÕES
Os três produtos obtidos foram identificados e suas estruturas foram sugeridas a partir dos espectros de massas. É possível perceber que as mudanças nas estruturas e na
composição atômica das moléculas resultam em grandes diferenças nas colorações observadas.
Caracterização e Preservação de Bactérias Isoladas de
Rejeitos de Minas de Cobre
INTRODUÇÃO
RESULTADOS E DISCUSSÃO
A habilidade dos micro-organismos em colonizar uma ampla gama de ambientes,
caracterizados por condições extremas de pH, temperatura, concentração de sais,
oxigenação, disponibilidade de nutrientes, entre outras, tem sido amplamente estudada.1
Estes
organismos aprimoraram, ao longo do tempo, suas funções metabólicas e
R
biocatalíticas
de modo a se adequar e usufruir dos recursos existentes nestes ambientes.2
E
S Neste contexto, este trabalho visou caracterizar por coloração de Gram as bactérias
U
isoladas
de rejeitos aquosos do processo de mineração de cobre na Mina do Sossego
L
(Canaã
dos Carajás - PA) pertencente a mineradora Vale S.A. Além disso, foi realizada a
T
preservação
destes micro-organismos por criopreservação
A
D
O
S
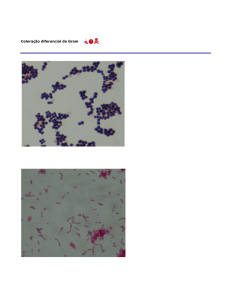
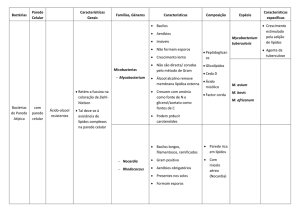
Coloração de Gram:
E
A)
B)
D
I
S
C
U
S
S
Ã
OFigura 4. Esquema da técnica de coloração de Gram. A ) Preparo do esfregaço e fixação; B) Etapas de coloração.
A coloração de Gram é baseada na composição da parede celular das bactérias
(Figura 6).
Gram (+)
Figura 6. Classificação das bactérias de acordo com a composição da parede celular em Gram (+) e Gram (-)..
A Figura 7 apresenta a classificação das bactérias oriundas das amostras de rejeitos
de mineração. É notável que a maioria das bactérias isoladas é Gram (+), independente
do meio de cultivo de origem.
120
Nº de bactérias
MATERIAL E MÉTODOS
Gram (-)
100
80
60
40
20
Preservação a temperatura ultra-baixas de bactérias:
0
Gram (+)
Gram (-)
NA
37
16
TSA
31
22
YMA
31
20
MEA
20
13
Total
119
71
Figura 7. Classificação das bactérias isoladas de rejeitos de mineração de cobre, de acordo com a composição da parede
celular (Gram+ ou Gram-) e do meio de cultivo.
As culturas microbianas são extremamente vulneráveis e passíveis de contaminação,
mutação ou perda de viabilidade. Por estes motivos,
todas as bactérias analisadas neste
C
trabalho foram preservadas por técnica de congelamento
à temperatura ultra-baixa. Esta
O
N
técnica diminui as velocidades das reações
metabólicas dos micro-organismos,
C
promovendo a integridade celular por longos períodos
de tempo.
L
Figura 5. Esquema da técnica de preservação a temperaturas ultra-baixas.
U
S
Õ
E
As amostras de rejeitos de mineração de cobre estudadas apresentaram-se como um nicho versátil para o isolamento de micro-organismos
heterotróficos. A caracterização por
S
coloração de Gram permitiu separar as bactérias isoladas em dois grupos distintos de acordo com a composição da parede celular.
CONCLUSÕES
AGRADECIMENTOS:
Referências Bibliográficas:
Degani, A.L.G.; Cass, Q.B.; Vieira, P.C. Quim. Nova na Escola. 1998, 5, 21-25.
Wagner, H.; Bladt, S. Plant Drug Analysis: A Thin-Layer Chromatography Atlas. 2nd ed.
Gadd, G.M. Microbiology, 2010, 156, 609.
Baker, B.J.; Banfield, J.F. FEMS Microbiol. Ecol., 2003, 44, 139.