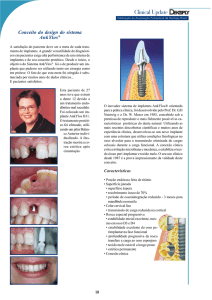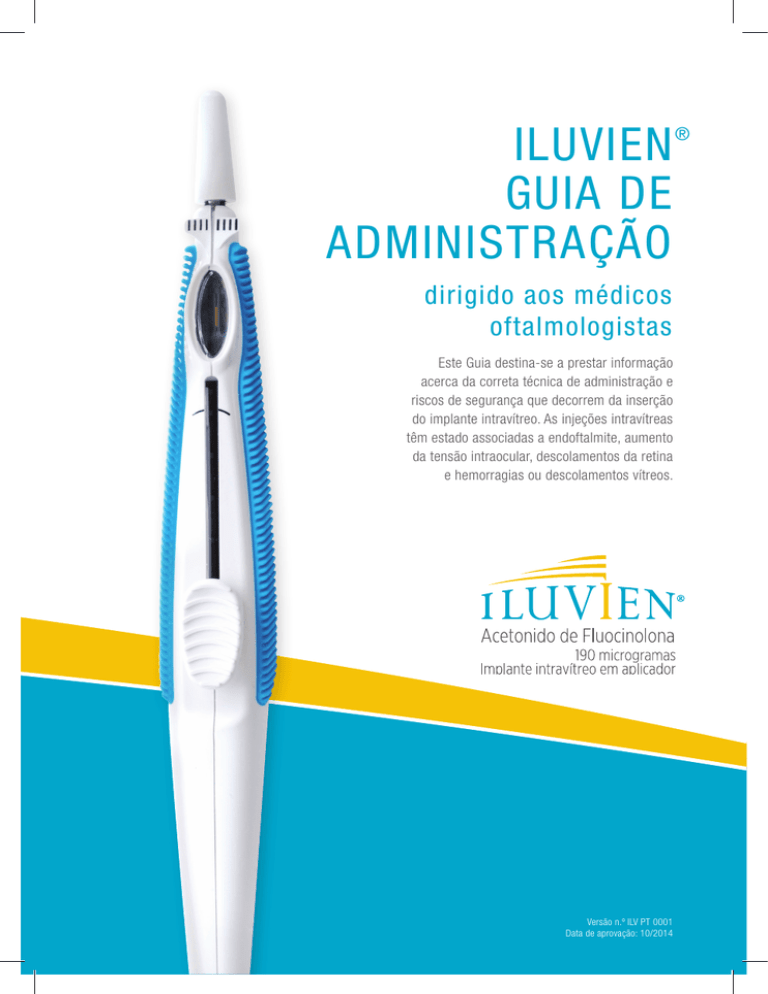
ILUVIEN
GUIA DE
ADMINISTRAÇÃO
dirigido aos médicos
oftalmologistas
Este Guia destina-se a prestar informação
acerca da correta técnica de administração e
riscos de segurança que decorrem da inserção
do implante intravítreo. As injeções intravítreas
têm estado associadas a endoftalmite, aumento
da tensão intraocular, descolamentos da retina
e hemorragias ou descolamentos vítreos.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
®
2
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
ILUVIEN® é um implante intravítreo com libertação prolongada de um corticosteroide diretamente
na cavidade vítrea durante até 36 meses.
Cada implante contém 190 microgramas
de acetonido de fluocinolona. O implante é um pequeno tubo que mede
aproximadamente 3,5 mm x 0,37 mm
e é administrado através de um aplicador
com uma agulha de 25 G.
INDICAÇÕES TERAPÊUTICAS
ILUVIEN® é indicado para o tratamento de problemas de visão associados ao Edema
Macular Diabético crónico, que não respondam suficientemente às terapêuticas
disponíveis.
CONTRAINDICAÇÕES
Um implante intravítreo com ILUVIEN® é contraindicado na presença de glaucoma
preexistente ou infeção periocular ou ocular, suspeita ou ativa, incluindo a maioria das doenças virais da córnea e da conjuntiva, incluindo queratite por herpes simplex epitelial ativo (queratite dendrítica), vaccinia, varicela, infeções micobacterianas e doenças fúngicas.
ILUVIEN® é contraindicado em doentes com hipersensibilidade à substância ativa ou a qualquer um destes excipientes: álcool polivinílico, tubo em poliimida e adesivo de silicone.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
3
POSOLOGIA
A dose recomendada é de um implante ILUVIEN® no olho afetado. Não é recomendada a administração concomitante nos dois olhos.
Um implante adicional pode ser administrado passados 12 meses, se o doente sentir
uma redução da visão ou um aumento na espessura da retina associados à recidiva
ou agravamento do Edema Macular Diabético.
Não se deve proceder a reimplantações, a não ser que os potenciais benefícios
justifiquem os possíveis riscos.
Só os doentes que tiveram uma resposta insuficiente ao tratamento anterior com
fotocoagulação a laser ou outras terapêuticas disponíveis para o Edema Macular
Diabético é que devem ser tratados com ILUVIEN®.
4
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
EFEITOS INDESEJÁVEIS
Nos estudos de Fase 3, 38,4% dos indivíduos tratados com ILUVIEN® necessitaram de
medicação para baixar a pressão intraocular (PIO) e 4,8% tiveram de ser operados para
baixar a PIO. A utilização de medicação para baixar a PIO foi similar nos indivíduos que
receberam dois ou mais tratamentos com ILUVIEN®.
A incidência de cataratas em indivíduos fáquicos foi aproximadamente 82% nos
indivíduos tratados com ILUVIEN® e de 50% nos indivíduos tratados do grupo de
controlo nos ensaios clínicos de Fase 3. 80% dos indivíduos fáquicos tratados com
ILUVIEN® tiveram de ser operados às cataratas no Ano 3.
Os seguintes efeitos indesejáveis foram avaliados como relacionados com o tratamento
e estão classificados de acordo com a seguinte convenção:
n
n
n
uito frequentes (≥ 1/10): operação às cataratas, cataratas, aumento da pressão
M
intraocular, moscas volantes (miodesopsia);
F requentes (≥ 1/100, < 1/10): glaucoma, trabeculectomia, dor ocular, hemorragia
no vítreo, hemorragia da conjuntiva, visão turva, intervenção cirúrgica de glaucoma,
acuidade visual diminuída, vitrectomia, trabeculoplastia;
P ouco frequentes (≥ 1/1.000, < 1/100): endoftalmite, cefaleia, oclusão vascular
da retina, anomalia do nervo ótico, maculopatia, atrofia do nervo ótico, úlcera
conjuntival, neovascularização da íris, exsudados retinianos, degenerescência do
vítreo, descolamento do vítreo, opacificação da cápsula posterior, aderências da íris,
hiperemia ocular, adelgaçamento escleral, remoção do implante expulso da esclera,
corrimento ocular, prurido do olho, expulsão do implante, implante na linha de visão,
complicações na intervenção, dor relacionada com a intervenção.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
5
PREPARAÇÃO DO DOENTE PARA
A INTRODUÇÃO DO IMPLANTE INTRAVÍTREO ILUVIEN®
O tratamento com ILUVIEN visa apenas o uso intravítreo e deve ser administrado por um
oftalmologista com experiência na aplicação de injeções intravítreas. A introdução do
implante intravítreo deve ser realizada em condições asséticas controladas, o que inclui
a utilização de luvas esterilizadas, um campo estéril e um espéculo palpebral esterilizado
(ou equivalente). Deve ser administrada uma anestesia adequada e um microbicida de
largo espetro antes da implantação.
6
01
Pode ser administrado
um antibiótico pré-operatório
em gotas de acordo
com as indicações
do oftalmologista responsável.
02
Mesmo antes da intervenção, administre
anestesia tópica no local da implantação
(é recomendada a aplicação no
quadrante inferotemporal) sob a
forma de uma gota, quer através de um cotonete embebido num agente
anestésico, quer da administração
subconjuntival da anestesia adequada.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
03
Administre topicamente 2-3 gotas de um antissético tópico adequado
no fórnix inferior. As pálpebras podem
ser limpas com cotonetes embebidos
num antissético tópico adequado.
Coloque um espéculo palpebral
esterilizado. Peça ao doente para
olhar para cima e desinfete o local
da implantação com um cotonete
embebido num antissético tópico
adequado.
Deixe secar o antissético tópico
durante 30-60 segundos antes
da implantação de ILUVIEN®.
PREPARAÇÃO DO APLICADOR ILUVIEN®
04
O exterior do tabuleiro não deve ser
considerado estéril. Um assistente
(não esterilizado) deve retirar o tabuleiro
da caixa e remover a tampa do tabuleiro
sem tocar na superfície interior. Verifique
através da janela do sistema do aplicador
para ter a certeza de que existe um
implante no interior.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
7
05
Retire o aplicador do tabuleiro com as
mãos protegidas por luvas esterilizadas
tocando apenas na superfície
esterilizada e no aplicador.
Recomenda-se manter a tampa de
proteção do aplicador até que esteja
pronto para administrar ILUVIEN®.
Antes da injeção, manter a ponta
do aplicador acima do plano horizontal
para assegurar que o implante está em
posição.
06
8
Para retirar o volume de ar
administrado com o implante,
a implantação deve ser um processo
com dois passos.
Antes de introduzir a agulha
no olho, pressione o botão para baixo
até à primeira paragem
(as marcas curvas a preto).
Depois da primeira paragem,
solte o botão que voltará à posição
PARA CIMA. Se o botão não voltar
à posição para cima, não prossiga.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
PROCEDIMENTO DE INSERÇÃO DE ILUVIEN®
07
O local de implantação ideal
é inferior ao disco ótico e posterior ao equador. Este posicionamento pode
ser conseguido ao direcionar a agulha
para a zona inferior do disco ótico. Meça 4 milímetros inferotemporalmente
desde o limbo, com a ajuda de um
compasso de calibre.
08
Mantendo a ponta do aplicador
acima do plano horizontal, remover
cuidadosamente a tampa de proteção
da agulha e inspecionar a ponta para
assegurar que está apta para
a injeção.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
9
09
10
10
Afaste delicadamente a conjuntiva
para que, depois da retirada da
agulha, os locais de entrada na
conjuntiva e na esclera não fiquem
alinhados. Deve ter-se cuidado para evitar o contacto entre a agulha
e a margem da pálpebra ou pestanas.
Introduza a agulha no olho. Para libertar o implante, enquanto o botão está para cima, pressione o botão até ao fim e remova a agulha.
Nota: assegurar que o botão vai até ao fim e que para, antes de se remover a agulha.
Retire o espéculo palpebral e realize
uma oftalmoscopia indireta para
verificar o posicionamento
do implante, a perfusão adequada
da artéria retinal central
e a ausência de quaisquer outras
complicações.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
Nota: assegurar que o botão
vai até ao fim e que para,
antes de se remover a agulha.
CUIDADOS A TER APÓS A INSERÇÃO DE ILUVIEN®
Após a implantação intravítrea, deve ser feita uma observação através da técnica
de oftalmoscopia indireta no quadrante do implante com vista a confirmar a correta
colocação. A depressão escleral pode melhorar a visualização do implante. A observação
deve incluir uma verificação da perfusão da cabeça do nervo ótico imediatamente após
a implantação. A medição imediata da pressão intraocular (PIO) pode ser feita de acordo
com as indicações do oftalmologista.
Após a implantação, os doentes devem ser vigiados devido a potenciais complicações,
como endoftalmite, aumento da tensão intraocular, descolamento da retina e hemorragias ou descolamentos vítreos. A biomicroscopia com tonometria deve ser feita entre o segundo e o sétimo dia após a implantação.
Seguidamente, recomenda-se que os doentes sejam monitorizados pelo menos
trimestralmente para descartar potenciais complicações devidas à prolongada libertação
do acetonido de fluocinolona que dura cerca de 36 meses.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
11
ADVERTÊNCIAS E PRECAUÇÕES ESPECIAIS DE UTILIZAÇÃO
As injeções intravítreas têm estado associadas a endoftalmite, aumento da tensão
intraocular, descolamentos da retina e hemorragias ou descolamentos vítreos.
Os doentes devem ser instruídos para notificar de imediato quaisquer sintomas
sugestivos de endoftalmite.
A monitorização dos doentes no segundo ao sétimo dia após a injeção pode permitir a identificação e tratamento atempado de infeção ocular, aumento da tensão intraocular
ou qualquer outra complicação. É recomendado que a tensão intraocular seja vigiada,
pelo menos trimestralmente após a implantação.
A utilização de corticosteroides intravítreos pode causar cataratas, tensão intraocular
elevada, glaucoma e até aumentar o risco de infeções secundárias.
A segurança e a eficácia de ILUVIEN® administrado concomitantemente nos dois olhos
não foram estudadas. O tratamento concomitante dos dois olhos não é recomendado
enquanto não se conhecer a resposta ocular e sistémica do doente ao primeiro implante.
Em caso de subidas da pressão intraocular que não respondam à medicação ou procedimentos para baixar a PIO, o implante ILUVIEN® pode ser retirado através de uma vitrectomia.
12
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
CONTROLO DE REAÇÕES ADVERSAS IDENTIFICADAS APÓS A INSERÇÃO
O estudo FAME fornece informação sobre efeitos adversos recolhidos durante os ensaios
clínicos piloto. Não é objetivo do presente Guia dar orientações sobre o controlo de
efeitos adversos. A avaliação e controlo de quaisquer efeitos adversos deve ser feita numa base individual por um oftalmologista qualificado.
A utilização de corticosteroides a longo prazo pode causar cataratas e aumentar a pressão intraocular.
Cataratas: a maioria dos doentes que desenvolveram cataratas durante os estudos FAME
foram submetidos a cirurgia às cataratas.
Pressão intraocular: a maioria dos doentes nos estudos FAME que sofreram de aumento da pressão intraocular foram tratados de forma eficaz com medicação.
Menos de 5% tiveram de ser operados para baixar a pressão intraocular. Em caso de subidas da PIO que não respondam à medicação ou procedimentos para baixar a PIO,
o implante ILUVIEN® pode ser retirado através de uma vitrectomia.
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
13
OS EFEITOS INDESEJÁVEIS DEVEM SER NOTIFICADOS
Os formulários de notificação estão disponíveis em:
http://www.infarmed.pt/portal/page/portal/INFARMED/MEDICAMENTOS_USO_HUMANO/
FARMACOVIGILANCIA/NOTIFICACAO_DE_RAM.
Os efeitos indesejáveis devem também ser notificados à Alimera Sciences Limited
([email protected]).
14
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
Versão n.º ILV PT 0001
Data de aprovação: 10/2014
15
PORTUGAL
ALIMSCI Portugal, Lda.
Av. D. João II, Lote 1.06.2.5B
Edifício Mar Vermelho
1990-095 Lisboa
Portugal
Escritório: +351 211 212 177
Fax: +351 211 212 100
e-mail: [email protected]
Versão n.º ILV PT 0001
Data de aprovação: 10/2014