Isomeria e Quiralidade de Complexos
Prof. Fernando R. Xavier
UDESC 2015
Histórico
Durante o século 19, Werner estudando compostos de
cobalto(III) com amônia e íons cloreto foi capaz de isolar 4
espécies com cores distintas.
?
Para os dois últimos casos, um fato intrigante foi observado: Dois compostos com
propriedades fisico-químicas distintas apresentavam exatamente a mesma
composição química.
2
Fato:
A fómula molecular de um composto de coordenação não fornece informações
definitivas sobre o arranjo espacial dos ligantes entorno de um centro metálico.
Exemplo:
Montar
a
fórmula
estrutural
do
cátion
complexo
tetraaminobisclorocobalto(III) – Um complexo clássico de Werner.
[Co(NH3)4Cl2]+
Dois compostos podem ser obtidos partindo-se deste nome!!!
3
Definição:
Com base na situação anterior, é dito que os complexos de Werner com fórmula
[Co(NH3)4Cl2]+ são isômeros entre si. Logo, o fenômeno de isomeria pode estar
presente quando uma dada fórmula química pode apresentar mais de um arranjo
estrutural (plano ou
espacial), gerando por consequência compostos com
propriedades distintas.
Os tipos de isomeria mais comuns observados em compostos de coordenação são
os seguintes:
de ligação;
de coordenação
de ionização
geométrica
de hidratação
ótica
4
Resumo:
Isômeros
(mesma fórmula, diferentes propriedades)
Estruturais
Espaciais
(ligações diferentes)
(mesmas ligações, arranjos diferentes)
De esfera de
coordenação
De ligação
Geométricos
Óticos
5
Isomeria de Ligação: Ocorre quando ligantes ambidentados estão presentes no
composto de coordenação.
Exemplo: [Co(NH3)5(NO2)]2+
Δ , NH3(aq)
Nitrito κ-O (vermelho)
Nitrito κ-N (amarelo)
6
Isomeria de Ionização: Ocorre quando ligantes e contraíons presentes em um
composto de coordenação trocam de posição.
Exemplo 1: [Pt(NH3)4Cl2]Br2 e [Pt(NH3)4Br2]Cl2
Exemplo 2: [Cr(NH3)5(SO4)]Br e [Cr(NH3)5Br]SO4
7
Isomeria de Hidratação: Ocorre quando um ou mais ligantes aquo são
substituídos pelos contraíons.
Exemplo: [Cr(OH2)6]Cl3; [Cr(OH2)5Cl]Cl2 . H2O e [Cr(OH2)4Cl2]Cl . 2H2O
Violeta
Verde-claro
Verde-escuro
8
Isomeria de Coordenação: Ocorre quando diferentes compostos de coordenação
podem ser gerados partindo-se da mesma fómula molecular.
Exemplo: [Co(NH3)6][Cr(CN)6] e [Cr(NH3)6][Co(CN)6]
9
Isomeria Geométrica (N.C. 4):
Considerando os compostos tetracoordenados de platina(II) com ligantes Cl- e NH3
sintetizados por Werner, geometricamente temos duas possibilidades de arranjo
espacial: Tetraédrico ou quadrado planar.
Werner isolou dois complexos de cor amarela, não eletrólitos, de fórmula
[Pt(NH3)2Cl2], concluindo que se tratavam de espécies quadrado-planares.
Para compostos do tipo [MA2B2]
apenas isomeria cis/trans é
observada.
cis-[Pt(NH3)2Cl2]
C2v
trans-[Pt(NH3)2Cl2]
D2h
10
Isomeria Geométrica (N.C. 4):
Com três diferentes tipos de ligantes em um mesmo complexo [MA2BC], a
localização entre os ligantes do tipo A permitem a localização das espécies cis e
trans.
Exemplo: [Pt(NH3)Cl2(PR3)]
cis-[Pt(NH3)Cl2(PR3)]
cis-[MA2BC]
trans-[Pt(NH3)Cl2(PR3)]
trans-[MA2BC]
11
Isomeria Geométrica (N.C. 4):
Com os 4 ligantes diferentes entre si em um mesmo complexo ([MABCD]), a
geometria cis/trans é especificada com maiores informações sobre cada espécie.
A-trans-C-[MABCD]
A-trans-B-[MABCD]
A-trans-D-[MABCD]
Exemplo: [Pt(NH3)BrCl(PR3)]
Br-trans-NH3-[Pt(NH3)BrCl(PR3)]
Br-trans-Cl-[Pt(NH3)BrCl(PR3)]
Br-trans-PR3-[Pt(NH3)BrCl(PR3)]
12
Isomeria Geométrica (N.C. 6):
Em complexos octaédricos, sistemas do tipo [MA6] ou [MA5B] apresentam apenas
um arranjo geométrico possível logo, não são encontrados isômeros.
Entretanto, complexos do tipo [MA4B2] apresentam isomeria cis/trans.
Exemplo: [CoCl2(en)2]
cis-[MA4B2]
C2v
trans-[MA4B2]
D4h
cis-[CoCl2(en)2]
trans-[CoCl2(en)2]
13
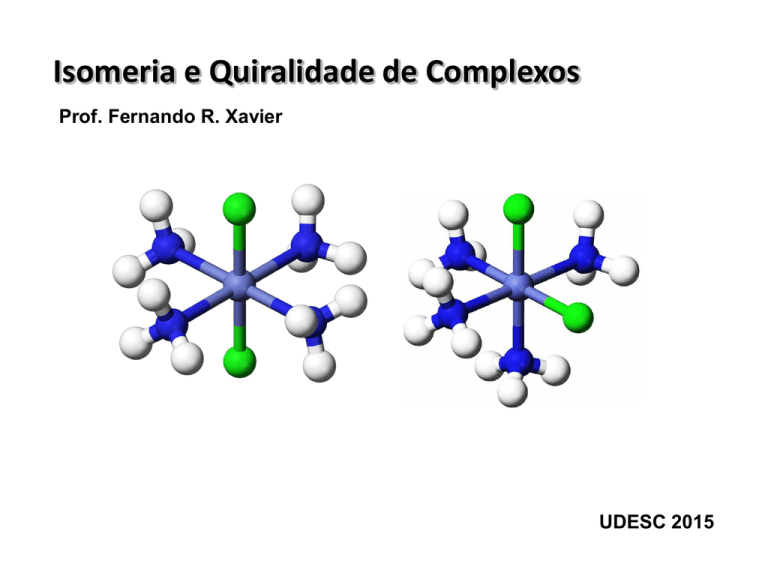
Isomeria Geométrica (N.C. 6):
Representação espacial dos complexos cis e trans-[Co(NH3)4Cl2]+.
14
Isomeria Geométrica (N.C. 6):
Em complexos octaédricos, sistemas do tipo [MA3B3] apresentam duas
possibilidades: ou os ligantes ficam coordenados de forma perpendicular
(coordenação meridional) ou ocupam uma face do octaedro (coordenação
facial).
Exemplo: [Co(NH3)3Cl3]
mer-[MA3B3]
C2v
mer-[Co(NH3)3Cl3]
fac-[MA3B3]
C3v
fac-[Co(NH3)3Cl3]
15
Isomeria Geométrica (N.C. 6):
Em complexos octaédricos, sistemas do tipo [MA2B2C2] apresentam uma série de
isômeros geométricos.
trans-[MA2B2C2]
trans-B-[MA2B2C2]
trans-A-[MA2B2C2]
trans-C-[MA2B2C2]
16
Isomeria Geométrica (N.C. 6):
Em complexos octaédricos, sistemas do tipo [MA2B2CD] ou [MA3B2C] resultam
em várias possibilidades de isomeria geométrica.
fac-[Rh(C≡CR)2(H)(PMe3)3]
mer-cis[Rh(C≡CR)2(H)(PMe3)3]
mer-trans[Rh(C≡CR)2(H)(PMe3)3]
17
Isomeria Ótica
Moléculas
que
possuem
imagens
especulares não-sobreponíveis são ditas
quirais e, estas imagens especulares são
classificadas
como
isômeros
óticos
ou
opticamente ativos.
Mas como saber se uma molécula é
óticamente
ativa?
Um
equipamento
relativamente simples pode revelar tal
fato: O polarímetro.
18
Isomeria Ótica (N.C. 4)
Assim como em química orgânica, onde um carbono é considerado quiral
quando seus quatro substituintes são diferentes, um composto de coodenação
tetraédrico (N.C. 4) também é quiral se os quatros ligantes de sua esfera de
coordenação
forem
diferentes
sendo
suas
imagens
especulares
não-
sobreponíveis.
Exemplo: [Cu(L)2]
19
Isomeria Ótica (N.C. 6)
Como visto anteriormente, muitas são as possibilidades de se encontrar isômeros
geométricos em compostos octaédricos. Aliado a isto, dentro de alguns destes
casos além de isômeros geométricos, isômeros óticos podem ser encontrados.
[Mn(acac)3]
cis-[MA2B2C2]
cis-[CoCl2(en)2]
20
Isomeria Ótica (N.C. 6)
Para complexos octaédricos quirais, é comum a descrição da configuração
absoluta da molécula em questão. Tal característica é observada quando através
de um eixo de rotação imaginário a molécula assume uma forma helicoidal.
Quando o aspecto desta “hélice” gira no sentido horário temos uma configuração
absoluta do tipo delta (Δ). Se o sentido de torção for anti-horário a configuração
absoluta é dita lambda (Λ).
N
N
N
N
N
N
N
N
N
N
N
Λ-[Co(en)3
]3+
Δ-[Co(en)3]3+
N
21