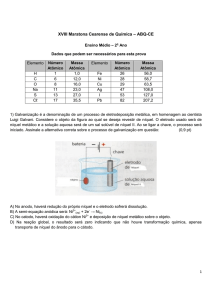
CONTEÚDO PARA EXAME DE QUÍMICA
2º ANO – Ensino Médio (Matutino)
Concentração de soluções. Capítulo 1
Processos de óxido-redução. Capítulo 3
Termoquímica. Capítulo 6
Cinética química. Capítulo 7
Exercícios exame 2ª. Ano
1-São dissolvidos 8g de sacarose em água suficiente para 500 cm3 de solução. Qual é a concentração comum dessa
solução em g/cm3 e g/L?
2- Determine a massa de NaOH (hidróxido de sódio) dissolvido em água suficiente para 0,6L de solução, cuja
concentração comum é 0,7 g/cm3?
3- Uma solução contém 5 mols de moléculas de soluto dissolvidas em 20 mols de moléculas do solvente.
Determine as frações molares do soluto e do solvente.
4- São dissolvidos 19,6g de (H2SO4) ácido sulfúrico em água suficiente para 800 cm3 de solução. Qual é a
molaridade dessa solução em mol/L?
5-Temos 800 cm3 de uma solução 0,45 mol/L de (NaOH) hidróxido de sódio. Determine a massa de NaOH nessa
solução e a concentração comum.
6- A concentração comum de uma solução é de 0,24g/cm3. Qual é a quantidade de soluto necessária para
prepararmos 0,05L dessa solução?
7- Em 356,4 g de água são dissolvidos 68,4g de sacarose (C12 H22 O11). Determine as frações molares da sacarose e
da água. Dados
8- Qual a concentração molar ou molaridade de uma solução que num volume de 600 cm3, contém 0,15 ml de
moléculas de soluto?
9- Calcule a molaridade de uma solução aquosa de cloridreto que, num volume de 1500 ml contém 21,9 g de H Cl (
ácido clorídrico).
10- Determine a massa de H3 P O4 (ácido fosfórico) que deve ser dissolvido em água para obter 2400 cm3 de
solução 1,0 mol/L.
11- Uma solução contém 29,4 g de H2 S O4 (ácido sulfúrico) dissolvidos numa certa massa de H2 O. Calcule a
massa da água dessa solução, sabendo que a fração molar do soluto é de 0,1 .
12- Determine a porcentagem em massa do soluto de uma solução que contém 75 g de nitrato de prata ( Ag N O 3 )
dissolvidos em 425 g de água.
13- Balanceie as equações abaixo pelo método de óxido-redução.
01- ZnO + C → Zn + CO
1 1 1 1
02- Fe3O2 + CO → Fe + CO2
03- Fe2O3 + CO → CO2 + Fe
1
3
3
3
1 3 3 2
04- K2Cr2O7 + H2O + S → SO2 + KOH + Cr2O3
2
05- K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O
2
1
3 4 2
14
2
2
3
7
14- (Cesgranrio-RJ adaptado) Tratando-se o fósforo branco (P4) com solução aquosa de ácido nítrico,
obtêm-se o ácido fosfórico (H3PO4) e monóxido de nitrogênio (NO), segundo a equação química nãobalanceada:
P4 + HNO3 + H2O → H3PO4 + NO
3 20 8
12 20
Qual a soma dos coeficientes dos reagentes dessa reação balanceada? R:31
15- (Puccamp-SP) Os filtros contendo carvão ativo, procuram eliminar o excesso de cloro na água tratada.
Pode ocorrer a reação:
Cl2 + C + H2O → CO2 + H+ + Cl ─. Balanceando-se a equação com os menores números inteiros
possíveis, qual a soma dos coeficientes do primeiro membro da reação? R: 5
2 1 2 1 4 4
16- (Mack-SP) Qual a soma dos menores coeficientes inteiros do balanceamento da equação a seguir,
pelo método redox:
R:15
K2Cr2O7 + HCl → K2O + Cr2O3 + H2O + Cl2
1 6 1 1 3 3
17- O gás carbônico presente em extintores de incêndio não pode ser usado para apagar o fogo
provocado por sódio metálico porque o gás carbônico reage com o metal aquecido, formando carbonato
de sódio e carbono elementar. Formule a equação que representa a reação descrita, balanceando-a pelo
método de oxirredução.
R: 4Na + 3CO2 → 2Na2CO3 + 1 C
18- (UERJ) A equação Au+3 + Ag → Ag+ + Au representa uma reação possível pelo contato, em
presença de saliva, de uma obturação de outro e outra de prata. Nessa equação, após ajustada, qual a soma
de todos os coeficientes (reagentes e produtos)?
R: 8
19- Dadas as equações, informe quais são endotérmicas e quais são exotérmicas: (CNTP)
a) Fe(S) + ½ O2(g) → FeO(s) ∆H= ─ 64,04 Kcal
b) H2O(l) → H2(g) + ½ O2(g)
∆H= + 68,3 Kcal
c) 2 C(graf) + 3 H2(g) → C2H6(s) ∆H= ─ 20,5 Kcal
d) CO2(g) → C(graf) + O2(g)
∆H= + 94,14 Kcal
e) Ca(S) + C(graf) + 3/2 O2(g) → CaCO3(s) + 288 Kcal
f) CaO(S) + 151,9 Kcal
→ Ca(s) + ½ O2(g)
g) 6 CO2(g) + 6 H2O(l) + calor → C6H12O6(aq) + 6 O2 (g)
Exercícios do livro páginas ?????
20 screva como se lê as equações (a, c, d, g) do exercício 2.
20- A partir das informações, monte as equações químicas.
a) um mol de enxofre líquido reage com um mol de oxigênio gasoso, produzindo um mol de dióxido
de enxofre gasoso liberando 71 Kcal nas (CNTP).
b) Um mol de carbono grafite reage com meio mol de oxigênio gasoso produzindo um mol de
monóxido de carbono gasoso. A variação de entalpia é de 26,5 Kcal e o processo é exotérmico.
22- Coloque as energias absorvidas ou liberadas dentro da equação reescrevendo-as. (CNTP).
a) H2O(l) → H2(g) + ½ O2(g) ∆H= ─ 64,04 Kcal
b) 2 C(graf) + 3 H2(g) → C2H6(s) ∆H= + 68,3 Kcal
c) Fe(S) + ½ O2(g) → FeO(s) ∆H= ─ 20,5 Kcal
III-
23- (UNIP-SP)-Das reações abaixo, quais são de oxirredução? Só saberá a resposta se resolver.
I2 → 2 I
LiCl +
III- 2 Na +
AgNO3 →
1⁄2 O2 →
a) I, II e III
b) III, somente.
AgCl +
LiNO3
Na 2O
c) I e II, somente.
e) II e III, somente.
d) nenhuma delas é de oxidação.
24- (FUVEST-SP)-Considere as seguintes reações químicas:
I- SO2 + H2O2 → H2SO4
II- SO2 + H2O → H2SO3
III-K2Cr2O7 +
HBr →
KBr + CrBr3 + Br2 + H2O
Pode-se classificar como reação de oxirredução, apenas:
a) I
b) II
c) III
d) I e III
25- A respeito da equação, coloque verdadeiro (V) ou falso (F).
MnO2 + HCl → MnCl2 + H2O + Cl2
e ) II e III
a) O HCl é o agente oxidante.
b) MnO2è o agente redutor.
c) Mn4+ sofre oxidação.
d) MnO2 è o agente oxidante
e) HCl é o agente redutor
f) Cl – sofre redução.
26- Informe os números de oxidação somente dos elementos sublinhados:
a) BaCl2 b) H3PO4
c) CaCO3
d) Pb 2+
e) SO4 2 –
27- (UNIP-SP)- A soma dos coeficientes menores e inteiros para a reação abaixo é: Será necessário fazer o
balanceamento.
KMnO4 + HBr → KBr + MnBr2 + H2O + Br2
a) 32
b) 33
c) 35
d) 36
28- Dadas as equações termoquímicas:
C (Graf.)→ C (diam.)
∆H =
I) C (Graf.) + O2 (g)→ CO2 (g)
∆H = - 94,10 kcal
II) C (diam.) + O2 (g)→ CO2 (g)
∆H = - 94,55 kcal
A variação de entalpia será:
a) - 188,65 kcal
b) + 0,45 kcal
c) + 188,65 kcal
e) 38
d) – 0,45 kcal
e) – 94,32 kcal
29- Quando uma nave espacial retorna á terra, ao reentrar na atmosfera, provoca as
seguintes reações químicas dos componentes do ar:
30- 940,5kJ + N2 (g) → 2 N (g)
31- 506,6 kJ + O2 (g) → 2 O (g)
∆H = + 167,2 kcal
32- N2(g) + O2 (g) → 2 NO (g)
Quanto ao calor envolvido nessas reações, pode-se afirmar que:
a) I, II e III são exotérmicas
d) apenas I e II são endotérmicas.
b) Apenas III é endotérmica
e) apenas I e II são exotérmicas.
c) I, II e III são endotérmicas
30- Nas pizzarias há cartazes dizendo”forno a lenha”. A reação que ocorre neste forno
para assar a pizza é:
a) explosiva.
b) catalisada.
c) endotérmica.
d) hidroscópica.
e) exotérnica.
31- O que diz a lei de Hess?
32- Explique reação endotérmica e exotérmica e dê um exemplo de cada.
33- Observe as equações termoquímicas:
I) C (s) + H2O (g) → CO (g) + H2 (g)
∆H = + 31,4 kcal
II) CO (g) + ½ O2 (g) → CO2 (g)
∆H = - 67,6 kcal
III) H2 (g) + ½ O2 (g) → H2O(g)
∆H = - 57,8 kcal
De acordo com o ∆H ( variação de entalpia), podemos afirmar que:
a) II é endotérmica, I e III exotérmica.
d) I e II são endotérmicas, III exotérmica.
b) I e II são endotérmicas, II exotérmica.
e) I é endotérmica, II e III exotérmicas.
c) II e III são endotérmicas, I exotérmica.
34- A partir dos valores de ∆H determine a variação de entalpia do processo:
C6H6O2 (aq.) + H2O2 (aq.) → C6H4O2 (aq.) + 2 H2O (l)
∆H = ?
I)
II)
III)
C6H6O2 (aq.) → C6H4O2 (aq.) + H2 (g)
H2O2 (aq.) → H2O (l) + ½ O2 (g)
H2 (g) + ½ O2 (g) → H2O (l)
∆H = + 177 kJ.mol-1
∆H = - 95 kJ.mol-1
∆H = - 286 kJ.mol-1
35- Defina cinética química.
36- Quais fatores influenciam a velocidade de uma reação?
37- Dê a lei cinética da equação:
2 NH3 → N2 + 3 H2
38- Calcule a velocidade média em relação a reação química A+B→AB:
a) nos intervalos de 3 à 9 s
b) nos intervalos de 3 à 12s
Tempo (segundo) Massa (grama) AB formados
0
0
3
30
6
85
9
130
12
210
39- Analise os gráficos A e B e responda as questões.
Para o gráfico A
a) Qual é a equação da reação química envolvida?
b) Quantas e quais são as moléculas que colidem nessa reação elementar?
c) Como se chama a reação representada por E2?
d) A que corresponde o trecho marcado com a letra b?
e) A que corresponde o trecho marcado com a letra c?
f) A reação em questão é exotérmica ou endotérmica?
Para o gráfico B
a)
Qual é a equação da reação química envolvida?
b) Quantas e quais são as moléculas que colidem nessa reação elementar?
c) Como se chama a reação representada por E2?
d) A que corresponde o trecho marcado com a letra b?
e) A que corresponde o trecho marcado com a letra c?
f) A reação em questão é exotérmica ou endotérmica?