XVIII Maratona Cearense de Química – ABQ-CE
Ensino Médio – 2o Ano
Dados que podem ser necessários para esta prova
Elemento
H
C
O
Na
S
Cℓ
Número
Atômico
1
6
8
11
13
17
Massa
Atômica
1,0
12,0
16,0
23,0
27,0
35,5
Elemento
Fe
Ni
Cu
Ag
I
Pb
Número
Atômico
26
28
29
47
53
82
Massa
Atômica
56,0
58,7
63,5
108,0
127,0
207,2
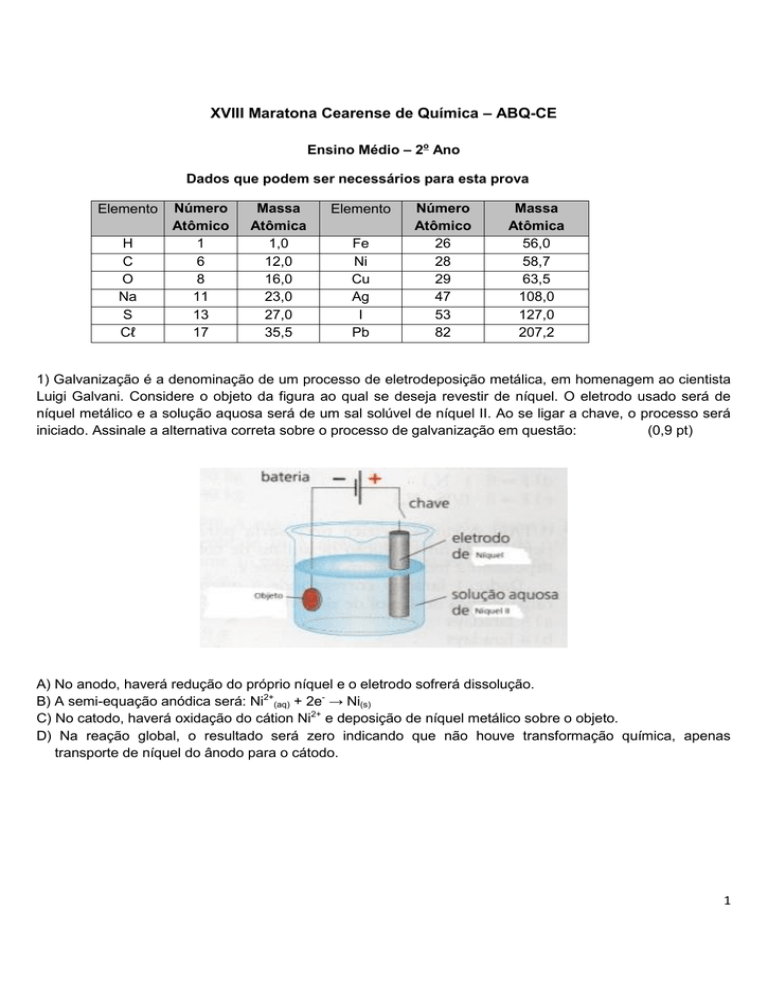
1) Galvanização é a denominação de um processo de eletrodeposição metálica, em homenagem ao cientista
Luigi Galvani. Considere o objeto da figura ao qual se deseja revestir de níquel. O eletrodo usado será de
níquel metálico e a solução aquosa será de um sal solúvel de níquel II. Ao se ligar a chave, o processo será
iniciado. Assinale a alternativa correta sobre o processo de galvanização em questão:
(0,9 pt)
A) No anodo, haverá redução do próprio níquel e o eletrodo sofrerá dissolução.
B) A semi-equação anódica será: Ni2+(aq) + 2e- → Ni(s)
C) No catodo, haverá oxidação do cátion Ni2+ e deposição de níquel metálico sobre o objeto.
D) Na reação global, o resultado será zero indicando que não houve transformação química, apenas
transporte de níquel do ânodo para o cátodo.
1
2) Diagrama de Hommel ou diamante do perigo é utilizado pela Associação Nacional para Proteção contra
Incêndios para expressar o risco do produto químico nele contido. Uma substância encontrada no laboratório
possui os seguintes dados: Riscos à saúde = 0 (material normal); Inflamabilidade = 0 (não queima);
Reatividade = 0 (estável); Riscos específicos = W (-------). Quanto ao símbolo W assinale a alternativa
correta:
(0,9 pt)
A) não misture com ácido.
B) material corrosivo.
C) não misture com álcali.
D) não misture com água.
3) Um estudante resolveu fazer a experiência semelhante à Árvore de Saturno, fig.1, usando fios de cobre
mergulhados em uma solução de nitrato de prata. Pela tabela de Potencial-padrão de eletrodo (em volts-1atm
e 25°):
(0,7 pt)
Fig. 1
Ag(s) → Ag+(aq) + 1e – ;
Eo = - 0,80V
Cu(s) → Cu2+(aq) + 2e – ;
Eo = - 0,34V
Com base nestes dados, assinale a alternativa correta sobre o experimento:
A) O íon cobre forçará a oxidação do metal prata produzindo a árvore.
B) O íon prata sofrerá redução gerando uma estrutura metálica semelhante a uma árvore.
C) O potencial-padrão de cada metal indica que a reação não ocorrerá espontaneamente.
D) O íon cobre sofrerá redução gerando a estrutura da árvore.
2
4) Bico de Bunsen é um equipamento ligado ao gás, que serve para o aquecimento de materiais não
inflamáveis. Analisando a figura a seguir, assinale a alternativa correta.
(0,9 pt)
A) I = zona oxidante; II = zona redutora; III = zona neutra; IV = registro de gás; V = entrada de ar; VI = base.
B) I = zona redutora; II = zona oxidante; III = zona neutra; IV = registro de gás; V = entrada de ar; VI = base.
C) I = zona neutra; II = zona redutora; III = zona oxidante; IV = registro de gás; V = entrada de ar; VI = base.
D) I = zona oxidante; II = zona redutora; III = zona neutra; IV = entrada de ar; V = registro de gás; VI = base.
5) Titulação é um método usado para determinação da concentração de soluções por meio de reação química
com uma solução de concentração conhecida. As etapas são:
Etapa 1: A solução de concentração conhecida é colocada no erlenmeyer e seu volume é medido
cuidadosamente.
Etapa 2: A solução de concentração desconhecida que irá reagir quimicamente com a solução do erlenmeyer
é colocada na bureta graduada.
Etapa 3: Adiciona-se à solução do erlenmeyer um indicador, que é a substância capaz de produzir um sinal
físico do término da reação.
Etapa 4: Deixa-se gotejar a solução da bureta sobre o erlenmeyer em constante agitação, até o ponto de
viragem.
Etapa 5: Anota-se cuidadosamente o volume gasto da solução da bureta para ser usado no cálculo da
concentração.
Assinale a alternativa correta sobre as etapas 1 a 5 do procedimento de titulação:
A) Todas as etapas estão corretas.
B) As etapas 1 e 2 estão erradas.
(0,7 pt)
C) Somente a etapa 1 está errada.
D) A etapa 3 está errada.
6) Assinale a alternativa que contém erro de conteúdo sobre o dióxido de carbono, segundo texto de Pohling,
2009, em Reações Químicas na Análise de Água:
(0,7 pt)
A) “O gás carbônico entra na água por absorção e dissolução”.
B) “À noite, as plantas aquáticas consomem oxigênio para a sua respiração e liberam gás carbônico para a
água, o que é chamado de dissimilação”.
C) “Os microrganismos consomem dióxido de carbono para decomposição aeróbica de compostos orgânicos
e desenvolvem oxigênio”.
D) “Em condições anaeróbicas, a matéria orgânica dissolvida na água decompõe-se na presença de bactérias
que atuam sobre o carbono e oxidam uma parte para gás carbônico e outra parte é reduzida para metano”.
3
7) A 235 OC, a constante de equilíbrio do sistema X2(g) + Z2(g) → 2XZ(g) é igual a 36. Colocando-se 20 mols
de XZ, 15 mols de X2 e 10 mols de Z2, num recipiente de 5 L, a 235 OC. Assinale a alternativa correta para o
sistema restabelecer o equilíbrio químico.
(0,7 pt)
A) a concentração de Z2 deve crescer.
C) a concentração de XZ não deve variar.
B) a concentração de XZ deve crescer.
D) as concentrações de X2 e Z2 não devem variar.
8) Efeito Tyndall é um efeito óptico de espalhamento ou dispersão da luz, provocado pelas partículas de uma
dispersão coloidal. Através deste efeito, é possível observar as partículas de poeira suspensas no ar por meio
de uma réstia de luz, observar as gotículas de água que formam a neblina por meio do farol aceso do carro, e
ainda, observar o feixe luminoso de uma lanterna por meio de um recipiente contendo gelatina. Quando
tiossulfato de sódio reage com ácido clorídrico forma-se enxofre coloidal, onde o efeito Tyndall pode ser
observado através da luz do retroprojetor, ocasionando a mais linda reação química: “Por do sol químico”.
Assinale a alternativa que mostra a equação química correta do efeito acima relatado.
(0,7 pt)
A) Na2S3O2(aq) + 2HCℓ(aq) → SO2(g) + 2S(s) + H2(g) + 2NaCℓ(s)
B) S2O32-(aq) + 4H+(aq) → 2S(s) + 2H2O(l) + ½O2(g)
C) S2O32-(aq) + 2H+(aq) → SO2(g) + S(s) + H2O(l)
D) Na2S2O3(aq) + 2HCℓ(aq) → O2(g) + 2S(s) + H2O(l) + 2NaCℓ(aq)
9) A administração de medicamentos é um dos procedimentos mais cruciais para uma enfermeira em um
hospital. É necessário ter competência e habilidade para administrar medicamentos, passando ao paciente
confiança e segurança. Ocorrem situações em que a farmácia do hospital não dispõe de determinada solução
na concentração prescrita pelo médico. Se em uma determinada situação a enfermeira necessitar de
aproximadamente 500 mL de soro fisiológico 2% e tenha disponível apenas um frasco de 500 mL de soro
fisiológico 0,9% e ampolas de 10 mL de cloreto de sódio (NaCℓ) a 10%, quantas ampolas devem ser
adicionados no frasco disponível para obter o soro fisiológico na concentração desejada?
(0,9 pt)
A) 5,5.
B) 4,5.
C) 3,0.
D) 2,0.
10) De forma independente, o dinamarquês Johannes Nicolaus Brönsted (1879-1947) e o inglês Thomas
Martin Lowry (1874-1936), propuseram no mesmo ano a teoria ácido-base conhecida como Teoria BrönstedLowry, que diz o seguinte: “Ácido é a espécie química que doa prótons. Já uma base é o receptor de prótons.”
Entre as seguintes alternativas relacionadas com essa teoria, a única correta é:
(0,4 pt)
A) Um ácido e sua base conjugada reagem para formar sal e água.
B) O ácido H2O funciona como a sua própria base conjugada.
C) A base conjugada de um ácido forte é base forte.
D) O ácido conjugado de uma base forte é um ácido fraco.
11) Considere as reações abaixo e marque a alternativa que indica corretamente as reações exotérmicas:
(0,4 pt)
I. 1/2H2(g) + 1/2Cℓ2(g) → HCℓ(g) + 22,06 kcal
II. Fe2O3(s) + 3C(s) → 2Fe(s) + 3CO(g) ΔH = + 490 kJ
III. PbCℓ2(s) + Cℓ2(g) + 30 kJ → PbCℓ4(l)
IV. HCℓ(aq) + NaOH(aq) → NaCℓ(aq) + H2O(l) ΔH = – 57,7 kJ
V. H2(g) + 1/2O2(g) → 2H2O(l) – 68,3 kcal
VI. H2(g) + I2(g) – 25,96 kJ/mol → 2 HI(g)
A) I, II e III.
B) II, III e V.
C) I, IV e VI.
D) I, IV e V.
4
12) Uma certa reação química é representada pela equação: 3X(g) + 2Y(g) → Z(g), onde X, Y e Z
significam as espécies químicas que são colocadas para reagir. Verificou-se experimentalmente, em
uma certa temperatura, que a velocidade desta reação aumenta oito vezes com a duplicação da
espécie Y, mas não depende das concentrações de X e Z. Assinale a alternativa que contém
respectivamente, a expressão correta da velocidade e o valor correto da ordem de reação.
(0,9 pt)
A) v = k[Y]3[Z]2 e 5.
B) v = k[X]2[Y] e 3.
C) v = k[Y]3 e 3.
D) v = k[Y]2 e 2.
13) Entalpia de Combustão é a variação de entalpia (ΔH) da combustão completa de 1 mol de combustível,
estando todos os reagentes e produtos no estado padrão. Determine a entalpia de combustão do pentanol,
em kcal/mol, sendo dados:
(0,4 pt)
Entalpia de formação de C5H12 O(l) = – 792 kcal/mol
Entalpia de formação de CO2(g)
= – 94 kcal/mol
Entalpia de formação de H2O(l)
= – 68 kcal/mol
A) – 86 kcal/mol.
B) + 86 kcal/mol.
C) – 66 kcal/mol.
D) + 66 kcal/mol.
14) Leia atentamente o texto e a seguir e assinale a alternativa adequada que complementa o texto,
respectivamente:
(0,4 pt)
“A respiração aeróbica e anaeróbica utilizadas pelas bactérias é também responsável pela especificação e
mobilidade dos elementos químicos no ambiente marinho. O hidróxido férrico (_______), por exemplo, não é
solúvel e atua como uma partícula e tende a se precipitar no fundo submarino, mas quando esse composto é
utilizado pelas bactérias como um agente oxidante (_____________) da matéria orgânica, ele se (_______)
ao íon ferroso (____) que é a forma solúvel do ferro.” (Texto extraído de Oceanografia Química, de SILVA,
Carlos Augusto Ramos e,. (Org.). Rio de Janeiro: Interciência, 2011).
A) [Fe(OH)2], doador de elétrons, oxida, (Fe3+).
B) [Fe(OH)3], doador de elétrons, reduz, (Fe2+).
C) [Fe(OH)3], aceptor de elétrons, reduz, (Fe2+).
D) [Fe(OH)2], aceptor de elétrons, oxida, (Fe3+).
15) Para combater a azia estomacal usa-se um medicamento que possui em sua composição o bicarbonato
de sódio. Após ser ingerido, o bicarbonato de sódio apresenta as seguintes reações:
(0,4 pt)
I) HCO3– + H2O → H2CO3 + OH–
II) H2CO3 → CO2 + H2O
Faça uma análise das respostas abaixo e assinale a alternativa incorreta:
A) Ao usar o medicamento, o excesso de íons H+ no estômago é neutralizado pelos íons OH– produzidos.
B) Quanto mais OH– for consumido no estômago, menor será a produção de gás carbônico no final da
reação.
C) Ocorre reação de hidrólise na reação I.
D) O H2CO3 da reação II sofre decomposição.
5