QUÍMICA
11
A maior parte do dióxido de carbono gerado no metabolismo celular, no corpo humano, por reagir rapidamente com a água contida no sangue, é conduzida
pela corrente sanguínea, para eliminação nos pulmões.
a) Escreva a equação química que representa a reação
de equilíbrio entre o dióxido de carbono e a água.
b) Se no sangue não houvesse outras substâncias que
garantissem um pH próximo de 7, qual seria a conseqüência da reação do gás carbônico com a água
do sangue, em termos de pH?
Resolução
a) A equação química que representa a reação de equilíbrio entre o dióxido de carbono e a água é:
→ H CO (aq) ←
→ H+(aq) + HCO– (aq)
CO2(g) + H2O(l) ←
2
3
3
b) Se no sangue não houvesse outras substâncias que
garantissem um pH próximo de 7, teríamos um pH
menor que sete devido à liberação de íons H+ provenientes da reação entre CO2 e H2O, ocorrendo,
portanto, acidose
12
Para evitar o crescimento de algas e bactérias, costuma-se adicionar desinfetantes na água de piscinas.
Dentre eles, o hipoclorito de cálcio é muito utilizado. A
dissolução do hipoclorito na água é acompanhada da
reação representada pela equação:
→ 2HOCl(aq) + Ca(OH) (aq)
Ca(OCl)2(s) + 2H2O(l) ←
2
Sabe-se ainda que a semi-reação
→ Cl–(aq) + H O(l)
HOCl(aq) + H+(aq) + 2e– ←
2
é a responsável pelo efeito desinfetante do HOCl.
a) Qual é o efeito do uso contínuo de Ca(OCl)2 sobre o
pH da água de uma piscina submetida a este tratamento? Justifique.
b) O tratamento desta piscina deve incluir, portanto, o
ajuste ocasional do pH para próximo de 7,4, a fim de
evitar irritações nos olhos, peles e ouvidos.
Responda, usando uma equação química, se o ajuste de pH deve ser feito pela adição de ácido clorídrico (HCl) ou de carbonato de sódio (Na2CO3) na água
desta piscina.
Resolução
a) O pH da água de uma piscina aumenta quando usamos continuamente Ca(OCl)2 devido aos seguintes
fenômenos: formação de base forte (primeira reação) e consumo de íons H+ (segunda reação) da
água da piscina.
→ 2HOCl(aq) + Ca(OH) (aq)
Ca(OCl)2(s) + 2H2O(l) ←
2
ácido
base
fraco
forte
→ Cl–(aq) + H O(l)
HOCl(aq) + H+(aq) + 2e– ←
2
OBJETIVO
U N E S P ( P ro v a d e C i ê n c i a s B i o l ó g i c a s ) D e z e m b ro /2 0 0 1
b) Essa água contém excesso de íons OH– (o meio é
básico) que podem ser neutralizados por íons H+
provenientes da adição de ácido clorídrico.
HCl(aq) → H+(aq) + Cl–(aq)
OH–(aq) + H+(aq) → H2O(l)
13
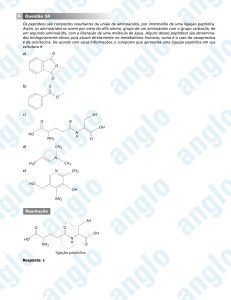
O adoçante aspartame pode ser sintetizado pela seqüência de duas reações, I e II.
I. Reação do metanol com o aminoácido de fórmula
estrutural
H
—
=
O
—
—
CH2 — C — C
OH
NH2
II. Ataque do produto da reação I sobre o grupo carboxílico mais próximo do grupo amina do composto
formando uma amida.
O
—
=
H
=
O
—
—
—
C — CH2 — C — C
HO
OH
NH2
Sabe-se que, em ambas as reações, I e II, além do produto orgânico, ocorre também a formação de água.
a) Utilizando fórmulas estruturais, escreva a equação
química que representa a reação I. Identifique a função do composto formado nesta reação.
b) Escreva a fórmula estrutural do produto da reação II.
Resolução
a) A primeira reação é uma esterificação:
H
—
=
O
→
+ H O — CH3 →
—
—
CH2 — C — C
NH2
OH
H
—
=
+ H2O
O — CH3
→
NH2
—
CH2 — C — C
—
→
→
O
éster
O composto formado pertence à função éster.
b) A segunda reação, entre um grupo carboxílico e um
grupo amina origina um composto com ligação amídica.
OBJETIVO
U N E S P ( P ro v a d e C i ê n c i a s B i o l ó g i c a s ) D e z e m b ro /2 0 0 1
—
H3C — O
→
NH
—
OH
—
=
—
—
NH2
H
C — C — CH2
+
—
—
C — CH2 — C — C
HO
O
=
=
O
—
H
O
H
—
—
=
N — C — CH2
O
H C
—
NH2
—
—
HO
H
—
—
=
O
C — CH2 — C — C
—
→ H2O +
H
=
O
O — CH3
14
A corrosão (oxidação) de móveis de ferro para praia
pode ser evitada pelo recobrimento da superfície com
alguns metais que, embora sejam mais ativos do que
o ferro, quando se oxidam formam revestimentos aderentes de óxidos, que são resistentes à corrosão.
a) Exponha uma razão que justifique por que o processo de corrosão do ferro ocorre mais facilmente em
regiões praianas.
b) Considere a tabela a seguir.
Semi-reação
Ag+(aq) + e– → Ag(s)
Cu2+(aq) + 2e– Cu(s)
Fe2+(aq) + 2e– → Fe(s)
Cr3+(aq) + 3e– → Cr(s)
Zn2+(aq) + 2e– → Zn(s)
E0(V)
+ 0,799
+ 0,342
– 0,447
–0,744
–0,762
Com base nesses dados, escolha os metais mais reativos que o ferro que poderiam ser utilizados para a
proteção de móveis de ferro. Justifique sua resposta.
Resolução
a) O processo de corrosão (oxidação) do ferro ocorre
mais facilmente em regiões praianas devido à umidade relativa do ar ser maior e pelo fato de a água
conter sais dissolvidos, o que facilita a condução da
eletricidade. A água é boa condutora quando tem
íons dissolvidos.
Fe(s) → 2e– + Fe2+(aq)
1/2O2(g) + 2e– + H2O(l) → 2OH–(aq)
b) Quanto mais reativo for o metal, menor o seu potencial de redução. Portanto os metais mais reativos
que o ferro são o zinco e o cromo. Estes sofrem oxidação mais facilmente que o ferro e agem como
metais de sacrifício. Exemplo:
Zn(s) → 2e– + Zn2+(aq)
Fe2+(aq) + 2e– → Fe0(s)
15
O isótopo radioativo 222
Rn, formado a partir de 238
U
86
92
por emissões sucessivas de partículas alfa e beta, é a
OBJETIVO
U N E S P ( P ro v a d e C i ê n c i a s B i o l ó g i c a s ) D e z e m b ro /2 0 0 1
principal fonte de contaminação radioativa ambiental
nas proximidades de jazidas de urânio. Por ser gasoso,
Rn atinge facilmente os pulmões das peso isótopo 222
86
Po, com um tempo de
soas, onde se converte em 218
84
meia-vida de 3,8 dias.
a) Calcule o número de partículas alfa e de partículas
beta emitidas, considerando a formação de um
átomo de radônio, no processo global de transU em 222
Rn. Considere as variações
formação do 238
92
86
dos números atômicos e dos números de massa
que acompanham a emissão de partículas alfa e
beta, para a resolução da questão.
b) Calcule o tempo necessário para que o número N0
de átomos de 222
Rn, retido nos pulmões de uma
86
pessoa, seja reduzido a N0/16 pela conversão em
218
Po.
84
Resolução
a) Podemos escrever a seguinte equação nuclear:
238
U → x
92
4
0
α + y
2
β
222
+
–1
Rn
86
Cálculo do x (número de partículas alfa)
238 = x . 4 + 222
x=4
Cálculo do y (número de partículas beta)
92 = 8 – y + 86
y=2
3,8d N0 3,8d N0 3,8d N0 3,8d N0
b) N0 → ––– ––––––– ––– ––––––– ––– ––––––– –––
2
4
8
16
tempo total = 4 x 3,8d = 15,2d
16
Considere os hormônios progesterona e testosterona,
cujas fórmulas estruturais são fornecidas a seguir.
=
O
CH3
C — CH3
H3C
O
OBJETIVO
Progesterona
(hormônio feminino)
U N E S P ( P ro v a d e C i ê n c i a s B i o l ó g i c a s ) D e z e m b ro /2 0 0 1
CH3
OH
H3C
O
Testosterona
(hormônio masculino)
a) Quais são as funções orgânicas que diferenciam os
dois hormônios?
b) Tanto a molécula de progesterona como a de testosterona reagem com solução de bromo. Utilizando
apenas o grupo de átomos que participam da reação, escreva a equação química que representa a
reação entre o bromo e um dos hormônios.
Resolução
a) O hormônio progesterona apresenta dois grupos
que caracterizam a função cetona, enquanto o hormônio testosterona apresenta um grupo álcool no
lugar de um grupo cetona.
b) Ocorre adição de bromo aos átomos de carbono da
dupla ligação.
H3C
H3C
+ Br2 →
O
O
Br
Br
OBJETIVO
U N E S P ( P ro v a d e C i ê n c i a s B i o l ó g i c a s ) D e z e m b ro /2 0 0 1