Microbiologia
1) Definições:
Parasitologia: É a ciência que estuda os parasitas (seres que dependem de outros para sobreviver)
. Endoparasitas: Vivem internamente no hospedeiro.
. Ectoparasitas: Vivem na superfície do hospedeiro.
Ex: Helmintos, artrópodes, protozoários.
Microbiologia: É a ciência que estuda os microrganismos (seres microscópicos menos evoluídos)
Ex: Bactérias, fungos, vírus.
Imunologia: Ciência que estuda o sistema imune, relacionado à medidas de defesa do corpo frente a
parasitas ou microrganismos.
2) Introdução/Origem da vida:
A unidade básica de qualquer ser vivo é chamada de célula. Todas estas apresentam bioquimicamente
elementos básicos, como aminoácidos, proteínas, carboidratos, lipídios e ácido nucléico.
O primeiro ser vivo constituía de uma célula simples apenas de ácido nucléico, envolvido por uma membrana,
e possuía o poder de auto-replicação. Esta célula não possuía núcleo organizado, portanto é chamada de
procarionte, com capacidade de realizar fotossíntese (organismo autótrofo).
Deste ancestral comum surgiram 3 linhas de povoamento:
a) Arquibactérias: mais primitivas.
b) Eubactérias: Ancestrais das bactérias atuais.
c) Linha nuclear: Seres nucleados (eucarionte).
Algumas das primeiras células eucariontes começaram a apresentar mitocôndrias, as quais deram origem aos
protozoários e animais. Em outro grupo surgiram mitocôndrias e cloroplastos, as quais deram origem a algas e
plantas.
3) Principais diferenças entre procariontes e eucariontes:
Características
Tamanho
Número de cromossomos
Membrana nuclear
Aparelho mitótico
Mitocôndrias
Cloroplasto
Aparelho de Golgi
Retículo endoplasmático
Lisossomos
Ribossomos
Célula Procarionte
1 a 2 por 1 a 4 μm
1 fita cromossômica circular
Não possui
Não possui
Não possui
Não possui
Não possui
Não possui
Não possui
70s
Celular Eucarionte
Acima de 5 μm
Mais de 1 cromossomo linear
Possui
Possui
Possui
Possui (algas e plantas)
Possui
Possui
Possui
80s
4) Classificação taxonômica:
É a divisão dos seres vivos segundo suas semelhanças e diferenças.
Reino
filo
classe
ordem
família
gênero
*considerações levadas por Whittaker no estudo dos reinos: evolução e forma de nutrição.
espécie
5) Classificação dos organismos segundo Reinos:
A divisão é feita primeiramente separando em pro/eucariontes.
Monera
Protista
Fungi
Animalia
Plantae
* Vírus
Monera
Seres procariontes e unicelulares: bactérias e cianofíceas. Nutrição por absorção, ingestão e fotossíntese.
Protista
Seres eucariontes e unicelulares: protozoários. Nutrição por absorção, ingestão e fotossíntese.
Fungi
Seres eucariontes, uni ou pluricelulares: Fungos, liquens. Nutrição por absorção. Geralmente são imóveis.
Animalia
Seres eucariontes e pluricelulares. Nutrição por ingestão.
Plantae
Seres eucariontes e pluricelulares. Nutrição por fotossíntese.
*Vírus
Seres acelulares, compostos por cápsula protéica e material genético. *Necessitam invadir outras células para
poderem se replicar, por isso há polêmica quanto à consideração dos vírus como seres vivos.
6) Importância da microbiologia
I – Doenças infecciosas
-Brucelose
-Tuberculose
II – Ação deletéria – Destruição de alimentos
- Bolor
III – Uso na produção de alimentos
- Levedura
IV – Presença importante no corpo
I – Morfologia e Arranjos Bacterianos
1) Morfologias:
- Cocos
- Bacilo ou Bastonetes
- Espiralada
- Filamentosa
2) Arranjos Bacterianos
a) Cocos
-- Diplococos
-- Tétrodes
-- Sarcinas
-- Estreptococos
-- Estafilococos
b) Bastonetes
-- Diplobastonete
-- Estreptobastonete
-- Palicada ou caracteres chineses
c) Pleomorfas – Não possuem arranjo com forma definida.
II – Crescimento e Reprodução Bacteriana:
1º - Reprodução Bacteriana (Assexuada):
- Cisparidade
- Fissão Binária ou Repartição
Célula Principal
Elongação Celular
Duplicação
Formação de uma parede
Invaginação de 2 células
2º Curva de Crescimento
Padrão normal de organismo.
Devido ao sistema imunológico, nem sempre temos este padrão normal no organismo. O sistema quebra este
ciclo.
É comum haver casos de choque na fase 4 na curva de crescimento, causando morte bacteriana e liberando
várias toxinas, o que é prejudicial ao organismo.
3º Fatores que interferem no crescimento bacteriano:
A – Temperatura Se dividem em 3 tipos:
* Psicotróficas – crescem entre 4 e 18ºC
* Mesófilas – Crescem entre 20 e 40ºC
* Termófilas – Crescem entre 40 e 110ºC
B – Tensão de O2
Se dividem em 4 grupos:
* aeróbias – crescem numa taxa de O2 de 20%.
* anaeróbias – crescem numa taxa de O2 de 6% ou menos.
* aeróbias facultativas – crescem em qualquer taxa de O2.
* microaeróbias – crescem numa taxa de O2 de 8 a 18%
III – Relação entre estrutura e função da na célula bacteriana:
Cromossomo – Ácido Nucléico: Fita de DNA única e enovelada, dispersa no citoplasma.
Ribossomos – 40% RNA e 60% proteínas. São responsáveis por ler o RNA e sintetizar proteínas.
Mesossomos – Invaginações da membrana plasmática. É onde se inicia e onde termina a replicação bacteriana.
Membrana citoplasmática – sua constituição é semelhante às células eucariontes:
- M. Citoplasmática Procarionte: composta por uma camada bilaminar de fosfolípides.
- M. Citoplasmática Eucarionte: composta por uma camada bilaminar de fosfolípides + esteróides.
*Funções: Transporte de moléculas para o interior da bactéria.
Armazenamento de energia.
Síntese de enzimas atuantes em sua cadeia respiratória.
Parede Celular – Responsável pela proteção física da bactéria.
Cápsula – Composta por polissacarídeos, possui 3 funções básicas:
-Aderência.
-Proteção contra a penetração de substâncias nocivas à bactéria.
-Virulência – Impede a resposta imune do hospedeiro.
Pili – Aderência
Flagelo – Constituído por proteínas, está inserido a superfície da membrana citoplasmática; é responsável pelo
movimento da bactéria.
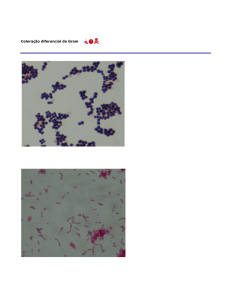
IV – Coloração de GRAM
1- A técnica de coloração de GRAM está relacionada à parede celular. De acordo com a coloração, pode-se dividir as
bactérias em 2 classificações:
GRAM positivo (+) – apresentam uma parede celular formada por várias camadas de peptídeo glicano sobrepostas
(geralmente cerca de 20), constituindo 90% de sua composição. = Roxa
GRAM negativo (-) – apresentam parede celular formada por apenas uma camada de peptídeo glicano. = Rosa
2 - Processo de coloração de GRAM
1º - Preparo do esfregaço
Suspender uma pequena porção da amostra bacteriana a ser corada em uma gota de água ou solução salina 0,85%,
sobre uma lâmina de microscópio, espalhando a gota. Este procedimento deve ser feito com um alça bacteriológica
flambada ou um palito de madeira esterilizado. Deixar o material secar e, em seguida, fixá-lo com calor, flambando
rapidamente a lâmina acima da chama de um bico de Bunsen.
2º - Aplicação do corante primário
Cobrir toda a sua superfície da lâmina com o corante cristal violeta; deixar em repouso por um minuto. Descartar o
excesso de corante ou enxaguar a lâmina com água.
3º - Aplicação do fixador
Cobrir toda a sua superfície da lâmina com lugol; deixar em repouso por um minuto. Descartar o excesso do fixador ou
enxaguar a lâmina com água.
4º - Descoloração
Com a lâmina inclinada, despejar algumas gotas de álcool-acetona 1:1 v:v (descolorizador) para remover o complexo
cristal violeta-lugol de células Gram-negativas. Este procedimento não pode exceder a cinco segundos, pois o
descolorizador poderá remover o corante cristal violeta das células Gram-positivas. Em seguida, enxaguar a lâmina com
água para remover excesso de solvente.
5º - Aplicação do corante secundário
Cobrir toda a sua superfície da lâmina com o corante fucsina básica; deixar em repouso por um minuto. Enxaguar a
lâmina com água e tocar as bordas com papel absorvente para remoção do excesso de água.
6º - Microscopia
Examinar a amostra ao microscópio óptico. Na aplicação da técnica de coloração de Gram de organismos
desconhecidos, pode-se utilizar como controles uma bactéria Gram-positiva e uma Gram-negativa, conhecidas,
preparando-se lâminas com três esfregaços, sendo o esfregaço central o da bactéria desconhecida. Desta forma, as
bactérias controles indicarão se a técnica foi ou não bem sucedida. Sugere-se utilização de Bacillus subtilis e
Escherichia coli como controles Gram positivo e Gram negativo, respectivamente.
-Descrição do processo de coloração:
O método consiste no tratamento de uma amostra de uma cultura bacteriana crescida em meio sólido ou líquido, com
um corante primário, o cristal violeta, seguido de tratamento com um fixador, o lugol. Tanto bactérias Gram-positivas
quanto Gram-negativas absorvem de maneira idêntica o corante primário e o fixador, adquirindo uma coloração violeta
devido à formação de um complexo cristal violeta-iodo, insolúvel, em seus citoplasmas. Segue-se um tratamento com um
solvente orgânico, o etanol-acetona (1:1 v:v). O solvente dissolve a porção lipídica das membranas externas das
bactérias Gram-negativas e o complexo cristal violeta-iodo é removido, descorando as células. Por outro lado, o solvente
desidrata as espessas paredes celulares das bactérias Gram-positivas e provoca a contração dos poros do
peptidoglicano, tornando-as impermeáveis ao complexo; o corante primário é retido e as células permanecem coradas. A
etapa da descoloração é crítica, pois a exposição prolongada ao solvente irá provocar a remoção do cristal violeta dos
dois tipos de bactérias, podendo produzir resultados falsos. A retenção ou não do corante primário é, portanto,
dependente das propriedades físicas e químicas das paredes celulares bacterianas tais como espessura, densidade,
porosidade e integridade.
Em seguida, a amostra é tratada com um corante secundário, a fucsina básica. Ao microscópio, as células Grampositivas aparecerão coradas em violeta escuro e as Gram-negativas em vermelho ou rosa escuro. Células de bactérias
Gram-positivas, células velhas, mortas ou com envelopes danificados por agentes físicos ou químicos, tendem a perder
o cristal violeta e uma mesma amostra bacteriana pode exibir parte ou todas as células coradas como Gram-negativas.
Portanto, o uso de material fresco é importante. Por outro lado, resultados do tipo "falso Gram-positivo" só são obtidos se
o tratamento com etanol-acetona for omitido.
O corante cristal violeta pode ser substituído, com os mesmos resultados, pelo azul de metileno e a fucsina básica pode
ser substituída pelo corante vermelho safranina. A fucsina cora muitas bactérias Gram-negativas mais intensamente que
a safranina, que por sua vez não cora prontamente algumas espécies de bactérias. O solvente etanol-acetona pode ser
substituído por álcool 95%.
A técnica da coloração de Gram não é infalível e pode-se fazer o teste do hidróxido de potássio (KOH). Em um lâmina de
microscopia adicionam-se duas gotas de uma solução de KOH a 3%. Com o auxílio de uma alça de semeadura coletase uma colônia isolada da bactéria a ser testada e mistura-se com a solução de KOH na lâmina por 30 segundos.
Durante a mistura deve-se erguer a alça de semeadura cerca de 1 a 2 cm da superfície da lâmina observando-se se há
fios de material viscoso pendentes. Se a bactéria for verdadeiramente Gram-negativa, o KOH irá romper sua parede
celular e liberar seu DNA que será observado como fios viscosos. Se a bactéria for Gram-positiva não haverá a formação
de fios.
I – História da Microbiologia:
Em 1665 Robert Hooke começou a pesquisar as primeiras células com um microscópio primitivo, baseando-se
na teoria celular (todo organismo vivo é formado de uma unidade fisiológica e morfológica fundamental,
chamada célula).
Em meados de 1700. Leewenhoek conseguiu observar microorganismos mais detalhadamente por possuir um
microscópio mais potente.
De 1700 a 1850 prevaleceu a teoria da abiogênese ou de geração espontânea (vida surgir a partir de matéria
“morta”). Esta teoria ganhou força por cientistas perceberem que, mesmo em recipientes completamente
tampados, ainda assim ‘surgiam’ organismos vivos. (hoje sabemos que isso ocorria pois os recipientes não eram
devidamente esterilizados, e conseqüentemente→ os microrganismos anaeróbios conseguiam se replicar.
Em 1861 Pasteur derruba a teoria da abiogênese, afirmando e provando que com a correta esterilização e
embalo não é possível surgir vida. O método utilizado foi, basicamente, de esterilizar dois recipientes e apenas
‘limpar’ um terceiro. Nos 3 foi colocado caldo de carne (matéria orgânica “morta”) e um dos recipientes
esterilizado e o ‘limpo’ foram lacrados e deixados por algum tempo. Observou-se a replicação microbiológica no
recipiente que não foi lacrado e no “limpo”, enquanto o recipiente esterilizado e lacrado continuou sem
microrganismos. Essa técnica de esterilização e embalo ficou conhecida como “Pasteurização”, e é muito
utilizada para alimentos e condimentos. Com Pasteur também surgiram diversas outras técnicas de assepsia.
Em1886 Robert Koch relacionou e mostrou que microorganismos podem ser causadores de patologias. Para isso,
estudou o sangue retirado de indivíduos bovinos infectados com uma doença e notou a presença de bactérias.
Cultivou-as e inoculou-as em indivíduos saudáveis, os quais vieram a desenvolver a mesma patologia,
comprovando sua teoria.
Em meados do ano 2000 surgiu a PCR, técnica de “Reação em Cadeia pela Polimerase”, conhecida como exame
de DNA, muito importante em identificação e diferenciação de indivíduos de mesmo gênero, mas com
características morfofisiológicas muito semelhantes entre diferentes espécies, sua diferença estando por
exemplo em diferentes patologias ou anti-bióticos funcionais. Ela consiste, através de variações de temperatura,
na multiplicação em escala geométrica das fitas de DNA, produzindo mais de um bilhão de cópias após 30 ciclos.
II – Coloração de GRAM e sua exceção
1) GRAM (+) – apresentam em sua totalidade camadas sobrepostas de peptídeos glicanos.
2) GRAM (-) – apresetam uma camada de peptídeo glicano, lipoproteínas, fosfolípide e lipopolissacarídeos. Devido à
estes, tem resistência elevada contra antibióticos, principalmente do grupo das penicilinas.
3) Exceção ao GRAM:
BAAR – Bactérias álcool/ácido resistentes
Dentre as bactérias, existem algumas que não possuem ou possuem poucos constituintes se tratando de parece
celular(maior parte lipídeos, 60% ácido micólico). Algumas microbactérias, como Mycobacterium tuberculosis e
Mycobacterium leprae são resistentes ao processo de coloração de GRAM, tornando-o inefetivo. Para estas é utilizado o
processo de coloração de BAAR, ou método de Ziehl-Neelsen, ou então método de coloração à quente.
Coloração de BAAR
1
2
3
4
5
6
7
8
9
10
11
12
Preparar um esfregaço homogêneo, delgado e identificado em uma lâmina nova desengordurada, limpa e
seca;
Deixar secar à temperatura ambiente;
Fixar o material do esfregaço passando 3 a 4 vezes pela chama do bico de Bunsen;
Cobrir a totalidade da superfície do esfregaço com solução de Fucsina fenicada, previamente filtrada ou
filtrado sobre a lâmina no momento da coloração;
Deixar agir por cerca de 5 minutos, aquecendo brandamente utilizando algodão umedecido em álcool ou
com a chama do bico de Bunsen, passando lentamente por baixo da lâmina, até que se produza emissão
de vapores e, quando estes são visíveis, cessar o aquecimento. Repetir essa operação até completar três
emissões sucessivas. Evitar a fervura e secagem do corante (adicionar mais corante, se preciso, dentro
deste período para evitar que a lâmina seque porque o esfregaço precisa estar coberto
permanentemente durante o aquecimento.). Este aquecimento deve ser intermitente, pois é importante
manter a solução aquecida durante o tempo previsto;
Lavar em água corrente para eliminar a Fucsina. Toma-se a lâmina pelo extremo numerado, inclinar para
frente e lavar deixando cair um jato d’água de baixa pressão sobre a película corada, de maneira que essa
não se desprenda;
Cobrir toda a superfície do esfregaço com a solução de Álcool-ácido. Tomar a lâmina entre o polegar e o
indicador e fazer um movimento de vai-e-vem, de modo que o Álcool-ácido vá descorando suavemente a
Fucsina. Se o esfregaço estiver ainda com a cor vermelha ou rosada, descora-se novamente. Considera-se
descorado o esfregaço, quando suas partes mais grossas conservarem somente um ligeiro tom rosado.
Essa operação dura, em geral, dois minutos;
Terminada a fase de descoloração e eliminado o Álcool-ácido, lavar a lâmina da mesma forma como se
procedeu depois da coloração com a Fucsina, com cuidado para não desprender a película;
Cobrir toda a superfície do esfregaço com solução de Azul de metileno durante 30 segundos a 1 minuto;
Lavar, da mesma forma como se indicou para a Fucsina, tanto o esfregaço como a parte inferior da
lâmina;
Colocar a lâmina com o esfregaço para cima, sobre o papel limpo, para secar à temperatura ambiente ou
estufa a 35º C;
Observar ao microscópio com objetiva de imersão (100 x).
III – Meios de cultura:
1º Definição e composição:
-Meio de cultura é o material composto por todos os nutrientes necessários para o crescimento de microrganismos em
laboratório.
-Para o crescimento de determinado grupo de M.O., precisamos saber tudo o que aquele grupo necessita: pH,
temperatura, nutrientes e % de O2.
-Podem ser realizados em ensaios ou placa de Petri (mais comum).
*O local deve estar esterilizado.
*Constituído de microrganismos e ágar (polissacarídeo obtido de algas marinhas).
--Para preparar o ágar, prepare a solução do mesmo e deixe em banho Maria a 50ºC. eventualmente o ágar tornar-se-á
sólido, estando pronto para o uso.
2º Meios especiais de cultivo:
Meios redutores – usado principalmente para bactérias anaeróbicas.
Meio diferencial – meio com diferentes nutrientes (obtido geralmente com adição de sangue na produção do
ágar – ágar sangue). Geralmente bactérias de infecção de garganta, ex : streptococcus.
Meio de enriquecimento – amostra de fezes suspeita de infecções entéricas. É um meio rico em nutrientes
essenciais para o grupo de bactérias específico da suspeita.
Cobaias – usado para bactérias que não se desenvolvem em meios de cultura.Ex: agente causador da lepra ou
ranseniase (Mycobacterium leprae).
I) Microbiota normal do corpo humano
A microbiota normal do corpo humano é um grande grupo de micro organismos (especialmente bactérias)
constituído por uma grande variedade de espécies que habitam mucosa, pele, e grande parte das vísceras ou órgãos de
praticamente todos os indivíduos.
A microbiota normal inicia no momento do nascimento ao passar pelo canal do parto.
Pele
A microbiota normal é distribuída por toda a pele mas têm uma preferência maior por áreas quentes e
úmidas,nesses locais o valor que encontramos é de aproximadamente 106 m.o./cm2 ; nas outras regiões da pele é de
aproximadamente 104 m.o./cm2 . Na pele são encontrados (mais comuns) staphylococcus e corynebacterium, e em
menor quantidade streptococcus.
Cavidade oral
Encontra aproximadamente 108 m.o./mL de saliva e sendo as principais do tipo: staphylococcus, streptococcus,
neisseria e mycoplasma.
Aparelho digestório
Esôfago → estéril (não possui m.o.)
Estômago → tende a ser estéril, porém após as refeições pode apresentar um numero variável de
bactérias.
Porção anterior do duodeno → aprox. 10³ m.o./mL de suco entérico, staphylococcus e lactobacillus.
Porção posterior do duodeno e jejuno → 107 m.o./mL de suco entérico, número de espécies bem
variado.
Cólon → 1010 m.o./g de bolo alimentar e o número de bactérias é elevado.
A microbiota entérica é a principal microbiota do corpo, entre tanto os M.O. são os principais responsáveis por
infecções endógenas.
Vagina
2 períodos: 1° período entre a puberdade e a menopausa e o 2° período é o pós menopausa.
1° período predomina os lactobacillus.
2° período encontra-se staphylococcus e corynebacterium.
Ouvido
A microbiota do ouvido é muito semelhante a da pele.
Significado da microbiota normal
Funções: maléfica e benéfica
A principal função dessa microbiota normal seria de defesa do organismo (relacionado com a imunidade); uma
função especifica da microbiota entérica seria a defesa contra a Salmonella.
Já o lado maléfico dessa microbiota normal é que pode trazer doenças, principalmente quando apresentarmos
uma queda de imunidade (imunossupressão). Ex: indivíduos que recebem antibióticos ficam mais sujeitos a uma
infecção por salmonellas.
ETA’s → enfermidades transmitidas por alimentos
II) Cocos gram +
1. Staphylococcus são cocos gram +,tendem a forma arranjos em forma de cachos de uva, são bactérias
amplamente distribuídas na natureza e fazem parte de microbiota normal de vários locais do corpo como pele,
mucosa e etc; têm quatro espécies de staphylococcus divididos em dois grupos:
Coagulase + e coagulase –
Coagulase é a capacidade de coagulação do plasma (parte líquida do sangue).
Coagulase + principal espécie (spp) S.aureus está relacionada com infecções piogênicas (produzem pus).
Coagulase – principais spp …
Staphylococcus são anaeróbias facultativas e preferem baixa umidade.
S. aureus produzem diversa toxinas que contribuem para a patogênicidade (facilitam a invasão do corpo
acarretando lesão aos tecidos). Ex: a principal toxina é a enterotoxina é a responsável pelas intoxicações de
origem alimentar.
Infecção alimentar ≠ intoxicação alimentar
Relacionado com alimento contaminado infecção alimentar é a ingestão da bactéria.
Intoxicação alimentar é a ingestão dos produtos da bactéria (ou seja, das toxinas produzidas pela
bactéria).
2. Streptococcus
São bactérias gram + e geralmente crescem em cadeias e sua principal spp patogênica é S. Pyogenes
(causa faringite). S. Pyogenes precisam de um meio de cultura especial, esse meio é o ágar sangue, segundo a
tensão de O2 eles são anaeróbicos facultativos.
S.pneumoniae é responsável pela pneumonia e crescem aos pares (são diplococcus).
Streptococcus produzem substancias extra celulares que são essenciais para patogenicidade, as
substancias extra celulares destoem células fagociticas (que protegem o organismo).
Principais spp relacionadas com constituição de alimentos
S.lactis e S.cremonis estão relacionadas com a produção de laticínios (produção de manteiga).
3. Cocos gram –
Neisseria
Neisseria são cocos gram – aeróbicos e a tensão de O2 acima de 18% fazem parte da microbiota normal
especialmente da nasofaringe. E têm duas spp patogênicas são:
N.gonorrhoeae → gonococo → gonorréia
N.meningitidis → minigococo → menigite
A neisseria é resistente a vancomicina, polimixina e nistatina, esses antibióticos são utilizados no meio seletivo
de cultura da neisseria.
A neisseria geralmente crescem aos pares. (parecendo dois caroços de feijão)
4. Bacilos gram +
Corynebacterium são bacilus gram positivos que crescem na forma de clava
paliçada de caracteres chineses, são piogênicas.
5. Bacilos gram – …..
e formam arranjos de forma
Enterobactérias são anaeróbias facultativas e se locomovem através de flagelos peritríqueos (são aqueles que
estão presentes em toda a estrutura bacteriana). Possuem grandes quantidades de fímbrias (PILI).
As enterobactérias produzem varias proteínas chamadas de bacteriocinas que causam a morte de
bactérias intimamente relacionadas fazendo que ocorra o equilíbrio da flora intestinal.
Grupos e detalhes das enterobacterias
1) Escherichia é um habitante natural ou mais comum do trato intestinal, a principal spp é a E.coli.
A presença dessa bactéria na água ou no alimento é um indicador de contaminação fecal.
A spp E.coli têm vários sorotipos (varias variedades), e muitas vezes elas não são patogênicas, porem
algumas vezes elas podem estar relacionadas com infecções urinarias, já outros sorotipos estão
relacionados com a diarréia.
A diarréia associada a E.coli causa doença grave de origem alimentar.
2) Salmonella na grande maioria das vezes ela é responsável por doenças. São habitantes naturais do intestino
de aves e bovinos. Geralmente a doença está relacionada com condições sanitárias inadequadas.
A salmonella causa a salmonelose, a principal spp é a S.enterica que possui aproximadamente 2400
variedades sorológicas.
A salmonella é uma das causadoras mais comuns de intoxicação alimentar.
3) Shigella é uma bactéria típica de seres humanos e elas causam disenteria bacilar ou shigelose, e é uma das
principais causas da diarréia dos viajantes.
4) Klebsiella é encontrada normalmente no solo ou na água e a sua principal spp patológica é a K.pneumoniae
que causa a pneumonia.
5) Enterobacter
Principais spp:
E.cloacae
E.aerogenes
É encontrada nos homens e nos animais e no ambiente ela é encontrada no solo, água e esgoto.
É responsável por infecção urinaria e esta relacionada a infecção de origem hospitalar.
6) Pasteurella
Principal spp P.multocida responsável por patologia no ser humano. Ela apresenta uma característica
que é uma exceção entre as outras bactérias: elas são imóveis.
Essas bactérias são comuns no trato intestinal em diversas spp animais, porém em cães e gatos, além do
intestino elas podem ser encontradas na cavidade oral (na saliva).
Controle do crescimento microbiano
I.
II.
Definição:
São formas de impedir que a população de M.O. se multipliquem, atuando no sentido de prevenir ou
controlar doenças.
Definição de termos:
a) Esterilização é a retirada total de micro organismos presentes em um determinado local .
b) Desinfecção é a retirada parcial de micro organismos de objetos inanimados. Ex: descontaminação do
vaso sanitário.
c) Antissepsia é a retirada parcial de M.O. de tecidos vivos. Ex: lavar as mãos.
d) Assepsia é uma técnica de prevenção, assepsia é um conjunto de medidas para impedir que o micro
organismo atue em locais inadequados. Ex: utilização de luvas.
Métodos físicos: estão relacionados a esterilização (geralmente).
A. Temperatura
Temperatura baixa diminui o metabolismo dos M.O. fazendo com que esses M.O. não consigam se multiplicar.
Ex: geladeira(1 a 8°C).
Temperatura alta
calor úmido
1º método é a água em ebulição (100°C) mesmo assim têm alguns esporos que podem resistir. A água
em ebulição está mais ligada a desinfecção.
2º método é a panela de pressão onde a água atinge mais de 100°C.
3º autoclave é utilizada em laboratório e tem controle de pressão e temperatura atingida, é utilizada
para esterilização.
4º pasteurização é a relação entre a temperatura e o tempo e é mais utilizada no leite e em laticínios.
Pasteurização rápida: 72 a 75°C / 15 a 20 segundos. É um método de desinfecção parcial.
UHT é uma ultra pasteurização onde é feita a esterilização e as temperaturas chegam a 138°C
Calor seco
1º forno Pasteur é feita a esterilização através do ar quente.
2º incineração é a queima do material.
No geral para conseguirmos uma esterilização é necessário uma associação de temperatura alta e tempo alto.
Em calor úmido a média é de 30 minutos a 120°C, já em calor seco o tempo é de 120 minutos a 160°C.
B. Filtração
É feita através de filtros bacteriológicos que tem a capacidade de reter todos os micro organismos da
solução, ocorrendo a esterilização.
C. Radiação
RX e UV têm utilidade antimicrobiana.
Métodos químicos: são mais voltados para desinfecção ou antissepsia. O tempo deve estar associado a
concentração. Ex: formol puro durante um mês pode levar a esterilização.
Limpeza previa é a lavagem com água e sabão depois tem a capacidade de remover até 90% dos M.O.
Agentes químicos antimicrobianos:
Fenóis: desinfetantes
Álcool: álcool 70%
Halogênios: cloro e iodo (bactericida)
Metais pesados: mercúrio, cobre e prata ( Cu e Ag inibem o crescimento bacteriano)
Detergentes: destroem os lipídeos dos M.O. impedindo que eles se multipliquem.
Outros conceitos e controle de infecções hospitalares
CIDA: matar, ex: bactericida
Stase: (stático) inibir o crescimento bacteriostático
Degermação: é uma antissepsia, ou seja, retirada de M.O. da pele através de uma atuação (ou remoção) mecânica.
Ex: utilizar algodão com álcool antes da injeção.
Nosocomial: microbiota hospitalar. São infecções adquiridas em hospital onde o paciente é suscetível. Geralmente
são CEPAS resistentes a antibióticos.
Para isso têm que ter uma profilaxia (prevenção e controle) eficiente obrigatória, complexa e multiprofissional.