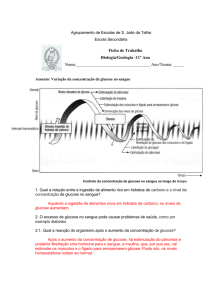
GLICÉMIA E CETONÉMIA
A. GLICÉMIA E GLICOSÚRIA
A glucose é o principal açúcar existente no sangue, que serve como "fonte de energia" aos
tecidos. A glicémia é a taxa de glucose existente no sangue, e o seu nível é em geral mantido
dentro duma gama de valores considerados normais. Glicosúria refere-se à presença de
glucose na urina e é sempre anormal.
Métodos Enzimáticos de determinação das concentrações de glucose
Usam enzimas específicos, habitualmente a glucose oxidase. Na aula prática irá utilizar um
método deste tipo.
A glucose oxidase cataliza a oxidação da glucose em ácido glucónico, com formação de
peróxido de hidrogénio (H2O2). Este reage com o fenol e 4-aminofenazona, na presença da
peroxidase, com formação de um composto vermelho-violeta, a quinoneimina:
Glucose Oxidase
D-Glucose + O2 + H2O
D-Gluconato (ácido glucónico) + H2O2
Peroxidase
H2O2 + 4-Aminofenazona + Fenol
Quinoneimina + 4H2O
A intensidade da coloração é proporcional à quantidade de glucose contida na solução.
É um método sensível e específico para o doseamento da glucose.
Métodos enzimáticos semi-quantitativos (métodos de comparação)
Trata-se de testes enzimáticos rápidos, sob a forma de fitas contendo a glucose-oxidase e
peroxidases, indispensáveis para o auto-controlo dos doentes diabéticos. São usados tanto
para o sangue (ex: Glucostix, BMtest), como para a urina (ex: Combur, Ketodiastix).
Nestes métodos basta uma gota de sangue/ urina para estimar a concentração da glucose, por
comparação com uma escala de cores.
No caso do sangue, há actualmente disponível no mercado uma grande variedade de
dispositivos que fazem a leitura da glicémia automaticamente.
1
A urina é habitualmente avaliada por comparação de cores a olho nú, embora também já
existam aparelhos de leitura automática.
A.1. Gicémia
Os valores normais da glicémia variam com as refeições, o stress e o local de colheita:
O valor normal em jejum de 8h é de 0,5 a 1,1 g/ l ou 50-110 mg% (mg/100ml) ou seja 2,8 –
6,1 mmol/ l (mM).
Em situações de stress, ex: traumatismos graves, pode verificar-se hiperglicémia por
libertação de adrenalina e cortisol.
Na prática clínica, a determinação da glicémia faz-se em dois grupos de circunstâncias:
1- Suspeita de hiperglicémia
Esta surge genericamente por:
a) défice de acção da insulina – diabetes mellitus
b) exagero de acção de uma ou mais “hormonas da contra-regulação” (ex: síndrome de
Cushing –cortisol , hipertiroidismo – tiroxina).
A diabetes mellitus é uma doença crónica provocada por alterações do metabolismo de
hidratos de carbono, lípidos e proteínas, resultantes do défice de insulina. Manifesta-se
clinicamente por: polifagia, polidipsia (sede excessiva), poliúria e perda de peso.
Define-se pela existência de glicémia em jejum ≥126mg/dl ou ≥ 200mg/dl em determinação
ocasional ou 2h após teste de tolerância à glucose oral (i.e. a ingestão de 75g de glucose em
200ml de água, no adulto).
Na diabetes mellitus, a hiperglicémia deve-se à diminuição da captação de glucose pelas
células dos tecidos periféricos, particularmente do tecido muscular e do tecido adiposo, por
défice de acção da insulina.
Distinguem-se dois tipos de Diabetes:
Diabetes Tipo 1 – por défice da produção de insulina- mais frequente no jovem e
insulinodependente.
Diabetes do Tipo 2 – por resistência à acção da insulina - mais frequente no adulto e
habitualmente controlável com antidiabéticos orais, necessitando de insulina ocasionalmente
ou mais tardiamente na sua evolução.
2- Suspeita de hipoglicémia
2
Num indivíduo normal, os mecanismos de regulação da glicémia são muito eficazes, de modo
que mesmo num jejum prolongado/ greve de fome não se verifica hipoglicéma. A
hipoglicémia é sempre uma situação anormal, cuja causa deve ser investigada, sobretudo se
recorrente. Clinicamente manifesta-se por dois grupos de sinais/sintomas: glicopénicos, por
falta de glucose cerebral (prostração, tremores, convulsões, coma) e adrernérgicos, por
estimulação da libertação de adrenalina (palidez, hipersudorese, taquicardia).
Qualquer alteração dos mecanismos produtores de glucose sanguínea (glicogenólise,
gluconeogénese…) ou fornecedores de fontes de energia alternativas, poupando glucose,
nomeadamente no jejum (oxidação dos ácidos gordos, cetogénese…) pode conduzir a
hipoglicémia. Essa alteração pode dever-se a défice das reservas (ex: de glicogénio, como nos
recém-nascidos prematuros) e/ou imaturidade dos sistemas enzimáticos, a défice enzimático
hereditário ou adquirido (ex: devido a uma doença hepática grave) ou a alteração hormonal
(excesso de secreção de insulina – hiperinsulinismo- ou diminuição das hormonas da contraregulação, como o cortisol ou a hormona do crescimento). O consumo de álcool pode causar
hipoglicémia devido ao efeito inibitório dos metabolitos do etanol sobre o ciclo de Krebs, a
gluconeogénese e a oxidação dos ácidos gordos, particularmente nas crianças (por excesso de
NADH/NAD+).
A.2. Glicosúria
Normalmente, não se verifica a presença de glucose na urina. A glucose tem dimensões
pequenas e é hidrossolúvel, pelo que a sua concentração no filtrado glomerular é igual à do
plasma. Para concentrações até 180-200mg/dl (limiar renal para a glucose), toda a glucose
filtrada é reabsorvida no túbulo contornado proximal. Para concentrações superiores, que
ultrapassem a capacidade de reabsorção tubular, surge glucosúria: glucosúria por
hiperglicémia. Em caso de lesão tubular renal proximal pode verificar-se glucosúria, mesmo
com valores de glicémia normais, por incapacidade de reabsorção da glucose filtrada no
glomérulo: glucosúria de causa renal.
Em qualquer circunstância, a glucose, pelo seu efeito osmótico, arrasta grandes volumes de
água, aumentando assim o débito urinário -poliúria- com risco de desidratação.
Na prática clínica, a determinação da glicosuria faz-se em dois grupos de circunstâncias:
Suspeita de glicosúria secundária à hiperglicémia
- Diabetes mellitus: à hiperglicémia associa-se glucosúria e cetonúria. A análise da urina é
frequentemente o primeiro teste a apontar o diagnóstico. A glucosúria não é actualmente
3
usada no controlo do doente diabético, uma vez que só surge quando é ultrapassado o limiar
renal para a glucose (o objectivo do controlo é a manutenção da glicémia em valores próximos
do normal) e, por outro lado, porque aquele limiar apresenta grande variação individual. Para
esse efeito, usa-se a determinação da glicémia capilar ao longo do dia.
- Hiperglicémia de outras causas: nomeadamente durante a administração de soros
intravenosos com concentração elevada de glucose.
Suspeita de lesão tubular renal proximal:
- À glicosúria associa-se aumento da excreção urinária de outras substâncias normalmente aí
reabsorvidas, com os aminoácidos, o bicarbonato, o fósforo e o ácido úrico.
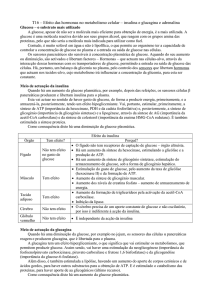
B. CORPOS CETÓNICOS
A designação “corpos cetónicos” engloba 3 compostos: acetoacetato, β-hidroxibutirato e
acetona.
O acetoacetato e o β-hidroxibutirato são moléculas hidrossolúveis formadas no fígado e
utilizadas por outros orgãos como uma importante fonte de energia. São ácidos, conduzindo à
cetoacidose, quando em excesso no sangue circulante.
Os corpos cetónicos são produzidos a partir de acetil-CoA, resultante da β-oxidação dos
ácidos gordos que ocorre em condições de jejum prolongado (fome) ou na Diabetes Mellitus.
Assim, a nível hepático, forma-se acetoacetato e D-3-hidroxibutirato (β-hidroxibutirato). A
descarboxilação espontânea do acetoacetato gera acetona. Acetoacetato e β-hidroxibutirato
são interconvertidos pela enzima mitocondrial D-3-hidroxibutirato desidrogenase, num
equilíbrio que depende do estado redox da célula, i.e., da razão NAD+/NADH. No sangue, a
razão [β-hidroxibutirato]/[acetoacetato] varia numa proporção de 1:1 a 10:1. A concentração
total de corpos cetónicos no sangue de animais bem-nutridos não excede 0,2 mmol/L. A perda
na urina é normalmente menor que 1mg/24h nos humanos.
Os corpos cetónicos são oxidados nos tecidos extra-hepáticos, com resultante formação de
ATP, proporcional à sua concentração no sangue, até cerca de 12 mmol/L. A ocorrência de
cetonémia está geralmente associada a um aumento da produção de corpos cetónicos pelo
fígado, mas experiências em ratos aos quais foi removido o pâncreas demonstraram que a
cetonémia associada à Diabetes Mellitus pode aumentar também devido a uma redução na
capacidade de catabolismo dos corpos cetónicos. Se, por um lado, o acetoacetato e o β-
4
hidroxibutirato são facilmente oxidados pelos tecidos extrahepáticos, a acetona é dificilmente
oxidada, sendo volatilizada ao nível dos pulmões, o que explica o hálito cetónico
característico das situações de hipercetonémia.
2 AcetilCoA
Acetoacetil-CoA sintetase
AcetoacetilCoA
HMG-CoA sintetase
Formação dos corpos
cetónicos (fígado)
β-Hidroxi-β-metilglutaril-CoA (HMG-CoA)
HMG-CoA liase
Acetoacetato
+
NADH+H
NAD+
β-hidroxibutirato
CO2
Acetona (propanona)
Metabolismo dos corpos cetónicos (fígado, sangue e tecidos periféricos):
Fígado
Sangue
Acil-CoA
Tecidos
Extrahepáticos
FFA
Acil-CoA
Glucose
URINA
Glucose
AcetilCoA
Corpos
cetónicos
Ciclo de
Krebs
AcetilCoA
Corpos cetónicos
Corpos
cetónicos
Acetona
PULMÕES
5
Ciclo de
Krebs
Determinação da concentração plasmática de corpos cetónicos (quantificase o β-hidroxibutirato)
Fundamento do método enzimático (espectrofotométrico):
Por acção da enzima 3-hidroxibutirato desidrogenase (3-HBDH), o D-3-hidroxibutirato
(ácido D-3-hidroxibutírico) é oxidado a acetoacetato pelo NAD+ (nicotinamida adenina
dinucleótido), formando-se NADH. A formação de NADH, que é directamente proporcional à
concentração de β-hidroxibutirato presente na amostra inicial, é seguida pelo aumento da
absorvância a 340 nm.
3-Hidroxibutirato desidrogenase
D-3-hidroxibutirato + NAD+
Acetoacetato + NADH + H+
6