INTRODUÇÃO AOS
PROCESSOS METALÚRGICOS
Prof. Carlos Falcão Jr.
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2. PROCESSOS HIDROMETALÚRGICOS
• Ocorrem na interface entre as fases sólida e
líquida
• Temperaturas entre 10 e 300ºC
• São divididos em diferentes tipos:
2.1) Lixiviação
2.2) Refino
impurezas
de
soluções
p/
eliminar
2.3) Precipitação de metal elementar a
partir de soluções
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.1) Lixiviação
•
Técnica que permite a transferência de um
metal, contido em um minério, para a solução,
seguida pela separação posterior da ganga
• Os solventes usados são:
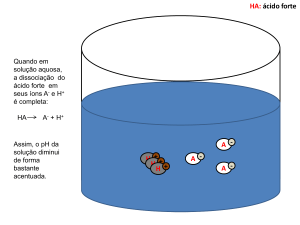
soluções de ácidos
soluções de bases
soluções de sais
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.1) Lixiviação
•
Exemplo: lixiviação do óxido de zinco de um
concentrado de zinco ustulado por meio de uma
solução de ácido sulfúrico, seguida por
separação de resíduos insolúveis (“cakes” –
massa de pó não compactada) através de
sedimentação e filtração
(ZnO+Fe2O3+SiO2)sol + H2SO4 → ZnSO4 +
concentrado de zinco ustulado
(Fe2O3+SiO2)sol
“cake”
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.2) Refino de soluções p/ eliminar impurezas
• As soluções podem conter, junto ao metal, um
número de impurezas que permanecem no
processo de lixiviação.
• As técnicas para refino de soluções são:
2.2.1) Precipitação com aditivos
2.2.2) Extração com solventes orgânicos
2.2.3) Processos de adsorção ou troca iônica
usando trocadores de íons (resinas sintéticas)
2.2.4) Cristalização
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.2) Refino de soluções das impurezas
2.2.1) Precipitação com aditivos
• Exemplo: precipitação de impurezas de ferro
com formação de sulfato de zinco, utilizando
óxido de zinco (aditivo).
Fe2(SO4)3 + ZnO + H2O → Fe(OH)3 + ZnSO4
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.2) Refino de soluções das impurezas
2.2.2) Extração com solventes orgânicos
• Alguns solventes orgânicos tem a capacidade
de dissolver e formar compostos complexos
com sais de alguns metais, não formando sais
de outros metais, nem dissolvendo-os.
• Exemplo: extração de nitrato de uranila com
ajuda do tributilfosfato
UO2(NO3)2 + 2TBPh → UO2.2NO3.2TBPh
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.2) Refino de soluções das impurezas
2.2.3) Processos de adsorção ou troca iônica
usando trocadores de íons (resinas sintéticas)
• Resinas tem a capacidade de trocar seus íons
constituintes H+ por alguns cátions contidos em
solução.
• Exemplo: extração de urânio de soluções por
meio de resinas de troca iônica
UO2SO4 + 2 trocador de cátion HR → UO2R2 +
H2SO4
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.2) Refino de soluções das impurezas
2.2.4) Cristalização
• Geralmente, é fracional, ou seja, é repetida
muitas vezes.
• Na parte final de um sistema de cristalizadores,
obtém-se cristais puros de um sal metálico,
além de uma solução do contaminante.
• Exemplo: separação por cristalização de oxifluoretos de zircônio e háfnio é baseada em
suas diferentes solubilidades em água.
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.3) Precipitação de metal elementar a partir de
soluções
• Uma das seguintes técnicas é aplicável:
2.3.1) precipitação eletrolítica a partir de soluções
aquosas
2.3.2) cementação ou deslocamento de um metal
de uma solução por outro metal
2.3.3) redução por meio de agentes redutores
gasosos (H2, CO, CH4) ou sólidos, sob pressão
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
• Estes processos não cobrem todas as técnicas
empregadas nos trabalhos metalúrgicos.
• Existem outros estágios de produção, que não
envolvem reações químicas, mas possuem
extrema importância.
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
• Estes são chamados de estágios auxiliares:
a)Manuseio de produtos (sólidos, líquidos e
gasosos)
b)Mistura de produtos sólidos com outros líquidos
ou de sólidos com sólidos
c) Secagem de materiais
d)Briquetagem e)Evaporação de soluções
f) Coleta de poeira
g)Detenção de gases nocivos ou de valor etc
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
TEORIA BÁSICA DA USTULAÇÃO
MINÉRIOS E CONCENTRADOS
DE
1. Pressões de Dissociação de Carbonatos e
Hidratos e Condições para a Decomposição
destes na Ustulação
1.1 Calcinação de carbonatos
• Baseia-se na dissociação de carbonatos
• Exemplo: calcinação do calcário
CaCO3sol ↔ CaOsol + CO2
Kp = pCO2
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
1.1 Calcinação de carbonatos
CaCO3sol ↔ CaOsol + CO2
Kp = pCO2
• Reação procede: razão da pressão de CO2 no
meio circundante (p’CO2) pela pressão de
equilíbrio (pCO2)
• Quando:
(p’CO2) < (pCO2) → ocorre dissociação
(p’CO2) > (pCO2) → carbonato é formado
(p’CO2) = (pCO2) → existe equilíbrio
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
1.1 Calcinação de carbonatos
• Figura 152 – Relação entre a pressão de
equilíbrio ou pressão de dissociação p CO2 e a
temperatura para carbonatos de vários metais.
• Figura 153 – Energias livres de formação de
carbonatos do tipo MeO e CO2.
• Conclusões:
carbonatos de
são instáveis
carbonatos de
terrosos →
temperaturas
metais pesados não-ferrosos
quando comparados aos
metais alcalinos e alcalinodecomposição a baixas
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
1.1 Calcinação de carbonatos
• Conclusões:
pCO2 varia com a mudança no raio iônico,
como nos metais do grupo 2 → função
periódica da localização dos elementos
químicos na TP
> raio iônico; > pCO2
• Na indústria:
Cal é obtida pela calcinação do calcário no
forno de chaminé aquecido por coque
pCO2 = 1 atm e p’CO2 = 0,2 atm, em 910ºC
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
1.2 Calcinação de Hidratos
Me(OH)2 ↔ MeO + H2O
Kp = pH2O
• Reação procede: razão da pressão de no meio
circundante (p’H2O) pela pressão de equilíbrio
(pH2O)
• pH2O na dissociação de um hidrato, numa dada
temperatura → pressão de dissociação do
hidrato
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
1.2 Calcinação de Hidratos
• Tabela pág. 335: Calores de formação dos
hidratos a partir de MeO e H2O.
• Compostos mais estáveis → hidratos de metais
alcalinos e alcalino-terrrosos
• A decomposição de hidratos, ou melhor,
hidróxidos de alumínio se dá em forno rotatório
• Al(OH)3 se dissocia em etapas, formando
hidróxidos, progressivamente, com menores
número de moléculas de água e pH2O :
Al2O3.3H2O → Al2O3.H2O → γ-Al2O3 → α-Al2O3
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
1.2 Calcinação de Hidratos
• Objetivo:
Obter
alumina
anidra
com,
aproximadamente, 70% γ-Al2O3 e 30% α-Al2O3
• Logo, a temperatura no forno deve ser elevada
a 1200º C.
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
TEORIA BÁSICA DA USTULAÇÃO
MINÉRIOS E CONCENTRADOS
DE
2.Condições para Ustulação Oxidante de Minérios
e Concentrados de Sulfetos
• Baseia-se na seguinte reação:
MeS + 1,5O2 ↔ MeO + SO2
• Faixa de temperatura: 500-1000ºC
• Na presença de ar
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.Condições para Ustulação Oxidante de Minérios
e Concentrados de Sulfetos
• Além da formação de óxidos, sulfatos metálicos
(ustulação sulfatante) também são formados, de
acordo com a reação:
MeS + 2O2 ↔ MeSO4
• Fornos de ustulação atuais → ustulador “fluidbed” (leito de fluido) - Figura 154
• Ar entra pelas aberturas da parte de baixo do
forno
• Acima, entra o concentrado de sulfeto metálico
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
2.Condições para Ustulação Oxidante de Minérios
e Concentrados de Sulfetos
• Os subprodutos gasosos, contendo SO2,
escapam pela abertura na parte superior do
forno
• Uma haste vertical localizada no centro do forno
movimenta o concentrado das laterais para o
centro e vice-versa
• Vantagem: dispensa o uso de combustíveis
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
TEORIA BÁSICA DA USTULAÇÃO
MINÉRIOS E CONCENTRADOS
DE
3.Ponto de Ignição (ou Inflamação) de Sulfetos
• Sulfetos inflamam em altas taxas de oxidação
• Resultam num excelente progresso da reação
• Dispensando o consumo de combustível
• Condição para ignição de um sulfeto → alto
valor de calor liberado por unidade de tempo
• Ponto de ignição de um sulfeto → temperatura
da sua combustão autógena no ar, sem
aplicação de fonte externa de calor
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
3.Ponto de Ignição (ou Inflamação) de Sulfetos
• Valores de pontos de ignição dos sulfetos
variam em função de alguns fatores:
aumenta com sua capacidade calorífica
aumenta com a compactação do sulfeto e de
seus produtos de combustão
diminui com o aumento do seu poder
calorífico
diminui com a diminuição do tamanho e da
compactação das partículas do sulfeto
• Tabela XIII – pág. 337
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
3.Ponto de Ignição (ou Inflamação) de Sulfetos
• Sulfetos de chumbo e de zinco são menos
inflamáveis que os de ferro e de cobre
• Os valores dos pontos de ignição dos mesmos
sulfetos (pirita e esfalerita) praticamente não são
afetados pela variação de tamanho das
partículas de 0,2 a 2 mm.
• Obs: Ponto de ignição de um sulfeto é
dependente do conteúdo da mistura e das
concentrações de gases (O2 e SO2) no forno.
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
TEORIA BÁSICA DA USTULAÇÃO
MINÉRIOS E CONCENTRADOS
DE
4.Condições para Formação e Dissociação de
Sulfatos Metálicos
• Sulfetos oxidam também a baixas temperaturas,
inclusive à temperatura ambiente
• Minérios de sulfeto oxidam a sulfato, logo que
são extraídos (mineração)
• A reação de oxidação é:
MeS + 2O2 ↔ MeSO4
• Também se dá a altas temperaturas (autoclave)
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
4.Condições para Formação e Dissociação de
Sulfatos Metálicos
• Sob aquecimento, sulfatos podem se decompor
conforme a seguinte reação de dissociação:
MeSO4sol ↔ MeOsol + SO3
Kp = pSO3
• Reação procede: razão da pressão de SO3 no
meio circundante (p’SO3) pela pressão de
equilíbrio (pSO3)
• pSO3 na dissociação de um sulfato, numa dada
temperatura → pressão de dissociação do
sulfato
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
4.Condições para Formação e Dissociação de
Sulfatos Metálicos
• Quando:
(p’SO3) < (pSO3) → ocorre dissociação
(p’SO3) > (pSO3) → sulfato é formado
(p’SO3) = (pSO3) → existe equilíbrio
• Figura 155 – pág. 338 – pSO3 de vários metais
em função da temperatura
• Figura 156 – pág. 339 – potenciais
termodinâmicos de formação dos sulfatos a
partir de MeO e SO
INTRODUÇÃO AOS PROCESSOS METALÚRGICOS
4.Condições para Formação e Dissociação de
Sulfatos Metálicos
• Sulfatos mais estáveis – de metais alcalinos e
alcalino-terrosos
• Sulfatos menos estáveis – de metais pesados
não-ferrosos