OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
CLASSIFICAÇÃO
OLIMPÍADA MINEIRA DE QUIMICA 2011 – MODALIDADE A
1ª SÉRIE ENSINO MÉDIO
RELAÇÃO DE ALUNOS(AS)
1º- JOÃO VITOR MONTEIRO CRUVINEL
2º - ELOY XAVIER GUIMARÃES PEREIRA
3º- LUCAS AKIRA ITO
4º - CLARKSON CASTRO SILVA
5º- FERNANDA CRISTINA DA SLIVA MACHADO
6º- LARA DE ARAÚJO
7º- LUIS FELIPE NAVES DE CASTRO SALLES
8º- ISADORA LYRIO STÁBILLE
9º - ANSELMO EMÍLIO TOMAIN
10º- MATHEUS NAGAI RIBEIRO DO VAL
11º- LUIS GUSTAVO CUNHA
12º- MAÍSA BEATRIZ DA SILVA
13º - BERNARDO ARAÚJO FERREIRA
14º- GABRIEL DE G. ARAÚJO LOPES
15º- VINÍCIUS DORNFELD DOS . CAMILO
16º- NATÁLIA AGUIAR QUEIROZ
17º- HEITOR FERNANDO SCUSSEL CAMPOS
18º- REBECCA LUIZA ARAÚJO
19º- FREDERICO VENANCIO DE SENNE
20º - AMANDA FERREIRA ESTEPHAN
21º- LORENA RANY SILVA SOARES
22º- FREDERICO AUGUSTO DE OLIVEIRA
ACERTOS DESEMPATE
87%
84%
83%
77%
71%
71%
71%
70%
68,5%
62,5%
62,4%
61,5%
60%
57%
56,5%
56,5%
56%
55,5%
53%
52%
52%
52%
79,16%
66,66%
33,33%
75%
0%
66,66%
45%
41,66%
OS ALUNOS(AS) ACIMA RELACIONADOS ESTÃO CONVOCADOS PARA AS AULAS DE
LABORATÓRIO – TREINAMENTO E APROFUNDAMENTO PARA A 2ª FASE.
FICAM OS CINCO PRIMEIROS IMEDIATAMENTE INSCRITOS PARA REPRESENTAR O
COLÉGIO CENECISTA DR JOSÉ FERREIRA NA 2ª FASE DA OLIMPÍADA, DIA 22 DE
OUTUBRO, UFMG – BH
EM CASO DE DESISTÊNCIA, FICA AUTOMATICAMENTE CONVOCADO O SEGUINTE NA
LISTA DE CLASSIFICAÇÃO
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
CLASSIFICAÇÃO
OLIMPÍADA MINEIRA DE QUIMICA 2011 – MODALIDADE B
2ª SÉRIE ENSINO MÉDIO
RELAÇÃO DE ALUNOS(AS)
1º - LUCAS ALVES BESSA CARDOSO
2 º- TIAGO LUCAS TADEU CARVALHO CASTRO
3º - ISABELA MAREGA DE SOUSA
4º - THAMIRES TEOBALDO DA SILVA
5º - MÁRCUS OTÁVIO S. C. MENÊSES
6º - ISABELLA BORGES SANTOS
7º - MARCOS LUIZ FERREIRA GOMES
8º - GABRIEL JORGE JARDIM
9º - FELIPE MATOS VIDAL
10º- HANNAH MARIA DE CASTRO PRIMO
11º- MARCELO CARVALHO BORGES DE MORAIS
12º- JOÃO HERCOS NETO
ACERTOS DESEMPATE
85%
75%
75%
75%
70%
70%
65%
65%
65%
65%
60%
60%
58,5%
50%
33,3%
58,5%
33,3%
66,6%
33,3%
25%
16,7%
66%
0%
OS ALUNOS(AS) ACIMA RELACIONADOS ESTÃO CONVOCADOS PARA AS
AULAS DE LABORATÓRIO – TREINAMENTO E APROFUNDAMENTO PARA
A 2ª FASE.
FICAM OS CINCO PRIMEIROS IMEDIATAMENTE INSCRITOS PARA
REPRESENTAR O COLÉGIO CENECISTA DR JOSÉ FERREIRA NA 2ª FASE DA
OLIMPÍADA, DIA 22 DE OUTUBRO, UFMG – BH
EM CASO DE DESISTÊNCIA, FICA AUTOMATICAMENTE CONVOCADO O
SEGUINTE NA LISTA DE CLASSIFICAÇÃO
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
NOTA
Questões objetivas:
NOME:...................................................................
.........................................
Acertos
.................................................................................
Questões discursivas
1°Ano........... Sala .............................................
Telefones para contato......................................
.....................................................
Total: .........................................
............................................................................
GABARITO
1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
A X
B X
C X
D X
E X
Questão 1 respondida na própria prova, não é necessário passar para o
gabarito.
Questões Objetivas
Questão 01)
As técnicas de separação dos componentes de uma mistura baseiam-se
nas propriedades físico-químicas desses componentes. Assim,
considerando os sistemas, apresentados abaixo, associe as misturas às
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
figuras que representam os equipamentos adequados a suas separações,
bem como às propriedades físico-químicas responsáveis pela utilização da
técnica. Justifique suas escolhas.
Sistema
a) Água e sulfato de bário
b) Água e tetracloreto de carbono
c) Água e etanol
Propriedade
1) Temperatura de ebulição
2) Solubilidade
3) Densidade
S( ) P( )
S( )
S( )
P( )
P( )
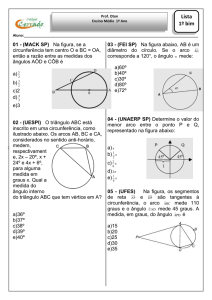
Questão 02)
Associe corretamente as duas colunas.
I. Frasco de Kitassato
II. Funil de separação
III. Proveta
IV. Mufla
V. Pinça de Mhor
(A)
(B)
É utilizada para medir volumes aproximados de líquidos
É utilizada para medir a passagem de gases através de tubos de
borracha
(C)
É utilizada para medir volumes precisos de líquidos
(D) É utilizado para separação de líquidos imiscíveis.
(E)
É utilizado para prender tubos de ensaio
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
(F)
(G)
(H)
É utilizado em filtração a vácuo.
É utilizada quando se pretende calcinar substâncias.
É utilizado na preparação de líquidos após a decantação
A associação correta é:
a) I-A; II-C; III-H; IV-G; V-E.
b) I-B; II-D; III-A; IV-G; V-H.
c) I-B; II-D; III-A; IV-C; V-E.
d) I-H; II-D; III-C; IV-G; V-E.
e) I-B; II-D; III-A; IV-G; V-E.
Questão 03)
Na perfuração de uma jazida petrolífera, a pressão dos gases faz com que
o petróleo jorre para fora. Ao reduzir-se a pressão, o petróleo bruto pára de
jorrar e tem de ser bombeado. Devido às impurezas que o petróleo bruto
contém, ele é submetido a dois processos mecânicos de purificação, antes
do refino: separá-lo da água salgada e separá-lo de impurezas sólidas
como areia e argila. Esses processos mecânicos de purificação são,
respectivamente,
a)
b)
c)
d)
e)
decantação e filtração.
decantação e destilação fracionada.
filtração e destilação fracionada.
filtração e decantação.
destilação fracionada e decantação.
Questão 04)
Abaixo, está esquematizado o fluxograma relativo à separação dos
componentes de uma mistura constituída por azeite, água e açúcar
totalmente dissolvido.
Examinado o fluxograma apresentado, você identifica os processos 1 e 2
como sendo, respectivamente:
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
a)
b)
c)
d)
e)
destilação e filtração.
filtração e decantação.
decantação e destilação
decantação e centrifugação
filtração e centrifugação
Questão 05)
Um átomo de hidrogênio com o elétron inicialmente no estado fundamental
é excitado para um estado com número quântico principal (n) igual a 3. Em
correlação a este fato qual das opções abaixo é a CORRETA?
a) Este estado excitado é o primeiro estado excitado permitido para o
átomo de hidrogênio.
b) A distância média do elétron ao núcleo será menor no estado excitado
do que no estado fundamental.
c) Será necessário fornecer mais energia para ionizar o átomo a partir
deste estado excitado do que para ionizá-lo a partir do estado
fundamental.
d) A energia necessária para excitar um elétron do estado com n = 3 para
um estado n = 5 é a mesma para excitá-lo do estado com n = 1 para um
estado com n = 3.
e) O comprimento de onda da radiação emitida quando este elétron
retornar para o estado fundamental será igual ao comprimento de onda
da radiação absorvida para ele ir do estado fundamental para o estado
excitado.
Questão 06)
Os sais de Cr6+ são em geral, solúveis no pH biológico e, portanto, têm fácil
penetração. Daí a sua toxicidade para os serres humanos. Por outro lado,
os compostos de Cr3+ são pouco solúveis nesse pH, o que resulta em
dificuldade de passar para o interior das células. Indique a opção que
corresponde á configuração eletrônica do íon Cr3+.
Dado: [Ar] argônio (Z = 18)
a) [Ar] 4s2 3d1
b) [Ar] 3d2
c) [Ar] 3d3
d) [Ar] 4s2 3d4
e) [Ar] 4s1 3d5
Questão 07)
A figura abaixo foi proposta por um ilustrador para representar um átomo de
lítio (Li) no estado fundamental, segundo o modelo de Rutherford-Bohr.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Elétron
Nêutron
Próton
Constatamos que a figura está incorreta em relação ao número de:
a) nêutrons no núcleo
b) partículas no núcleo
c) elétrons por camada
d) partículas na eletrosfera
Questão 08)
Ao resumir as características de cada um dos sucessivos modelos do
átomo de hidrogênio, um estudante elaborou as seguintes definições:
Modelo Atômico: Dalton. Características: Átomos maciços e indivisíveis.
Modelo Atômico: Thomson. Características: Elétron, de carga negativa,
incrustado em uma esfera de carga positiva. A carga positiva está
distribuída, homogeneamente, por toda a esfera.
Modelo Atômico: Rutherford. Características: Elétron, de carga negativa, em
órbita em torno de um núcleo central, de carga positiva. Não há restrição
quanto aos valores dos raios das órbitas e das energias do elétron.
Modelo Atômico: Bohr. Características: Elétron, de carga negativa, em
órbita em torno de um núcleo central, de carga positiva. Apenas certos
valores dos raios das órbitas e das energias do elétron são possíveis.
O número de ERROS cometidos pelo estudante é
a) 0
b) 1
c) 2
d) 3
Questão 09)
No fim do século XIX, Thomson realizou experimentos em tubos de vidro
que continham gases a baixas pressões, em que aplicava uma grande
diferença de potencial. Isso provocava a emissão de raios catódicos. Esses
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
raios, produzidos num cátodo metálico, deslocavam-se em direção à
extremidade do tubo (E). (Na figura, essa trajetória é representada pela
linha tracejada X.)
Nesses experimentos, Thomson observou que
I) a razão entre a carga e a massa dos raios catódicos era independente
da natureza do metal constituinte do cátodo ou do gás existente no tubo;
e
II) os raios catódicos, ao passarem entre duas placas carregadas, com
cargas de sinal contrário, se desviavam na direção da placa positiva.
(Na figura, esse desvio é representado pela linha tracejada Y.)
Considerando-se essas observações, é CORRETO afirmar que os raios
catódicos são constituídos de
a) elétrons.
b) ânions.
c) prótons.
d) cátions.
e) neutron
Questão 10)
A primitiva noção de átomo surge na Grécia antiga, a partir de Demócrito,
Leucipo e Epicuro; avança até o século XX enriquecida com outras idéias
que ajudaram a desenhar o modelo atômico atual. Na Coluna I, a seguir,
estão listadas algumas contribuições para que se chegasse ao modelo atual
de átomo e na Coluna II, os nomes de seus autores.
Numere a Coluna II de acordo com a Coluna I, associando cada
contribuição a seu autor.
Coluna I
1. Descoberta do elétron
2. Descoberta do núcleo e da eletrosfera
3. Descoberta dos níveis de energia dos átomos
4. Princípio da incerteza
5. Regra da máxima multiplicidade
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Coluna II
( ) Rutherford
( ) Thomson
( ) Hund
( ) Bohr
( ) Heisenberg
Assinale a opção contendo a sequência correta, de cima para baixo.
a)
b)
c)
d)
1, 5, 2, 4, 3
2, 4, 1, 3, 5
2, 1, 5, 4, 3
2, 1, 5, 3, 4
Questão 11)
Em um bate-papo na Internet, cinco estudantes de química decidiram não
revelar seus nomes, mas apenas as duas primeiras letras, por meio de
símbolos de elementos químicos. Nas mensagens, descreveram algumas
características desses elementos.
– É produzido, a partir da bauxita, por um processo que consome muita
energia elétrica. Entretanto, parte do que é produzido, após utilização, é
reciclado.
– É o principal constituinte do aço. Reage com água e oxigênio, formando
um óxido hidratado.
– É o segundo elemento mais abundante na crosta terrestre.
Na forma de óxido, está presente na areia. É empregado em componentes
de computadores.
– Reage com água, desprendendo hidrogênio. Combina-se com cloro,
formando o principal constituinte do sal de cozinha.
– Na forma de cátion, compõe o mármore e a cal.
Os nomes dos estudantes, na ordem em que estão apresentadas as
mensagens, podem ser:
a) Silvana, Carlos, Alberto, Nair, Fernando.
b) Alberto, Fernando, Silvana, Nair, Carlos.
c) Silvana, Carlos, Alberto, Fernando, Nair.
d) Nair, Alberto, Fernando, Silvana, Carlos.
e) Alberto, Fernando, Silvana, Carlos, Nair.
Questão 12)
Cinco amigos resolveram usar a tabela periódica como tabuleiro para um
jogo. Regras do jogo: Para todos os jogadores, sorteia-se o nome de um
objeto, cujo constituinte principal é determinado elemento químico. Cada um
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
joga quatro vezes um dado e, a cada jogada, move sua peça somente ao
longo de um grupo ou de um período, de acordo com o número de pontos
obtidos no dado. O início da contagem é pelo elemento de número atômico
1. Numa partida, o objeto sorteado foi “latinha de refrigerante” e os pontos
obtidos com os dados foram: Ana (3,2,6,5), Bruno (5,4,3,5), Célia (2,3,5,5),
Décio (3,1,5,1) e Elza (4,6,6,1).
H
Li Be
B C N
Na Mg
Al Si P
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi
Fr Ra Ac
He
O F Ne
S Cl Ar
Se Br Kr
Te I Xe
Po At Ra
Assim, quem conseguiu alcançar o elemento procurado foi:
a) Ana
b) Bruno
c) Célia
d) Décio
e) Elza
Questão 13)
Indique, entre as alternativas abaixo, aquela em que são feitas
exclusivamente afirmações corretas sobre os elementos cujas
configurações eletrônicas são dadas a seguir:
Elemento
1
2
3
4
Configuração
1s22s22p63s1
1s22s22p4
1s22s22p63s23p64s2
1s22s22p63s23p6
a) o elemento 3 é um gás nobre e o elemento 2 é um halogênio
b) os elementos 2 e 4 situam, respectivamente, no segundo e terceiro
períodos da Classificação Periódica
c) o elemento 4 situa-se no terceiro Período da Classificação Periódica e é
um metal alcalino terroso
d) o elemento 3 é um elemento de transição e o elemento 4 é um actinídeo
e) o elemento 1 é um metal alcalino terroso e o elemento 2 situa-se no
mesmo grupo do Nitrogênio(5A) na Classificação Periódica.
Questão 14)
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Considere as seguintes informações, relativas aos elementos genéricos “X”,
“Y” e “Z”.
I. “X” está localizado no grupo dos metais alcalinos terrosos e no 4º
período da tabela periódica.
II. “Y” é um halogênio e apresenta número atômico 35.
III. “Z” é um gás nobre que apresenta um próton a mais que o elemento “Y”.
a)
b)
c)
d)
e)
A análise das afirmativas permite concluir corretamente que:
“X” é mais eletronegativo que “Y”.
“Y” apresenta ponto de ebulição maior que “X”.
“Z” apresenta grande capacidade de se combinar com “Y”.
“X”, “Y” e “Z” apresentam propriedades químicas semelhantes.
“Z” tem maior potencial de ionização do que “X” ou “Y”.
Questão 15)
Ao se adicionar sódio metálico em água, ocorre reação deste com a água,
com liberação de gás hidrogênio (H2), conforme representada pela
equação:
Na0 (s) + H2O (l) NaOH (aq) + 1/2H2 (g)
O fenômeno descrito pode ser classificado como:
a) físico, porque ocorre a dissolução do sódio metálico.
b) químico, porque ocorre a formação de íons Na + em solução e
desprendimento de gás hidrogênio.
c) físico, porque evaporando-se a água, pode-se recuperar o sódio
metálico.
d) físico e químico, porque alterou a estrutura do sódio metálico e produziu
hidrogênio a partir da água líquida.
e) físico, porque não alterou as propriedades físicas do sódio metálico.
Questão 16)
A seguinte tabela envolve exemplos de processos e suas respectivas
transformações. Alguns estão corretos:
PROCESSO
TIPO DE TRANSFORMAÇÕES
I. Oxidação do ferro................................. Física
II. Ebulição da água................................... Física
III. Combustão do enxofre ao ar................. Química
IV. Lapidação do diamante......................... Química
V. Fusão do chumbo.................................. Física
Os itens corretos são:
a) I, IV e V
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
b)
c)
d)
e)
II, III e IV
II, IV e V
III, IV e V
II, III e V
Questão 17)
A água potável de boa qualidade é fundamental para a saúde e o bem estar
humano. Entretanto, a maioria da população mundial ainda não tem acesso
a este bem essencial. Mais do que isto, existem estudos que apontam para
uma escassez cada vez mais acentuada de água para a produção de
alimentos, desenvolvimento econômico e proteção de ecossistemas
naturais. Para exercer tais atividades, especialistas estimam que o consumo
mínimo de água per capita deva ser de pelo menos 1000 m3 por ano. Cerca
de 30 países, em sua maioria localizados no continente africano, já se
encontram abaixo deste valor. Com o rápido crescimento populacional,
acredita-se que inúmeras outras localidades deverão atingir esta categoria
no futuro próximo. Várias regiões do planeta (Pequim, Cidade do México,
Nova Deli e Recife, no Brasil) estão acima desse valor devido à exploração
de águas subterrâneas (NEBEL WRIGHT, Environmental Science, 2000).
A figura a seguir representa o ciclo hidrológico na terra. Nela estão
representados processos naturais que a água sofre em seu ciclo. (adaptado
de Qnes Ed. especial – Maio 2001- Cadernos Temáticos).
NÃO ESTÁ CORRETO o que se afirma em:
a) Considerando que as nuvens são formadas por minúsculas gotículas de
água, as mudanças de estado físico que ocorrem nos processos 1 e 2
são evaporação e condensação, respectivamente.
b) Quando o processo 1 está ocorrendo, o principal tipo de ligação que
está sendo rompido é a ligação de hidrogênio.
c) Os processos de evaporação das águas oceânicas (1) e da precipitação
(4), onde ocorrem rompimentos de ligações covalentes, são os principais
responsáveis pela reposição da água doce encontrada no planeta.
d) As plantas participam do ciclo hidrológico pelo processo 3, que
corresponde à transpiração, processo bastante intenso na região da
Amazônia brasileira.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
e) Em regiões rochosas, durante o processo de infiltração, sais de cálcio e
magnésio são dissolvidos na água; esta característica leva à
denominação de água dura.
Questão 18)
Seathl, chefe indígena americano, em seu famoso discurso, discorre a
respeito dos sentimentos e dos cuidados que o homem branco deveria ter
para com a Terra, à semelhança com os índios, ao se assenhorear das
novas regiões. E ao final, diz: “Nunca esqueças como era a terra quando
dela tomas-te posse. Conserva-a para os teus filhos e ama-a como Deus
nos ama a todos. Uma coisa sabemos: o nosso Deus é o mesmo Deus.
Nem mesmo o homem branco pode evitar nosso destino comum”.
O discurso adaptado, publicado na revista Norsk Natur, Oslo em 1974,
nunca esteve tão atual. O homem, procurando tornar sua vida mais
“confortável”, vem destruindo e contaminando tudo ao seu redor, sem se
preocupar com os efeitos desastrosos posteriores.
Esses efeitos podem ser causados por
I. liberação desenfreada de gases estufa.
II. destruição da camada de ozônio.
III. uso descontrolado de agrotóxicos e inseticidas.
IV. desmatamento e queimadas.
É correto afirmar que contribuem para o agravamento dos problemas as
causas citadas em
a)
b)
c)
d)
e)
I, II e III, apenas.
II e III, apenas.
I e IV, apenas.
I, II, III e IV.
II e IV, apenas.
Questão 19)
As ligações químicas predominantes entre os átomos dos compostos HI,
NH3 e NaCl são. respectivamente:
a) iônica, covalente, iônica
b) covalente, iônica, iônica.
c) iônica, covalente, covalente
d) covalente; covalente, iônica
e) iônica, iônica, covalente.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Questão 20)
Analise as afirmativas a seguir, referentes a alguns metais.
I. Usa-se em utensílios domésticos pela resistência à corrosão, pois
passiva-se em presença do oxigênio.
II. Usa-se na produção de aço, por sua alta resistência à tração.
III. Forma uma liga denominada latão, que serve, quando fundida ao cobre,
para a produção de objetos.
IV. Aplica-se em placas de vidro para a fabricação de espelhos.
Os elementos descritos nas afirmativas são, respectivamente, os metais
a)
b)
c)
d)
e)
alumínio, zinco, estanho e platina.
ferro, alumínio, chumbo e cromo.
níquel, carbono, zinco e prata.
alumínio, ferro, zinco e prata.
ferro, alumínio, estanho e prata.
Questões Discursivas
Questão 21)
Dados os elementos químicos 53M127 e 20X40, indique qual deles apresenta
tendência à formação de cátion e qual deles apresenta tendência à
formação de ânion? Justifique.
Questão 22)
Dalton, na sua teoria atômica, propôs, entre outras hipóteses, que:
a) “os átomos são indivisíveis;
b) “os átomos de um determinado elemento são idênticos em massa”;
Á luz dos conhecimentos atuais, quais são as críticas que podem ser
formuladas a cada uma dessa hipóteses?
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Questão 23)
O íon Sc3+ tem l8 elétrons e é isoeletrônico do íon X3-. Pergunta-se:
a) qual a estrutura eletrônica do átomo de escândio?
b) a que número atômico, família e período da Classificação Periódica
pertence o elemento X?
GABARITO
1) Gab:
a) C e 1. O etanol tem ponto de ebulição menor do que o da água. Desse
modo, a técnica adequada para realizar essa separação é a destilação.
b) A e 2. O sulfato de bário é insolúvel em água, podendo-se separá-lo da
água utilizando-se a técnica da filtração, desse modo, enquanto a água
passa pelo filtro, o sulfato de bário fica retido.
c) B e 3. O tetracloreto de carbono é mais denso do que a água e as
substâncias são imiscíveis. Quando em um funil de separação, o
tetracloreto de carbono vai se depositar abaixo da água e, desse modo,
escoará primeiro, ocorrendo a separação das substâncias.
2) Gab: E
3) Gab: A
4) Gab: C
5) Gab: E
RESOLUÇÃO
Como a energia absorvida para excitar o elétron é a mesma liberada no retorno
ao estado fundamental a partir do excitado, podemos afirmar que os
comprimentos de onda também serão os mesmos.
6) Gab: C
7) Gab: C
8) Gab: A
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
9) Gab: A
10) Gab: D
11) Gab: B
12) Gab: E
13) Gab: B
14) Gab: E
15) Gab: B
16) Gab: E
17) Gab: C
18) Gab: D
19) Gab: D
20) Gab: D
21) Gab: M tem tendência a formar um ânion monovalente (M-), cátion
bivalente (X2+).
22) Gab:
a) não. Os átomos são considerados, atualmente, como partículas divisiveis.
b) não. Os átomos de um mesmo elemento químico são idênticos em número
de prótons.
23) Gab:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d1
b) 15, 5A, terceiro
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
NOTA
Questões objetivas:
NOME:.........................................................
.......................................................................
.............................................Acertos
2°Ano...........
.............................................
Sala
Questões discursivas
Telefones
contato......................................
para
..........................................................
.......................................................................
Total: ..........................................
GABARITO
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
A
B
C
D
E
Questões Objetivas
Questão 01)
Na tabela 1, são apresentados alguns materiais utilizados em laboratórios
de química e, na tabela 2, nomes e/ou utilizações desses materiais.
Tabela 1- Materiais utilizados em laboratórios de química
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Tabela 2- Denominação e utilização de alguns materiais de laboratório
Após correlacionar os dados da tabela 1 com os da tabela 2, assinale a
opção que apresenta a numeração correta.
a) 1-b; 2-a; 3-c; 4-d; 5-e; 6-f.
b) 1-a; 2-b; 3-c; 4-f; 5-d; 6-e.
c) 1-e; 2-a; 3-d; 4-b; 5-c; 6-f.
d) 1-c; 2-f; 3-a; 4-b; 5-d; 6-e.
e) 1-e; 2-a; 3-c; 4-f; 5-b; 6-d.
Questão 02)
Sabendo-se que
- a amônia (NH3) é constituída por moléculas polares e apresenta boa
solubilidade em água.
- o diclorometano (CH2Cl2) não possui isômeros. Sua molécula apresenta
polaridade, devido à sua geometria e à alta eletronegatividade do elemento
Cl.
- o dissulfeto de carbono (CS2) é um solvente apolar de baixa temperatura
de ebulição.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
As fórmulas estruturais que melhor representam essas três substâncias
são, respectivamente,
Cl
a)
S
N
H
H
H
C
C
Cl
H
S
H
Cl
b)
N
H
S
C
H
C
S
H
H
H
Cl
H
c)
Cl
S
N
C
H
H
C
H
Cl
S
H
Cl
d)
N
H
H
H
C
H
S
C
S
Cl
S
C
S
H
Cl
H
e)
Cl
H
N
H
C
H
H
Questão 03)
Descoberto neste ano por pesquisadores alemães, o novo elemento
químico de número atômico 112 poderá ser batizado de “Copernicium”, em
homenagem ao cientista e astrônomo Nicolau Copérnico (1473-1543).
Segundo os cientistas, o novo elemento é aproximadamente 277 vezes
mais pesado que o hidrogênio, o que o torna o elemento mais pesado da
Tabela Periódica, ocupando a posição relativa ao 7 o período do Grupo 12. A
Tabela Periódica, uma das realizações mais notáveis da Química, foi
desenvolvida exclusivamente a partir das propriedades físicas e químicas
dos elementos e, por isso, o conhecimento da posição ocupada por um
elemento químico permite que se façam algumas previsões quanto às suas
propriedades. Considerando a localização dos átomos dos elementos
químicos X, Y e Z na Tabela Periódica:
X = 3 o período do Grupo 1 (I A)
Y = 3 o período da Grupo 16 (VI A)
Z = 2 o período da Grupo 18 (VIII A)
é correto afirmar que:
a) Os estados alotrópicos do elemento Y são diamante, grafita e fulereno.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
b) O elemento X conduz bem a corrente elétrica no estado sólido e forma
um composto iônico quando se combina com o elemento Y.
c) O elemento Z reage violentamente com a água, gerando gás hidrogênio
e uma base de Arrhenius.
d) A combinação entre os elementos X e Y conduz à formação de um
composto molecular.
e) O elemento Z apresenta a maior afinidade eletrônica e,
consequentemente, tende a ganhar elétrons mais facilmente do que os
elementos X e Y.
Questão 04)
Nas festas de Réveillon, o céu fica embelezado pelas cores emitidas pela
queima dos fogos de artifício. A esses fogos são adicionadas substâncias,
cujos átomos emitem radiações de luminosidades diferentes.
Considerando uma explicação para a observação das cores, na queima dos
fogos de artifício, por meio de modelos atômicos propostos no início do
século XX, marque a alternativa INCORRETA.
a) Na emissão de energia, devido à transição de elétrons, encontra-se uma
explicação para a observação das cores dos fogos de artifícios, pois
segundo os estudos de Bohr, o elétron pode emitir ou absorver uma
quantidade definida de energia chamada quantum.
b) Os estudos realizados por Thomson, assim como o modelo atômico
proposto por ele, reconhecem a natureza elétrica da matéria e explicam
a eletrização por atrito, a corrente elétrica, a formação dos íons e as
descargas elétricas em gases. Contudo, o modelo não explica as cores
observadas na queima dos fogos de artifício.
c) Os estudos realizados por Dalton, assim como o modelo atômico
proposto por ele, contribuíram para resgatar as idéias sobre o átomo, ao
proporem que átomos diferentes possuem diferentes pesos atômicos.
No entanto, o peso atômico não é o responsável pela exibição das cores
quando da queima dos fogos de artifícios.
d) De acordo com o modelo de Rutherford-Bohr, as cores produzidas na
queima de fogos são as emissões de energia na forma de luz. Essa
emissão de energia ocorre quando os elétrons excitados dos íons
metálicos, presentes nos fogos de artifícios, retornam para os níveis de
maior energia.
Questão 05)
Em 1913, o físico dinamarquês Niels Bohr mostrou que as leis da Física
Clássica não eram válidas para sistemas microscópicos, tais como o átomo
e suas partículas constituintes. Bohr criou um novo modelo atômico,
fundamentado na teoria dos quanta de Max Planck, estabelecendo alguns
postulados.
Assinale a opção que apresenta corretamente um dos postulados de Bohr.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
a) O elétron pode-se mover em determinadas órbitas sem irradiar. Essas
órbitas estáveis são denominadas “estados estacionários”.
b) É impossível determinar com precisão a posição e a velocidade
instantâneas de uma partícula.
c) Um mesmo orbital não pode ter mais do que dois elétrons. Num orbital
com dois elétrons, um deles tem spin + 1/2 e o outro – 1/2.
d) O elétron ao saltar de um nível de energia interno E 1 para outro mais
externo E2 emite um quantum de energia.
e) Num átomo, não existem dois elétrons com os quatro números quânticos
iguais.
Questão 06)
Ao se adicionar sódio metálico em água, ocorre reação deste com a água,
com liberação de gás hidrogênio (H2), conforme representada pela
equação:
Na0 (s) + H2O (l) NaOH (aq) + 1/2H2 (g)
O fenômeno descrito pode ser classificado como:
a) físico, porque ocorre a dissolução do sódio metálico.
b) químico, porque ocorre a formação de íons Na + em solução e
desprendimento de gás hidrogênio.
c) físico, porque evaporando-se a água, pode-se recuperar o sódio
metálico.
d) físico e químico, porque alterou a estrutura do sódio metálico e produziu
hidrogênio a partir da água líquida.
e) físico, porque não alterou as propriedades físicas do sódio metálico.
Questão 07)
Existem metais que, na forma de compostos, dão colorações características
à chama azul do bico de Bunsen. Essa propriedade é usada em laboratórios
no reconhecimento de metais. Com o calor da chama do bico de Bunsen, os
elétrons dos íons metálicos absorvem energia e saltam para níveis mais
externos e, ao retornarem para os níveis internos, emitem radiações
coloridas típicas de cada metal.
Observe a figura abaixo e assinale a opção correta.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
a) Os elementos Li, Na, Cu, Sr, Ca e Ba, nessa ordem, estão colocados em
ordem crescente de energia de ionização.
b) A configuração eletrônica do Cobre é: [Ar] 4s2 3d10.
c) Elementos Ba, Sr e Ca pertencem ao grupo dos alcalinos terrosos.
d) O elemento de transição interna é o Cu, já que seu subnível de maior
energia é o f.
e) Os elementos Li, Cu, Ba, Sr, Na e Ca, nessa ordem, estão colocados em
ordem crescente de raio atômico.
Questão 08)
As estruturas mineralizadas de alguns animais são formadas principalmente
por íons cálcio, magnésio, carbonatos, fosfatos e sulfatos. Os ossos e os
dentes dos vertebrados, por exemplo, são constituídos principalmente por
fosfato de cálcio. As conchas dos moluscos e os corais são principalmente
de carbonato de cálcio. Os esqueletos dos invertebrados contêm um pouco
de carbonato de magnésio e também já foi encontrado no material
esquelético de um protozoário denominado Acantharia sulfato de estrôncio.
As substâncias citadas no texto são sais inorgânicos representados pelas
fórmulas:
a)
b)
c)
d)
e)
K3PO4, K2CO3, MgCO3 e SnSO3;
K3PO4, K2CO3, MnCO3 e SrSO4 ;
Ca3(PO4)2, CaCO3, MnCO3 e SnSO4 ;
Ca3(PO4)2, CaCO3, MgCO3 e SrSO3 ;
Ca3(PO4)2, CaCO3, MgCO3 e SrSO4 .
Questão 09)
Correlacione os ácidos da 1ª Coluna com as respectivas características e
aplicações listadas na 2ª Coluna.
1ª Coluna
I- H2SO4
II- H3PO4
III- HCl
IV- CH3COOH
V- HCN
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
2ª Coluna
( ) Encontrado no comércio como ácido muriático
( ) Usado para temperar saladas
( ) Adicionado em bebidas e refrigerantes
( ) Adicionado em baterias de automóveis
( ) Extremamente tóxico
Marque a alternativa que apresenta a seqüência correta de cima para baixo.
a) I, II, IV, V, III
b) III, IV, II, I, V
c) IV, II, III,V, I
d) IV, II, I,III, IV
Questão 10)
Dadas as reações químicas:
a) NH3(g) + HCl(g) NH4Cl(l)
b) 2 H2O2(aq) 2 H2O(l) + O2(g)
c) NaOH(aq) + HCl(aq) NaCl(aq) + H2O(l)
d) Zn(s) + H2SO4(aq) ZnSO4(aq) + H2(g)
e) CaO(s) + H2O(l) Ca(OH)2(aq)
associe-as corretamente com as afirmativas abaixo
( ) reação de simples troca
( ) reação de síntese, tendo como produto um sal
( ) reação de síntese, tendo como produto uma base
( ) reação de análise
( ) reação de dupla troca
a seqüência correta encontrada de cima para baixo nos parênteses é
a) d, a, e, b, c
b) a, e, b, d, c
c) d, a, e, c, b
d) c, b, e, a, d
e) d, e, a, c, b
Questão 11)
Observe a figura abaixo que representa o Ciclo Hidrológico.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Acerca desse assunto, analise as afirmativas a seguir.
I - A água na atmosfera pode reagir com determinados gases como dióxido
de enxofre (SO2), óxidos de nitrogênio (NO, NO2, N2O5) e dióxido de
carbono (CO2), ocasionando as chuvas ácidas.
II - O agente oxidante mais importante em águas naturais é o oxigênio
molecular dissolvido (O2). A quantidade de oxigênio depende da
temperatura e da pressão atmosférica. Quanto maior a pressão, maior a
dissolução do oxigênio e quanto menor a temperatura, menor a
dissolução desse gás.
III A fotossíntese do fitoplâncton é a principal fonte de oxigênio
dissolvido na água dos lagos, rios, mares, etc. Durante o dia, o
fitoplâncton remove o gás carbônico da água e produz oxigênio usado na
respiração dos organismos vivos. À noite, não há luz para promover a
fotossíntese. Assim, a concentração de oxigênio dissolvido aumenta
durante o dia.
IV Águas subterrâneas com sais minerais dissolvidos, geralmente
Carbonato de Cálcio ou uma combinação de Cálcio e Magnésio, são
chamadas de águas gaseificadas.
VNuvens formam um conjunto visível de partículas minúsculas de
água líquida ou de gelo, ou de ambas ao mesmo tempo – em suspensão
na atmosfera. Essa nuvens são formadas, em vapor de água, a partir da
sublimação da água líquida na superfície dos rios, lagos e oceanos.
Marque a alternativa que apresenta apenas afirmativas corretas.
a) I e III
b) I, II e IV
c) I e II
d) III, IV e V
Questão 12)
Na química, utilizamos um processo chamado de “Titulação” para
determinar a quantidade de substância de uma solução, através do
confronto com outra espécie química, de concentração e natureza
conhecidas. As titulações ácido-base, titulação de oxidação-redução e
titulação de complexação são exemplos deste procedimento. No caso de
uma titulação ácido-base, em que foi utilizado 87,5 mL de HCl 0,1 M para se
neutralizar um certo volume de NaOH 0,35 M, qual a quantidade de NaOH
envolvida?
Dados: massa molar do NaOH = 40g; massa molar do HCl = 36,5g
a) 15,0 mL
b) 25,0 mL
c) 50,0 mL
d) 75,0 mL
e) 87,5 mL
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Questão 13)
A preparação de soluções é uma das habilidades que os químicos
desenvolveram desde os tempos da alquimia e é considerada um
conhecimento básico.
Os dados da tabela a seguir foram retirados de um frasco de solução de
HCl.
O volume de HCl concentrado necessário para preparar 1 litro de solução 1
mol/L de HCl é
a)
b)
c)
d)
e)
31, 70 mL
36, 50 mL
105, 8 mL
121, 5 mL
125, 8 Ml
Questão 14)
No gráfico, encontra-se representada a curva de solubilidade do nitrato de
potássio (em gramas de soluto por 1000 g de água).
Para a obtenção de solução saturada contendo 200 g de nitrato de potássio
em 500 g de água, a solução deve estar a uma temperatura,
aproximadamente, igual a
a) 12 °C.
b) 17 °C.
c) 22 °C.
d) 27 ºC.
e) 32 °C.
Questão 15)
Antigamente, na construção das estradas de ferro, o processo de soldagem
dos trilhos era realizado pela reação do alumínio pulverizado com óxido de
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
ferro III, de acordo com a equação química (não balanceada) representada
abaixo.
Al (s) + Fe2O3 (s) Al2O3 (s) + Fe (l)
O processo de soldagem é possível, pois essa reação libera tanto calor, que
o ferro produzido é imediatamente fundido. Supondo-se que, para a
soldagem de dois trilhos, sejam necessários 4 mol de ferro e que todos os
reagentes sejam consumidos, a massa de óxido de ferro III gasta nesse
processo seria de
a)
b)
c)
d)
e)
159,6 mg.
858,1 kg.
319,2 g.
429,1 kg.
214,5 g.
Questão 16)
A análise do conteúdo calórico de um sorvete demonstra que ele contém,
aproximadamente, 5% de proteínas, 22% de carboidratos e 13% de
gorduras. A massa restante pode ser considerada como água. A tabela
abaixo apresenta dados de calor de combustão para esses três nutrientes.
Se o valor energético diário recomendável para uma criança é de 8400kJ, o
número de sorvetes de 100g necessários para suprir essa demanda seria
de, aproximadamente,
a)
b)
c)
d)
e)
Nutriente (1g)
Proteínas
Calor liberado (kJ)
16,7
Carboidrat os
Lipídeos (gorduras)
16,7
37,7
2
3
6
9
12
Questão 17)
O peróxido de hidrogênio que, em solução aquosa, é conhecido
comercialmente como água oxigenada, é um líquido claro de fórmula
química H2O2. Recentemente foi utilizado de forma ilegal, juntamente com o
hidróxido de sódio, para aumentar o volume de comercialização de leite. No
leite a água oxigenada sofre um processo de decomposição dado pela
equação:
2H 2 O 2 (l) 2H 2 O(l) O 2 (g) , com um H 196kJ
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Em relação a este processo, qual o calor (q) desprendido na decomposição
de 5,0g de H2O2(l) a pressão constante?
(Dados de massa
atômica: H=1; O=16.)
a)
b)
c)
d)
e)
–7,2 kJ
–14,4 kJ
–28,8 kJ
–49,0 kJ
–98,0 kJ
Questão 18)
Considere a seguinte sequência de reatividade dos elementos, na qual a
facilidade relativa de perda de elétrons aumenta da esquerda para direita:
Cu < Pb < Cd < Zn.
Assinale a opção que apresenta a afirmativa CORRETA.
a) O Cu é o metal mais nobre, isto é, ele é facilmente oxidado pelos íons
Pb2+, Zn2+ ou Cd2+.
b) A reação entre Zn2+ e Cu não ocorre espontaneamente.
c) Em uma pilha formada por uma semicélula de Zn/Zn 2+ e uma semicélula
Cd/Cd2+, os elétrons migram da semicélula de Cd/Cd 2+ para a de
Zn/Zn2+.
d) Todos os quatro metais da sequência estão localizados nas séries de
transição da tabela periódica.
e) O Zn2+ possui maior potencial de redução que os íons Pb2+, Cu2+ e Cd2+.
Questão 19)
Considere as informações a seguir e preencha os parênteses com V para
verdadeiro e F para falso.
O estireno, representado pela fórmula estrutural abaixo, é obtido a partir do
petróleo, sendo usado principalmente pelas indústrias de plásticos e de
borrachas.
Em relação a esse composto, afirma-se que
( ) sua fórmula mínima é idêntica à do benzeno.
( ) apresenta cadeia heterogênea e mista.
( ) possui o anel benzênico em sua estrutura.
( ) apresenta em sua estrutura somente um átomo de carbono quaternário.
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
( ) apresenta em sua estrutura somente um átomo de carbono com
geometria tetraédrica.
A sequência correta de preenchimento dos parênteses, de cima para baixo,
é
a)
b)
c)
d)
e)
V–F–V–F–F
F–V–V–V–V
V–V–V–V–F
F–F–F–F–V
F–F–F–V–V
TEXTO: 1 - Comum à questão: 23
Nas salinas, a água do mar é evaporada pela ação do vento e do calor,
obtendo-se o sal grosso. Em seguida, por processos de separação, esse sal
é purificado, resultando no cloreto de sódio cristalizado, que é utilizado na
indústria como matéria-prima para produção de diversos produtos químicos,
conforme exemplificado no esquema abaixo.
Disponível em <http://www.caii.com.br/ctudo-produtos-processo.html>. Acesso em: 10 jul. 2009.
(Adaptado)
Questão 23)
As substâncias comercialmente conhecidas como soda cáustica (I), água
sanitária (II) e barrilha (IV) são utilizadas como produtos de limpeza e na
fabricação de papel. A nomenclatura correta para essas substâncias é
respectivamente:
a)
b)
c)
d)
e)
Carbonato de sódio, hipoclorito de sódio e hidróxido de sódio
Hipoclorito de sódio, carbonato de sódio e hidróxido de sódio
Hidróxido de sódio, hipoclorito de sódio e carbonato de sódio
Hidróxido de sódio, carbonato de sódio e hipoclorito de sódio
Hipoclorito de sódio, hidróxido de sódio e carbonato de sódio
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Questões Discursivas
Questão 21)
O desenho abaixo representa um armário de um laboratório de química:
Escolha, entre os objetos do armário, o(s)
equipamento(s) necessário(s) para se determinar,
utilizando-se a técnica de titulação, o grau de
pureza de 1 tonelada de ácido cítrico, que é
sólido na temperatura ambiente. Dê o(s) nome(s)
e descreva o processo de utilização desse(s)
equipamento(s).
Questão 22)
A nitroglicerina, C3H5(NO3)3, é um líquido extremamente explosivo. Durante
sua explosão, ela se decompõe segundo a equação:
C 3 H 5 (NO3 ) 3 (l)
3CO 2 (g) 5/2H 2 O(g) 1/4O 2 (g) H r 5720 kJ / mol
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
Sendo a densidade da nitroglicerina igual a 1,59 g/mL, a 20ºC, calcule o
volume (mL) de nitroglicerina usado quando 11440 kJ de calor forem
liberados numa explosão.
Questão 23)
– Ainda sonolentos, saem em direção ao local da ocorrência e resolvem
parar num posto de combustível.
– Complete! – diz Rango ao frentista.
Assim que o rapaz começa a colocar álcool no tanque, Estrondosa grita:
– Pare! Pare! Este carro é a gasolina!
– Ainda bem que você percebeu o engano – disse Rango.
– Amigo! Complete o tanque com gasolina.
O nosso herói procedeu assim porque calculou que, com o volume de álcool
anidro colocado no tanque, adicionando a gasolina contendo 20%
(volume/volume) de etanol, obteria um combustível com 24% de etanol
(volume/volume), igual àquele vendido nos postos até pouco tempo atrás.
a) Sabendo-se que o volume total do tanque é 50 litros, qual é a
quantidade total de álcool, em litros, no tanque agora cheio?
b) Que volume de etanol anidro o frentista colocou por engano no tanque
do carro?
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
GABARITO
1) Gab: C
2) Gab: B
3) Gab: B
4) Gab: D
5) Gab: A
6) Gab: B
7) Gab: C
8) Gab: E
9) Gab: B
10) Gab: A
11) Gab: A
12) Gab: B
13) Gab: C
14) Gab: D
15) Gab: C
16) Gab: D
17) Gab: B
18) Gab: B
19) Gab: A
OLIMPÍADA DE QUÍMICA 2011 – FASE I – MODALIDADE A
20) Gab: C
21) Gab:
Pode-se utilizar para tal técnica o processo de titulometria ou análise
volumétrica. Para isso, são necessários os seguintes equipamentos:
-Balança:inicialmente deve-se pesar cuidadosamente a amostra impura;
-Balão Volumétrico: utilizado para solubilizar a amostra;
-Erlenmeyer: em seguida deve-se retirar uma porção da amostra (alíquota) do
balão volumétrico (utilizando uma pipeta) e transferi-la para o erlenmeyer que
será utilizado no processo de titulação;
-Bureta: utilizando uma solução padrão em uma bureta atada em um suporte
(não citado), deve-se iniciar o processo de titulação que irá se processar
consumindo os reagentes até total neutralização, indicada por meio de
indicadores ácido-base (mudança de coloração). Com isso, pode-se determinar
a concentração da amostra problema ou a massa que realmente é pura e
portanto reagiu e a partir de então, pode-se determinar a pureza da amostra.
22) Gab: 285,53mL
23) Gab:
a) Quantidade total de álcool na gasolina com 24% de etanol é x = 12L
b) Volume de etanol anidro colocado por engano: 2,5L