1) (Pucmg 2008) Considere o gráfico
a seguir, referente aos diagramas
energéticos de uma reação química
com
e
sem
catalisador.
Assinale a afirmativa CORRETA.
a) A reação é endotérmica.
b) A energia de ativação em presença
do catalisador é 150 kJ.
c) A curva II representa o diagrama
energético da reação catalisada.
d) A reação acontece em duas
etapas.
2)(Ufrj2008
a) Indique as etapas endotérmicas e
exotérmicas.
b) Calcule a variação da entalpia na
conversão do CO‚ em metanol.
c) Indique a etapa lenta do processo.
Justifique sua resposta.
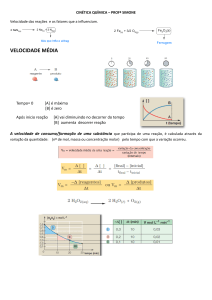
3) (Puc rio 2008) Considere a reação
de decomposição da substância A na
substância B e as espécies a cada
momento segundo o tempo indicado.
Sobre a velocidade dessa reação, é
correto afirmar que a velocidade de:
a) decomposição da substância A, no
intervalo de tempo de 0 a 20 s, é 0,46
mol /s.
b) decomposição da substância A, no
intervalo de tempo de 20 a 40 s, é
0,012 mol/ s.
c) decomposição da substância A, no
intervalo de tempo de 0 a 40 s, é
0,035 mol/ s.
d) formação da substância B, no
intervalo de tempo de 0 a 20 s, é 0,46
mol /s.
e) formação da substância B, no
intervalo de tempo de 0 a 40 s, é 0,70
mol/ s.
4) (Pucsp 2007) O dióxido de
nitrogênio (NO2) reage com o
monóxido de carbono (CO) formando
o óxido nítrico (NO) e o dióxido de
carbono (CO2).
NO2(g) + CO(g) → NO(g) + CO2(g)
Analisando
o
diagrama
de
coordenadas de reação apresentado,
um estudante fez as seguintes
afirmações:
I. A energia de ativação para a
formação do óxido nítrico é de 132
kJ/ mol.
II. A formação do óxido nítrico é um
processo endotérmico.
III. O aumento da temperatura do
sistema
reacional
diminui
a
velocidade de formação do óxido
nítrico, pois aumenta a energia de
ativação da reação.
Está(ão) correta(s) somente a(s)
afirmação(ões)
a) I.
b) II.
c) III.
d) I e II.
e) I e III.
5) (Ufsm 2007) Um comprimido
efervescente de vitamina C intacto,
pesando 5 g, quando colocado em
um copo contendo água a 25 °C, será
dissolvido em dois minutos.
Considerando
essa
informação,
assinale verdadeira (V) ou falsa (F)
em cada uma das proposições.
(
) Se o comprimido efervescente
estiver em pequenos pedaços, o
tempo de dissolução também será de
dois minutos, pois a massa continua
sendo 5 g.
(
) O tempo de dissolução do
comprimido
efervescente
intacto
mantém-se quando o comprimido for
dissolvido em água a 40 °C, pois a
área de contato é a mesma.
(
) Quanto maior a superfície de
contato do comprimido efervescente
com a água, maior o número de
colisões favoráveis, portanto maior a
velocidade de dissolução.
(
) O aumento da temperatura
diminui a energia de ativação,
diminuindo, portanto, o tempo de
dissolução.
A seqüência correta é
a) V - F - V - V.
b) F - V - F - V.
c) V - V - F - V.
d) F - F - V - F.
e) V - V - F - F.
6) (Ufrs) Observe o gráfico a seguir.
O perfil da reação genérica A ë B,
nele representado, indica que a
energia de ativação do processo, em
kJ, é igual a
a) 100.
b) 150.
c) 250.
d) 300.
e) 400.
7) Quando uma fita de magnésio é
mergulhada em uma solução aquosa
de ácido clorídrico, ocorre a reação:
Mg(s) + 2HCl(aq) → MgC2(aq) + H2(g)
A temperatura da solução e a
concentração do ácido afetam a
velocidade da reação de oxidação do
magnésio. Considere as condições
experimentais durante a oxidação da
fita de magnésio, de acordo com os
registros a seguir.
O magnésio será oxidado, mais
rapidamente, no experimento
a) 1.
b) 2.
c) 3.
d) 4
.
8) Aumentando-se a temperatura em
um sistema químico reagente, o único
fator que NÃO se altera é a (o)
a) energia de ativação da reação.
b) tempo para o equilíbrio ser
alcançado.
c) energia cinética das partículas
reagentes.
d) número de colisões efetivas entre
as partículas.
9) (Ufij) Considere o diagrama de
energia da reação de decomposição
do H2O2 representado
.
Assinale a alternativa INCORRETA:
a) A reação de decomposição do
H2O2 é exotérmica.
b) A curva "A" apresenta maior
energia de ativação que a curva "B".
c) A presença de um catalisador afeta
o ∆H da reação.
d) A curva "B" representa a reação
com a presença de um catalisador.
e) A letra "Z" representa o ∆H da
reação de decomposição do H2O2.
10)
Em
aquários,
utilizam-se
borbulhadores de ar para oxigenar a
água. Para um mesmo volume de ar
bombeado nesse processo, bolhas
pequenas são mais eficientes, porque
em bolhas pequenas
a) a área superficial total é maior.
b) a densidade é menor.
c) a pressão é maior.
d) a velocidade de ascensão é
menor.
e) o volume total é menor.
11) Considere as afirmações sobre
velocidade das reações químicas,
apresentadas a seguir.
I. O aumento da superfície de contato
entre os reagentes aumenta a
velocidade da reação.
II. O aumento da concentração dos
reagentes aumenta a velocidade da
reação.
III. O aumento da temperatura
aumenta a velocidade da reação.
A afirmação está CORRETA em:
a) I apenas.
b) I e II apenas.
c) III apenas.
d) I, II e III.
12) (Ufsm) Para que ocorra uma
reação química, é necessário que os
reagentes entrem em contato, através
de colisões, o que se chama Teoria
das Colisões. Essa teoria baseia-se
em que
I - todas as colisões entre os
reagentes
são
efetivas
(ou
favoráveis).
II - a velocidade da reação é
diretamente proporcional ao número
de colisões efetivas (ou favoráveis).
III - existem colisões que não são
favoráveis à formação do produto.
IV - maior será a velocidade de
reação, quanto maior for a energia de
ativação.
Estão corretas
a) apenas I, II e III.
b) apenas II e III.
c) apenas I e IV.
d) apenas I, II e IV.
e) apenas III e IV.
13) Considere a reação elementar
representada pela equação
3 O2(g) → 2 O3(g)
Ao triplicarmos a concentração do
oxigênio, a velocidade da reação, em
relação à velocidade inicial, torna-se
a) duas vezes menor.
b) três vezes maior.
c) oito vezes menor.
d) nove vezes maior.
e) vinte e sete vezes maior.
14) Analise as afirmações seguintes,
sobre CINÉTICA QUÍMICA.
( ) A etapa determinante da rapidez
de uma reação química é a mais
lenta.
(
) Catalisadores não participam
das etapas de uma reação química.
(
) Uma porção de maionese
deteriora-se mais rapidamente do que
os seus componentes considerados
separadamente, pois, entre outros
fatores, a superfície de contato de
cada um é maior.
(
) A freqüência de colisões
efetivas entre reagentes diminui com
o aumento de temperatura.
(
) Alumínio em pó pode ser
"queimado" mais facilmente do que
alumínio em raspas.
15) Observa-se que a velocidade de
reação
é
maior
quando
um
comprimido efervescente, usado no
combate à azia, é colocado:
a) inteiro, em água que está à
temperatura de 6°C.
b) pulverizado, em água que está à
temperatura de 45°C.
c) inteiro, em água que está à
temperatura de 45°C.
d) pulverizado, em água que está à
temperatura de 6°C.
e) inteiro, em água que está à
temperatura de 25°C.
16) Para responder à questão,
relacione os fenômenos descritos na
coluna I com os fatores que
influenciam na velocidade dos
mesmos, mencionados na coluna II.
COLUNA I
e) II e IV.
1 - Queimadas se alastrando
rapidamente quando está ventando.
2 - Conservação dos alimentos no
refrigerador.
3 - Efervescência da água oxigenada
na higiene de ferimentos.
4 - Lascas de madeiras queimando
mais rapidamente que uma tora de
madeira.
COLUNA II
A - superfície de contato
B - catalisador
C - concentração
D - temperatura
A
alternativa
que
contém
a
associação correta entre as duas
colunas é
a) 1 - C; 2 - D; 3 - B; 4 - A
b) 1 - D; 2 - C; 3 - B; 4 - A
c) 1 - A; 2 - B; 3 - C; 4 - D
d) 1 - B; 2 - C; 3 - D; 4 - A
e) 1 - C; 2 - D; 3 - A; 4 – B
18) Sobre catalisadores, são feitas as
quatro afirmações seguintes.
I - São substâncias que aumentam a
velocidade de uma reação.
II - Reduzem a energia de ativação
da reação.
III - As reações nas quais atuam não
ocorreriam nas suas ausências.
IV - Enzimas são catalisadores
biológicos.
Dentre estas afirmações,
corretas, apenas:
a) I e II.
b) II e III.
c) I, II e III.
d) I, II e IV.
e) II, III e IV.
estão
19) No laboratório, o hidrogênio pode
ser preparado pela reação de zinco
com solução de ácido clorídrico.
Observe as condições especificadas
nas experiências a seguir.
17)
Considere
os
diagramas
representativos de Energia (E) versus
coordenada das reações (cr):
O diagrama da reação mais lenta e o
da que tem a energia de ativação
igual a zero são, respectivamente,
a) I e II.
b) I e III.
c) II e III.
d) I e IV.
A velocidade da reação é maior em
a) I
b) II
c) III
d) IV
e) V
20) A seguir estão representadas as
etapas da reação:
H2 + Br2 → 2HBr
Gabarito
1c
2) a) Etapa endotérmica: II ë III.
Etapas exotérmicas: I ë II e III ë IV.
b) ∆H = - 40 kJ.
c) A etapa lenta é a etapa que vai de
II a III, por apresentar a maior energia
de ativação.
A
velocidade
da
reação
determinada pela etapa:
a) I
b) II
c) III
d) IV
e) V
é
21) No estudo cinético de uma reação
representada por
2A(g)
+
B2(g)
→
2AB(g)
colocou-se os seguintes dados:
A velocidade da reação pode ser
expressa pela reação
a) v = k 2[A]
b) v = k [B]2
c) v = k [A] [B]
d) v = k [A]2 [B]
e) V = K [A] [B]2
3b
4a
5d
6) d
7) d
8) a
9) c
10) a
11) d
12) b
13) e
14) V F F F V
15) b
16) a
17) b
18) d
19) c
20) b
21) d