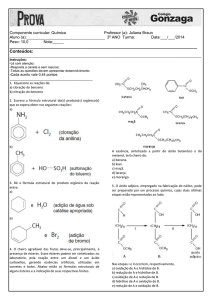
ESTABILIDADE DE
MEDICAMENTOS
Prof. Erika Liz
ESTABILIDADE
É a capacidade de um produto de
manter suas características originais
conforme as suas especificações de
pureza,
qualidade
e
potência.
O estudo da estabilidade se realiza em
uma fase prévia da comercialização de
um produto novo, ou quando se
efetuaram mudanças no processo de
elaboração.
Portaria nº 500/MS/SNVS, de 9 de outubro de 1997
INTRODUÇÃO
Todos os materiais sofrem alterações,
com o tempo, sob a ação do
ambiente:
◦ Materiais extraídos da natureza
◦ Materiais sintéticos
Meio ambiente: fatores ambientais
◦
◦
◦
◦
Físicos: luz (radiação UV, IV)
Umidade
Calor
Microrganismos
Introdução
Com os fármacos ocorre o mesmo:
◦ Fármacos puros são mais estáveis que
em misturas: as chances de interação
com outros materiais aumentam
Medicamentos são misturas de fármacos
e veículos ou excipientes
◦ Fármacos em formas sólidas são mais
estáveis que em formas líquidas: as
reações químicas ocorrem melhor em
meio líquido
Introdução
◦ Fármacos
sujeitos
a
algum
processamento
são também
mais
facilmente decompostos: granulação
úmida, secagem, aquecimento para
facilitar a solubilização, etc.
Maior exposição aos agentes ambientais:
oxigênio, luz, aquecimento, microrganismos
Introdução
A decomposição dos fármacos, puros ou
nos
medicamentos,
obriga
aos
fabricantes estipular a sua data de
validade
◦ Baseados em experimentos que permitem
estimar o tempo em que os fármacos
permanecem em condições de exercer seu
efeito sem alterar sua toxicidade
Estabilidade física
A estabilidade física significa que o
medicamento não sofreu alterações,
durante seu armazenamento, que
impliquem
em
mudança
das
características físicas:
◦
◦
◦
◦
Aspecto, cor, odor, sabor
Aparecimento de cristais em soluções
Dureza ou friabilidade em comprimidos
Separação de fases em emulsões
Estabilidade física
◦ Separação de fases em emulsões
Estabilidade física
Outros exemplos:
◦ Supositórios: fusão fora da faixa ideal
◦ Comprimidos e cápsulas: alteração do tempo
de dissolução do fármaco
◦ Suspensões: formação de sedimento
compactado; alteração do tamanho de
partícula
◦ Todas as formas: aparecimento de
polimorfismo
Polimorfismo do ibuprofeno em diversos solventes
Optical micrographs of crystal habit of
racemic (±)-ibuprofen grown in various
solvents by cooling with various shape
factors (in square brackets) (scale bar
= 200 µm): (a) acetonitrile [2.5], (b)
benzene [5.0], (c) n-butyl alcohol [2.0],
(d) chloroform [2.2], (e) N,Ndimethylaniline [4.0], (f) N,Ndimethylformamide [1.6], (g) dimethyl
sulfoxide [6.5], (h) 1,4-dioxane [3.6], (i)
ethanol [2.9], (j) ethyl acetate [3.3], (k)
n-heptane [4.3], (l) isopropyl alcohol
[2.3], (m) methanol [3.1], (n) methyl
tert-butyl ether [4.3], (o) methyl ethyl
ketone [3.1], (p) tetrahydrofuran [2.6],
(q) toluene [4.5], and (r) p-xylene [5.3].
Estabilidade química
É a capacidade da forma farmacêutica
em manter a identidade molecular do
fármaco
Mecanismos principais de degradação
química:
◦
◦
◦
◦
Hidrólise
Oxidação
Fotólise
Outros (racemização, dimerização, etc.)
Estabilidade química
A estabilidade química depende de:
◦ Umidade: em meio líquido as reações de
decomposição
aumentam
pois
as
moléculas estão mais sujeitas a colisões
estando em solução
◦ Temperatura: a temperatura catalisa a
maioria das reações
◦ Luz
◦ pH
Estabilidade química
Efeito da temperatura:
◦ Em geral, o aumento de 10 graus na
Temperatura, acelera em 2 a 5 vezes a
velocidade de uma reação
◦ Importante lembrar que, em nosso país, a
temperatura ambiente varia muito,
ultrapassando os 30º C
◦ A temperatura é um importante catalisador
das reações de hidrólise e oxidação
Estabilidade química
Hidrólise
◦ Ocorre quebra da molécula de fármaco pela
ação da água – a água é um reagente
◦ Há grupos funcionais que favorecem a
hidrólise:
Lactonas (ésteres cíclicos)
Lactamas (amidas cíclicas)
Ésteres
Amidas
Hidrólise
Mecanismo:
Hidrólise
Lactamas
Hidrólise
Hidrólise
Hidrólise da cefotaxima sódica
Hidrólise e pH
O pH é um importante catalisador da
hidrólise
◦ Em pH baixo: aumenta a eletrofilicidade da
carbonila com a protonização do Oxigênio
◦ Em pH alto aumentam hidroxilas nucleófilas
para ataque
Existe um pH ótimo, no qual a hidrólise
é mínima
Hidrólise e pH
Hidrólise
Como evitar ou diminuir a hidrólise:
◦ Remover a água: substituir por solventes
como glicerina, sorbitol. Nem sempre é
possível.
◦ Proteger da umidade, usar dessecantes
formas sólidas
◦ Preparar suspensões em vez de soluções
◦ Acondicionamento impermeável
Estabilidade química
Como evitar ou diminuir a hidrólise:
◦ Remover traços de metais que podem
catalisar a hidrólise:
uso de quelantes: EDTA, ác. tartárico, ác. cítrico,
polifosfatos, ác. Glucônico
◦ Ajustar o pH e propiciar sua manutenção:
Soluções tampões de fosfato, de ácido bórico,
acetato, entre outras
◦ Manter boas condições de temperatura e
umidade
Oxidação
Reação que ocorre na presença de
oxigênio, com o ganho de oxigênio ou
perda de hidrogênio
É iniciada tanto pela luz como pela
presença de metais
Caracteriza-se por uma série de
reações em cadeia mediadas por
radicais livres
Oxidação
Compostos
sujeitos à oxidação
◦ Alcenos
◦ Aldeídos
◦ Heteroátomos adjacentes a anel
benzênico (hidroquinonas)
◦ Tióis e compostos de enxofre não
totalmente oxidados
Oxidação
Reação de degradação da vitamina C
Oxidação
Como
evitar ou reduzir a oxidação:
◦ Remover traços de metais
◦ Evitar a luz
◦ Reduzir o contato com oxigênio
◦ Manter a temperatura
◦ Usar anti-oxidantes
Oxidação
Quelantes
◦ EDTA (edetato de sódio, ác. edético)
Anti-oxidantes
◦ Ácido ascórbico
◦ Sulfitos (sulfito e metabissulfito de sódio)
◦ Ácido ascórbico e seus ésteres,
◦ Tocoferóis
◦ BHT (butilhidroxitolueno), BHA (butilhidroxianisol)
◦ Sulfoxilato
Fotólise
A luz UV afeta as ligações químicas
fornecendo energia para a separação
dos elétrons compartilhados entre os
dois átomos dessa ligação. Pode resultar
em:
◦ Formação de radicais livres no processo de
oxidação
◦ Lise da molécula formando dois radicais
◦ A quebra da molécula pode causar
isomerização
Fotólise
Fármacos sujeitos à fotólise:
◦
◦
◦
◦
◦
◦
◦
◦
Vitaminas (A, B1, B12, D, E)
Ácido fólico
Corantes
Dipirona
Ácido meclofenâmico
Metotrexato
Fenotiazinas
Corticóides:hidrocortisona,
metilprednisolona
Fotólise
Como prevenir os efeitos da ação da luz:
◦ Fármacos oxidáveis: uso de anti-oxidantes
e quelantes, proteção contra O2,
temperatura de armazenagem adequada,
material de acondicionamento opaco ou
âmbar.
◦ Fármacos sujeitos à fotólise: proteção da
luz
Racemização
É a conversão de um isômero em outro, resultando
em mistura de ambos, geralmente, acompanhada
de perda de atividade
Ocorre com compostos que possuem C
assimétricos
Seus isômeros são denominados de enantiômeros
Pode ocorrer:
◦
◦
◦
◦
Luz
pH
Tipo de solvente
Presença de grupos aromáticos na molécula podem
facilitar
Racemização
O ibuprofeno, embora tenha isômeros,
não é administrado na forma de um
enantiômero,
pois
transforma-se
rapida e preferencialmente na forma
mais ativa no organismo
Racemização
O naproxeno é fornecido na forma S
suas preparações requerem controle
de pH para não haver racemização
Racemização
A teratogenicidade da talidomida se
deve a um de seus enantiômeros. Não
só pode haver perda de atividade na
racemização...
Racemização
Como
prevenir a racemização:
◦ Escolha adequada de solvente e pH
◦ Proteção da luz
◦ Controle de temperatura
Estabilidade microbiológica
A contaminação microbiana acarreta em
perda de estabilidade química e física
◦ Odor, cor e cheiro desagradável
◦ Presença de patogênicos
Os agentes são: algas, bactérias e
fungos
As formas particularmente susceptíveis
são as preparações líquidas e semisólidas
Estabilidade microbiológica
Principais
causas
◦ contaminação ambiental
◦ pessoal
◦ matérias-primas: água, produtos de
origem natural, insumos em geral
◦ concentração ou tipo de conservante
inadequado
◦ inativação de conservantes
Estabilidade microbiológica
Como evitar a perda de estabilidade
microbiológica:
◦ Uso de matérias-primas dentro dos limites
microbianos especificados
◦ Boa qualidade microbiológica da água
◦ Produção dentro das GMPs – qualidade
ambiental adequada, higiene pessoal, etc.
◦ Uso de conservantes para não estéreis
◦ Controle e validação de processos de
esterilização
Estabilidade microbiológica
Conservantes:
São adjuvantes que mantém, dentro dos
limites preconizados, a carga microbiana
presente nas formas não estéreis durante o
armazenamento e a qualidade microbiana nas
estéreis multidose durante o uso
◦ Uso
externo:álcool
benzílico,
parabenos,
imidazolidiluréia, cloreto de benalcônio, cloroxilenol
◦ Uso interno: Benzoato de sódio ( até 0,5%), ácido
benzóico (0,01%), parabenos – metil, propil,
hidroxietil (0,05 a 0,4%)
Outros fatores que levam a perda
de estabilidade
Interações entre fármaco e excipientes
◦ Físicas: formação de misturas eutéticas
◦ Químicas: interação química (lactose e
metformina, lactose e ranitidina, conservantes e
tensoativos)
◦ Outras: alteração da dissolução de fármaco com
o tempo
Interações entre o fármaco e o recipiente
Outros fatores que levam a perda
de estabilidade
Interações entre o fármaco e o recipiente:
◦ Vidros: tipos I, II. III e NP - dependendo do tipo
pode ceder OH-, óxidos de sódio e cálcio ou
traços de metais (Fe, Mg) que catalisam reações
de oxidação;
◦ Metais - cedem Fe, Cu, Pb, Al catalisando
reações;
◦ Plásticos e borrachas - possuem na sua
composição
estabilizantes,
anti-oxidantes,
lubrificantes, corantes, plastificantes e outros.
Também adsorvem fármacos e conservantes
Estabilidade de produtos
manipulados
Data ou prazo de validade: deve ser
fixado pelo Controle de Qualidade
Deve ser apoiado por informações da
literatura
Orientações da Farmacopéia
Americana
Estabilidade de produtos
manipulados
Conforme USP/NF para formulações
manipuladas extemporâneas e válidas para
recipientes bem vedados e armazenagem à
temperatura controlada, o tempo de validade
pode se estender por:
◦ Líquidos não aquosos e formulações sólidas
Matérias-primas USP/NF: não mais que 6
meses
Contendo produtos industrializados: 25% do
prazo de validade original e no máximo 6
meses
Estabilidade de produtos
manipulados
◦ Fórmulas contendo água: quando
preparadas com matérias-primas
sólidas, não mais que 14 dias
◦ Outras: 30 dias ou o tempo da
duração da terapia, podendo se
estender caso haja informações sobre
a estabilidade que possam justificar
Estabilidade de produtos
industrializados
Estudos de estabilidade:
◦ Conhecer os produtos de decomposição
◦ Estabelecer o acondicionamento
◦ Estabelecer o prazo de validade
Estabilidade de produtos
industrializados
Prazo de validade:
◦ Período no qual os medicamentos
mantém seus atributos dentro de limites
considerados aceitáveis, ex.:
Teor de fármaco (95-105%)
Carga microbiana
Compostos de decomposição
Estabilidade de produtos
industrializados
Prazo
de validade:
◦ Testes de estabilidade:
Preliminar
Condições drásticas
Acelerada
Condições de temperatura e umidade relativa
que permitam extrapolação
Tempo de prateleira ou shelf –life
Condições de temperatura e umidade
ambiente