Metabolismo do heme - Rui Fontes
Metabolismo do heme
1. As hemoproteínas são constituídas por uma ou mais cadeias aminoacídicas (a apo-proteína) e por um ou
mais grupos prostéticos designados por heme. O heme é uma porfirina que contém Fe2+. São exemplos de
hemoproteínas, a hemoglobina, a mioglobina, os citocromos da cadeia respiratória, os citocromos P450, a
catálase, as peroxídases e a pirrólase do triptofano.
2. O heme pode ser descrito como sendo formado por protoporfirina III, um composto corado e fluorescente
que contém “pontes” metenilo (-CH=) unindo 4 anéis pirrólicos [4C,1N], e Fe2+. Os anéis pirrólicos das
porfirinas (e porfirinogénios) são, tradicionalmente, numerados de I a IV e cada um deles tem duas cadeias
laterais. As cadeias laterais da protoporfirina III podem ser descritas pela seguinte sequência: metil, vinil,
metil, vinil, metil, propiónico, propiónico, metil. Os grupos vinilo contêm 2 átomos de carbono ligados por
uma ligação dupla [-CH=CH2]; os grupos propiónicos contêm 3 átomos de carbono, sendo que um deles é
constituinte de um grupo carboxílico (-CH2-CH2-COOH).
3. O heme é sintetizado na maioria das células do organismo, nomeadamente nas células da medula óssea
precursoras dos eritrócitos e nos hepatócitos. A tabela abaixo esquematiza, de forma simplificada, a síntese
de uma molécula de heme assim como a sua degradação. No processo de síntese de uma molécula de heme
consomem-se 8 resíduos de succinato [4C] do succinil-CoA (intermediário do ciclo de Krebs) e 8 moléculas
de glicina [2C,1N]. Sucessivamente formam-se 8 moléculas do ácido δ-aminolevulínico (ALA; 5C,1N) que
reagem entre si duas a duas, formando 4 moléculas de porfobilinogénio [10C,2N]. Estas 4 moléculas de
porfobilinogénio reagem entre si formando, em passos sucessivos, o uroporfirinogénio III [40C,4N], o
coproporfirinogénio III [36C,4N], o protoporfirinogénio III [34C,4N], a protoporfirina III [34C,4N] e o
heme [34C,4N,1Fe2+]. No processo catabólico que ocorre no meio interno, o heme origina a biliverdina
[33C,4N] que se converte em bilirrubina [33C,4N]. Por ação de bactérias do lúmen intestinal a bilirrubina
origina produtos de excreção presentes nas fezes e na urina (urobilinogénio, urobilina e estercobilina)
[33C,4N].
succinilsuccinilCoA
CoA
+ glicina
+ glicina
ALA
ALA
[5C,1N]
[5C,1N]
porfobilinogénio [10C,2N]
succinilsuccinilsuccinilsuccinilCoA
CoA
CoA
CoA
+ glicina
+ glicina
+ glicina
+ glicina
ALA
ALA
ALA
ALA
[5C,1N]
[5C,1N]
[5C,1N]
[5C,1N]
porfobilinogénio [10C,2N]
porfobilinogénio [10C,2N]
uroporfirinogénio III [40C,4N]
coproporfirinogénio III [36C,4N]
protoporfirinogénio III [34C,4N]
protoporfirina III [34C,4N]
succinilsuccinilCoA
CoA
+ glicina
+ glicina
ALA
ALA
[5C,1N]
[5C,1N]
porfobilinogénio [10C,2N]
heme [34C,4N,1Fe2+]
biliverdina [33C,4N]
bilirrubina [33C,4N]
urobilinogénio [33C,4N]
urobilina e estercobilina [33C,4N]
Ao contrário do que acontece nos casos do heme e da protoporfirina III, o uroporfirinogénio III, o
coproporfirinogénio III e o protoporfirinogénio III são incolores e não são fluorescentes; nestes últimos
compostos as “pontes” entre os anéis pirrólicos não são “pontes” metenilo (-CH=) mas sim metileno (-CH2-).
4. No processo de síntese do heme o primeiro passo é catalisado pela síntase do ácido δ-aminolevulínico
(síntase do ALA; ver Equação 1). O grupo prostético da síntase do ALA é o piridoxal-fosfato. Na reação
ocorre transferência do resíduo de succinato do succinil-CoA para a glicina e uma descarboxilação: a síntese
do heme pode, assim, ser considerado um processo cataplerótico e o heme um derivado da glicina. A
atividade da síntase do ácido δ-aminolevulínico é o passo limitante da velocidade da via metabólica e o
produto final da via (o heme) inibe a síntese desta enzima.
Equação 1
succinil-CoA + glicina → ALA + CoA + CO2
Página 1 de 3
Metabolismo do heme - Rui Fontes
5. Na via metabólica de síntese do heme duas moléculas de ALA originam, por ação catalítica da desidrátase
do ALA (ver Equação 2), o porfobilinogénio que contém um anel pirrol com duas cadeias laterais distintas
(ácidos acético e propiónico).
Equação 2
2 ALA → 2 H2O + porfobilinogénio
6. Por ação sequencial de duas enzimas (a síntase do uroporfirinogénio I e a cosíntase do uroporfirinogénio III)
forma-se o uroporfirinogénio III que contém 4 anéis pirrólicos ligados por pontes metileno (ver Equação
3). Nestas reações perdem-se, como amónio, 4 dos 8 átomos de azoto que provinham da glicina. No
uroporfirinogénio III as cadeias laterais dos anéis pirrol são os ácidos acético e propiónico e ocorrem por
esta ordem: acético, propiónico, acético, propiónico, acético, propiónico, propiónico, acético. Ao contrário
do que acontece no uroporfirinogénio I (um isómero que não é, normalmente, intermediário neste processo)
as cadeias laterais do anel pirrol IV do uroporfirinogénio III estão invertidas.
Equação 3
4 porfobilinogénio → uroporfirinogénio III + 4 NH4+
7. Sucessivamente forma-se o coproporfirinogénio III (descarboxílase do uroporfirinogénio III que catalisa a
descarboxilação das quatro cadeias laterais acetato a metilo; ver Equação 4), o protoporfirinogénio III
(oxídase do coproporfirinogénio III que catalisa a descarboxilação e oxidação dos propionatos dos anéis I e
II a vinilos; ver Equação 5), a protoporfirina III (oxídase do protoporfirinogénio III que catalisa a oxidação
das pontes metileno a metenilo; ver Equação 6) e finalmente o heme, pela incorporação de Fe2+ na
protoporfirina III (síntase do heme; ver Equação 7).
Equação 4
Equação 5
Equação 6
Equação 7
uroporfirinogénio III → coproporfirinogénio III + 4 CO2
coproporfirinogénio III + O2 → protoporfirinogénio III + 2 CO2 + 2 H2O
protoporfirinogénio III + 3O2 → protoporfirina III + 3 H2O2
protoporfirina III + Fe2+ → heme
8. Algumas enzimas da via metabólica da síntese do heme são citosólicas (desidrátase do ALA, síntase do
uroporfirinogénio I, cosíntase do uroporfirinogénio III e descarboxílase do uroporfirinogénio;
correspondentes às Equações 2-4). Contudo, a primeira enzima da via metabólica (síntase do ALA; ver
Equação 1) e as últimas 3 (oxídase do coproporfirinogénio, oxídase do protoporfirinogénio III e síntase do
heme; ver Equações 5-7) são mitocôndricas. Significa isto que existem na membrana interna da mitocôndria
transportadores para o ALA (que sai) e para o coproporfirinogénio (que entra).
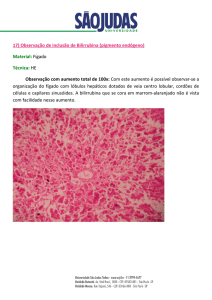
9. O catabolismo do heme tem lugar principalmente em células macrofágicas do baço, fígado e medula óssea
e inicia-se com a ação catalítica do sistema microssomático oxigénase do heme; este sistema catalisa a
rotura entre os anéis pirrólicos I e II do heme formando-se biliverdina (ver Equação 8). A biliverdina é, por
sua vez, reduzida a bilirrubina; esta reação é dependente do NADPH e é catalisada pela redútase da
biliverdina (ver Equação 9). A bilirrubina formada nesta fase do processo diz-se não conjugada, é
lipossolúvel e viaja no plasma ligada à albumina. A albumina não atravessa a membrana glomerular renal
e, por este motivo, a bilirrubina não conjugada não passa para a urina.
Equação 8
Equação 9
heme + 3 O2 + 3 NADPH → biliverdina + CO + 3 NADP+ + 3 H2O + Fe2+
biliverdina + NADPH → bilirrubina + NADP+
10. A bilirrubina não conjugada entra para os hepatócitos por difusão facilitada e reage com o ácido
glicurónico numa reação catalisada pela transférase do ácido glicurónico (ver Equação 10). Nesta reação o
dador do ácido glicurónico à bilirrubina é o UDP de ácido glicurónico e forma-se diglicuronil-bilirrubina,
também designada de bilirrubina conjugada. A bilirrubina conjugada é hidrossolúvel sendo excretada para
a árvore biliar por mecanismos de transporte ativo. No lúmen do intestino, a bilirrubina conjugada sofre a
ação de bactérias (redução) dando origem ao urobilinogénio que pode ser reabsorvido e de novo excretado
na bile (ciclo entero-hepático do urobilinogénio). O urobilinogénio está presente nas fezes e na urina e
pode, em contacto com oxigénio, ser oxidado a urobilina (ou ao composto similar estercobilina) que tem cor
castanha corando as fezes e sendo também parcialmente responsável pela cor normal da urina.
Equação 10
2 UDP-glicuronato + bilirrubina → 2 UDP + diglicuronil-bilirrubina
Página 2 de 3
Metabolismo do heme - Rui Fontes
11. A icterícia é um sinal clínico que consiste na coloração amarelada da pele, mucosas e esclerótica do olho
causada por aumento da bilirrubina no plasma sanguíneo e nos tecidos. Este aumento pode ser causado por
(1) aumento da sua síntese (ou seja, aumento do catabolismo do heme), (2) diminuição da velocidade de
conjugação ou (3) alterações no processo de excreção de origem mecânica. Os processos patológicos em
que há obstrução, esta obstrução pode ser (3.1) extra-hepática (como, por exemplo, no canal colédoco por
cálculos ou neoplasias) ou (3.2) intra-hepática. As obstruções intra-hepáticas ocorrem quando há lesão das
células hepáticas com edema concomitante (como, por exemplo, na hepatite vírica) e, consequentemente,
obstrução da “árvore” biliar (canalículos biliares).
12. Quando a icterícia é causada por aumento da síntese da bilirrubina ou por diminuição na conjugação é a
bilirrubina não conjugada (também designada por bilirrubina indireta) que está aumenta no plasma. A
bilirrubina não conjugada é lipossolúvel e pode entrar para o tecido cerebral (rico em fosfolipídeos e
glicolipídeos). Nas situações patológicas em que a bilirrubina não conjugada aumenta no plasma e atinge
concentrações muito elevadas pode causar lesão cerebral irreversível (e, eventualmente, a morte), uma
condição designada por “kernicterus”. Uma condição normal em que há icterícia é a “icterícia fisiológica do
recém nascido”. Nos primeiros dias de vida extra-uterina há uma diminuição marcada da concentração de
hemoglobina no sangue (hemólise fisiológica) e, simultaneamente, existe ainda imaturidade na síntese
hepática da glicuronil-transférase (ver Equação 10). Nalguns recém-nascidos o processo fisiológico pode ser
agravado por outras causas e a concentração plasmática de bilirrubina pode aumentar para níveis perigos.
13. Nas situações obstrutivas é sobretudo a bilirrubina conjugada (também designada por bilirrubina direta)
que aumenta no plasma. Nestas situações a bilirrubina conjugada acumula-se nos canalículos biliares e acaba
por ser reabsorvida para o plasma. Porque a bilirrubina conjugada não se liga à albumina, é filtrada no
glomérulo renal e aparece na urina, corando-a de cor de “vinho do Porto”. A incapacidade de excretar
bilirrubina na bile implica a não formação de urobilina e, consequentemente, nos casos em que há obstrução
mecânica completa as fezes têm cor clara.
14. As expressões “bilirrubina direta” e “bilirrubina indireta” têm a sua génese nos métodos que, classicamente,
são usados em “Química Clínica” para o doseamento da bilirrubina sérica [1]. Estes métodos baseiam-se na
formação de um composto corado quando um determinado reagente reage com a bilirrubina. Quando a
reação é feita na presença de substâncias que promovem a dissociação da bilirrubina não conjugada da
albumina a que estava ligada, toda a bilirrubina sérica contribui para a formação do composto corado e,
consequentemente, a absorvância mediada corresponde à “bilirrubina total”. Na ausência de adição ao meio
reativo das substâncias que promovem a referida dissociação, a bilirrubina que permanece ligada à albumina
não reage e não contribui para a absorvância medida; nestas condições, a absorvância registada é uma
medida da bilirrubina conjugada. Porque o valor obtido resulta da medição direta de uma absorvância
chama-se a esta medida “bilirrubina direta”. O valor que resulta do cálculo da diferença entre a “bilirrubina
total” e a “bilirrubina direta” designa-se de “bilirrubina indireta”. Do exposto se conclui que o valor da
bilirrubina indireta corresponde à bilirrubina que estava no soro original ligado à albumina, ou seja,
corresponde à bilirrubina não conjugada.
1. Calbreath, D. F. (1992) Clinical Chemistry. A Fundamental Textbook., 1st edn, W. B. Saunders Company., Philadelphia
Página 3 de 3