CINÉTICA QUÍMICA
ESTUDO DA VELOCIDADE DAS
REAÇÕES E DOS FATORES QUE
INTERFEREM NESSA VELOCIDADE.
VELOCIDADE MÉDIA
• É CALCULADA EM FUNÇÃO DE UMA DAS
SUBSTÂNCIAS PARTICIPANTES DA REAÇÃO.
• RAZÃO ENTRE A QUANTIDADE CONSUMIDA OU
PRODUZIDA E O INTERVALO DE TEMPO.
• A QUANTIDADE PODE SER EXPRESSA DE VÁRIAS
FORMAS: MASSA, VOLUME (GASES),
CONCENTRAÇÃO MOLAR, ETC.
• vm = consumo de reagente / variação do tempo
• vm = formação de produto / variação do tempo
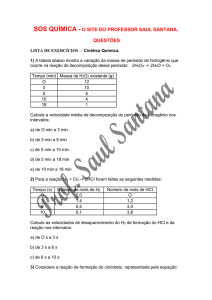
QUESTÃO
• Considere a reação genérica aA + bB cC + dD,
associada à seguinte tabela:
• Determine a velocidade média da reação em função
de A no intervalo entre 5min e 20min.
tempo
(min)
0
5
10
15
20
25
[A]/mol/L
8,5
7,0
5,5
4,0
2,5
1,0
[C]/mol/L
0
0,5
1,0
1,5
2,0
2,5
RESOLUÇÃO
•
•
•
•
vm = [A]/t
vm = 2,5 – 7,0 / 20 – 5
vm = - 4,5 / 15
vm = - 0,3mol/L.min
VELOCIDADE MÉDIA DA REAÇÃO
• É O MÓDULO DA VELOCIDADE DE CONSUMO
DOS REAGENTES (OU DE FORMAÇÃO DOS
PRODUTOS), DIVIDIDO PELO RESPECTIVO
COEFICIENTE DA SUBSTÂNCIA NA EQUAÇÃO.
• vmR = I vmreagente I / coeficiente
• vmR = I vmproduto I / coeficiente
QUESTÃO
• Considere a reação N2(g) + 3H2(g) 2NH3(g).
Expresse a velocidade média da reação,
fazendo uso de cada uma das três substâncias.
RESOLUÇÃO
•
•
•
•
vmR = I vN2 I / 1
vmR = I vH2 I / 3
vmR = I vNH3 I / 2
Lembrete: a velocidade encontrada através de
qualquer uma das três expressões terá o
mesmo valor.
GRÁFICO DA VELOCIDADE DE UMA
REAÇÃO
GRÁFICO DA VELOCIDADE DE UMA
REAÇÃO
TEORIA DAS COLISÕES
• CHOQUES ENTRE AS PARTÍCULAS REAGENTES.
• CHOQUES ORIENTADOS.
• CHOQUES EFETIVOS.
TEORIA DAS COLISÕES
ENERGIA DE ATIVAÇÃO E COMPLEXO
ATIVADO
• ENERGIA DE ATIVAÇÃO: QUANTIDADE MÍNIMA DE
ENERGIA NECESSÁRIA PARA QUE A COLISÃO ENTRE
AS PARTÍCULAS DOS REAGENTES , FEITA NUMA
ORIENTAÇÃO FAVORÁVEL, SEJA EFETIVA.
• A ENERGIA DE ATIVAÇÃO É INVERSAMENTE
PROPORCIONAL À VELOCIDADE DA REAÇÃO
• COMPLEXO ATIVADO: É UMA ESTRUTURA
INTERMEDIÁRIA ENTRE REAGENTES E PRODUTOS,
DOTADA DE ALTA ENERGIA E ALTA INSTABILIDADE.
ENERGIA DE ATIVAÇÃO E
COMPLEXO ATIVADO
INFLUÊNCIA NA VELOCIDADE
•
•
•
•
•
•
•
NATUREZA DOS REAGENTES
SUPERFÍCIE DE CONTATO
LUZ E ELETRICIDADE
CONCENTRAÇÃO DOS REAGENTES
PRESSÃO
TEMPERATURA
CATALISADORES E INIBIDORES
NATUREZA DOS REAGENTES
• CADEIAS LONGAS E GRANDE QUANTIDADE DE
LIGAÇÕES DIMINUEM A VELOCIDADE DA
REAÇÃO.
• COMPOSTOS ORGÂNICOS – REAÇÕES MAIS
LENTAS.
• COMPOSTOS INORGÂNICOS – REAÇÕES MAIS
RÁPIDAS.
SUPERFÍCIE DE CONTATO
• QUANTO MAIOR A SUPERFÍCIE DE CONTATO
DOS REAGENTES, MAIOR A VELOCIDADE DA
REAÇÃO.
• VELOCIDADE DE REAÇÃO DOS MATERIAIS
PULVERIZADOS PREVALECE SOBRE DE
MATERIAIS INTEIROS.
LUZ E ELETRICIDADE
• REAÇÕES FOTOQUÍMICAS (COM REAGENTE
FOTOQUÍMICO ATIVO)
• FOTÓLISES
• FOTOSSÍNTESES
CONCENTRAÇÃO DOS REAGENTES
• QUANTO MAIOR A CONCENTRAÇÃO DOS
REAGENTES, MAIOR A PROBABILIDADE DE
COLISÕES.
• MAIOR VELOCIDADE DA REAÇÃO.
CONCENTRAÇÃO DOS REAGENTES
PRESSÃO
• IMPLICA EM DIMINUIÇÃO DO VOLUME DO
SISTEMA, AUMENTANDO A PROBABILIDADE
DE CHOQUES.
• MAIOR VELOCIDADE DA REAÇÃO.
PRESSÃO
TEMPERATURA
• MEDIDA DO GRAU DE AGITAÇÃO DAS
PARTÍCULAS.
• MAIOR TEMPERAUTA IMPLICA EM MAIOR
GRAU DE AGITAÇÃO.
• MAIOR VELOCIDADE DA REAÇÃO.
CATALISADORES
• SUBSTÂNCIAS QUE DIMINUEM A ENERGIA DE
ATIVAÇÃO DO SISTEMA.
• AUMENTAM A VELOCIDADE DA REAÇÃO.
• NÃO REAGEM.
• NÃO DESLOCAM O EQUILÍBRIO.
• NÃO SÃO CONSUMIDAS PELA REAÇÃO.
CATALISADORES
CATÁLISE
• HOMOGÊNEA: CATALISADOR E REAGENTES
FORMAM UM SISTEMA MONOFÁSICO.
• HETEROGÊNEA: CATALISADOR E REAGENTES
FORMAM UM SISTEMA POLIFÁSICO.
• AUTO-CATÁLISE: UM DOS PRODUTOS DA
REAÇÃO AGE COMO CATALISADOR.
CATALISADOR AUTOMOTIVO
INIBIDORES
• AUMENTAM A ENERGIA DE ATIVAÇÃO,
DIMINUINDO A VELOCIDADE DA REAÇÃO.
LEI DA AÇÃO DAS MASSAS
• A CADA TEMPERATURA, A VELOCIDADE DE UMA REAÇÃO É
DIRETAMENTE PROPORCIONAL AO PRODUTO
(MULTIPLICAÇÃO) DAS CONCENTRAÇÕES EM QUANTIDADE DE
MATÉRIA, ELEVADAS A EXPOENTES DETERMINADOS
EXPERIMENTALMENTE.
• aA + bB → cC + dD
• v = k [A]a[B]b
• k é uma constante que só depende da temperatura.
• SÓLIDOS E/OU SOLVENTES NÃO ENTRAM NA EXPRESSÃO DE
VELOCIDADE.
• [ ] = CONCENTRAÇÃO MOLAR (mol/L)
TIPOS DE REAÇÕES
• ELEMENTAR: OCORRE EM UMA ÚNICA ETAPA.
• H3O+(aq) + OH-(aq) → 2H2O(l)
v = k[H3O+][OH-]
• NÃO-ELEMENTAR: DESENVOLVE-SE EM DUAS OU MAIS
ETAPAS. A ETAPA LENTA É DETERMINANTE DA VELOCIDADE DA
REAÇÃO.
• H2(g) + 2NO(g)→ N2O(g) + H2O(l) (lenta)
• H2(g) + N2O(g) → N2(g) + H2O(l) (rápida)
------------------------------------------------------• 2H2(g) + 2NO(g)→ N2(g) + 2H2O(l)
• v = k[H2][NO]2
GRÁFICO – REAÇÃO NÃO
ELEMENTAR
ORDEM DE UMA REAÇÃO
• SOMA DE TODOS OS EXPOENTES QUE
APARECEM NA EXPRESSÃO DA VELOCIDADE
DA REAÇÃO.
• v = k[A]a[B]b[C]c...
• ORDEM = a + b + c + ...
• ORDEM EM RELAÇÃO AO REAGENTE:
EXPOENTE DO PRÓPRIO REAGENTE.
DESCOBERTA DOS EXPOENTES
• DIVIDIR AS VELOCIDADES EXPERIMENTAIS, A
FIM DE OBTER OS COEFICIENTES.
• MONTAR A LEI CINÉTICA.
EXEMPLO
• Dada a reação química genérica a seguir,
determine a lei cinética da reação.
• aA + bB + cC → dD + eE + fF.
RESOLUÇÃO
•
•
•
•
•
•
•
•
DIVIDINDO v1 POR v2:
v1 /v2 = k(2)a(3)b(1)c / k(4)a(3)b(1)c
0,5/20 = 2a/4a
1/4 = 1a/2a
2a = 4
2a =22
a=2
DIVIDINDO v2 POR v3:
v2/v3 = k(4)a(3)b(1)c / k(4)a(6)b(1)c
2,0/2,0 = 3b/6b
1 = 1b/2b
2b = 1
2b =20
b=0
RESOLUÇÃO
•
•
•
•
•
DIVIDINDO v3/v4:
v3/v4 = k(4)a(6)b(1)c / k(4)a(6)b(2)c
2,0/16 = 1c/2c
1/8 = 1c/2c
2c = 8
2c = 23
c=3
v = k[A]2[C]3
MOLECULARIDADE
• NÚMERO MÍNIMO DE PARTÍCULAS
REAGENTES QUE PRECISAM COLIDIR PARA
QUE OCORRA UMA REAÇÃO ELEMENTAR OU
UMA ETAPA DE UMA REAÇÃO NÃO
ELEMENTAR.
• H2(g) + 2NO(g)→ N2O(g) + H2O(l)
• REAÇÃO TRIMOLECULAR
EXERCÍCIO
(UFES) Uma das reações que podem ocorrer no ar poluído é a do
dióxido de nitrogênio, NO2(g), com o ozônio, O3(g):
NO2(g) + O3(g) → NO3(g) + O2(g)
Os dados abaixo foram coletados a 250C.
A expressão da lei de velocidade e o valor da constante de
velocidade são, respectivamente:
EXERCÍCIO (CONTINUAÇÃO)
a)
b)
c)
d)
e)
v = k[NO2] e 2,2 x 107
v = k[O3] e 4,4 x 107
v = k[NO2][O3] e 2,2 x 107
v = k[NO2][O3] e 4,4 x 107
v = k[NO2]+[O3] e 2,2 x 107