CAPÍTULO 3
ÉSTERES
Apresentam a seguinte fórmula geral:
O
R
C
O
R
Métodos de obtenção
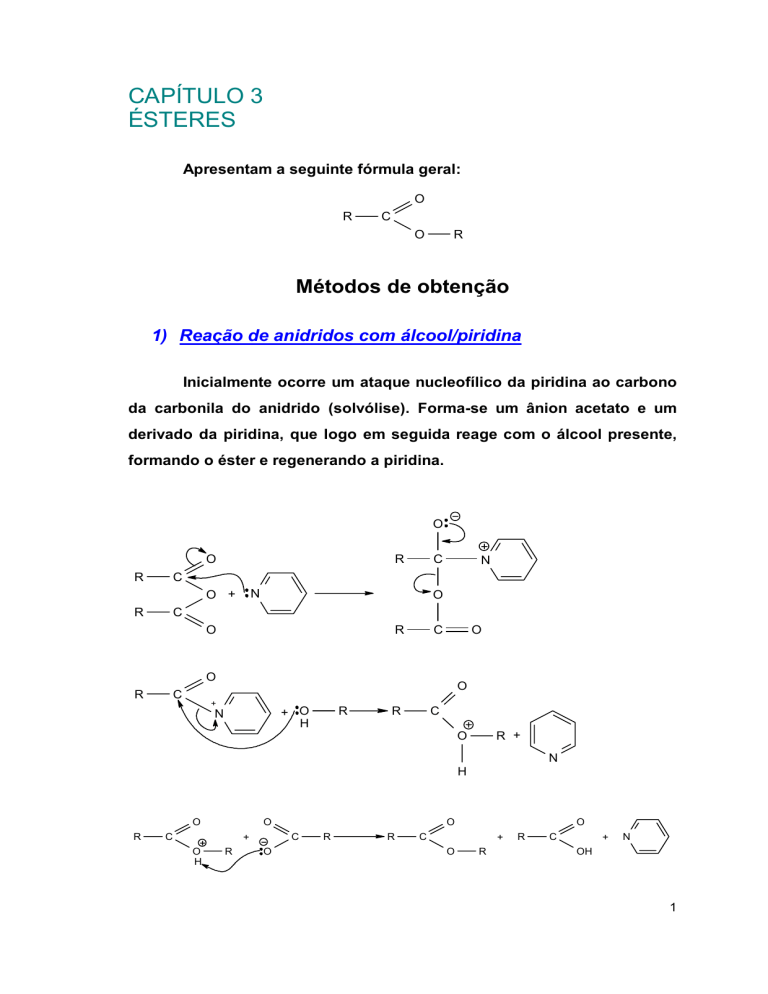
1) Reação de anidridos com álcool/piridina
Inicialmente ocorre um ataque nucleofílico da piridina ao carbono
da carbonila do anidrido (solvólise). Forma-se um ânion acetato e um
derivado da piridina, que logo em seguida reage com o álcool presente,
formando o éster e regenerando a piridina.
O
O
R
R
C
N
C
N
O +
R
O
C
O
R
C
O
O
R
C
O
+
+ O
H
N
R
R
C
R +
O
N
H
O
R
O
C
C
+
O
H
R
O
O
O
R
R
C
+
O
R
R
C
+
N
OH
1
Explique como pode ser sintetizado o propanoato de butila.
O
C
C
C
C
N
+
O
C
O
piridina
C
C
N
C
C
O
O
anidrido propanóico
C
C
C
O
O
C
C
O
C
C
+
N
C
C
O
O
O
C
C
+
C
N
O
H
C
C
C
C
C
C
O
H
O
O
C
N+ C
C
C
O
H
C
C
C
O
C
+
C
C
C
C
O
C
C
O
C
C
propanoato de
butila
C
C
+
C
C
C
C
C
C
O
C
ácido propanóico
OH
2) Reação de Haleto de acila com metóxido de Sódio ou
Etóxido de Sódio.
Essas bases fortes conseguem deslocar a base cloreto dos
cloretos de acila.
O
O
R
C
+
H2
C
O
Cl
CH3
R
+
Na
C
O
C
H2
CH3
Cl
O
R
+
C
+ Na
O
C
H2
Cl
CH3
Esse processo é utilizado para obter ésteres etílicos e/ou
metílicos, com alto rendimento.
2
3) Reação do Brometo de acila com álcoois, que são bases
fracas.
A ligação do cloro com o carbono é muito forte e necessita de
uma base forte para rompê-la.
A ligação do bromo com o carbono é muito mais fraca,
necessitando de uma base fraca para rompê-la.
O
O
R
C
H
O
+
R
R1
C
O
H
Br
R1
Br
O
R
C
O
O
H
R1 +
Br
HBr + R
C
O
R1
4) Reação de anidridos com Éteres/AlCl3 ou FeX3 ou BX3
(1ª)
O
R
O
C
R
R
C
R
FeCl3
O +
O
O
C
R
C
FeCl3
O
C
O
O
O
R
O
(2ª)
R
C
+
O
R
O
C
O
R1
R
O
R 1 + R1
O
C
+
O
C
R1
O
R
C
R1
R1
O
FeCl3
+
FeCl3
R1
R
C
+ FeCl3
O
R1
5) Reações de ácidos orgânicos com Diazometano.
Obtém-se sempre ésteres metílicos com alto rendimento, e gás
nitrogênio.
Ocorre a abstração do próton do ácido, e a rápida ligação do
3
acetato formado com o grupo metil e a formação de gás nitrogênio.
O
O
R
+ H2C
C
N
N
R
C
+ H3C
N
N
O
OH
N2 + H3C
O
O
H3C + R
R
C
C
O
O
CH3
6) Reação de cetenas com álcoois
Esses tipos de reações ocorrem a temperatura ambiente,
formando com facilidade os ésteres correspondentes.
O
R
C
C
O +
H
O
R
R
C
O
C
O
H
R
R
C
C
O
H
R
Β
O
R
C
C
O
R
7) Reação de ácido com álcool (em meio ácido)
É o processo mais econômico para obter éster em laboratório.
Existem dois mecanismos que tentam explicar essa reação.
→ Cisão Alquil/Oxigênio
R
OH + H
+
R
OH2
R
+ H2O
4
O
R
C
O
O
+ R
R
R
C
O
H
O
H
C
O
R
OH2 (ou : Β
R
)
Esse mecanismo é aceito quando os álcoois utilizados são
terciários, pois dão origem a cátions carbonos terciários relativamente
estáveis.
Para álcoois primários, admite-se que, não havendo o rearranjo, a
esterificação ocorra segundo uma cisão acil/oxigênio.
O
R
C
O +H
+
R
O
C
H2O + R
C
OH2
+
OH
O
R
C
O
+ HO
R1
R
B
C
O
H
O
HB + R
C
R1
O
R1
Moura Campos propõe também um mecanismo que utiliza o
oxigênio insaturado do grupo carboxi.
8) Reação de ácidos com alcenos em presença de H2SO4
H3C
CH2 + H
C
H
+
H3C
C
H
CH3
C
O
R
C
O
+
C
OH
C
R
C
C
+
O
H
C
+
C
HSO4
H2SO4
+
R
O
C
O
C
C
C
C
9) Reação de Bayer – Villiger
É utilizada para preparar acetato de fenila. Baseia-se na reação do
perácido benzóico com a acetofenona.
1ª etapa – Ataque nucleofílico ao carbono da carbonila da acetofenona.
5
O
O
O
C
C
+ HO
O
CH 3
C
CH 3
O
H
O
1º
C
O
β
O
O
C
C
+
CH3
OH
O
O
C
O
CH3
H3C
C
O
O
Moura Campos sugere para o mesmo procedimento, o seguinte
mecanismo:
O
R
OH
C
CH3 + H
+
R
C
O
CH3 +
HO
O
OH
C
Ph
R
C
O
O
H
O
C
Ph
CH3
OH
R
O
C
O
CH3
H
O
C
OH
Ph
B
HB + R
C
O
O
O
C
Ph
CH3
6
OH
O
Ph
+ H3 C
C
C
O
H3C
OH
O
H3 C
C
O
R
R
O
H
C
O
O
R
+
O
O
C
Ph
Ph
+ H3 C
C
O
C
O
OH
R
PROPRIEDADES QUÍMICAS DOS ÉSTERES
1) Saponificação
+
+
É a reação de um éster com uma base forte (Na OH ou K OH) .
Forma-se um álcool e um sal orgânico. Dependendo do tamanho do
grupo R do sal, esse composto tem propriedades detergentes.
O
O
R
C
+
O
R
OH
+
Na
R
C
OH
O
R
O
R
O
C
+
OR
R
OH +
R
OH
O
O
R
C
C
O
+
+
Na
O
R
C
O
+
Na
- Represente as reações que permitem obter ao mesmo tempo propanol 2
e pentanoato de sódio.
7
C
C
C
C
O
C
O
C
O
C
+
OH
pentanoato de isopropila
C
C
C
C
C
OH
O
C
+
Na
C
C
C
propanol 2
O
C
C
C
C
C
+ O
C
C
C
C
O
C + C
C
C
C
+
C
OH
+ Na
O
C
OH
O
C
C
C
C
pentanoato de sódio
C
+
O Na
2) Reação com aminas
São semelhantes às reações de saponificação levando à formação
de álcoois e amidas substituídas.
O
O
R
C
+
O
R
N
H2
R
R
C
O
H2 N
R
R
O
O
R
C
N
H2
R
+
O
R
R
OH + R
C
N
R
H
Explique como podemos obter ao mesmo tempo butanol 2 e N, N
dipropil butanoamida
8
O
O
C
C
C
H
+ N
C
O
C
C
C
C
C
C
C
C
C
H
N
C
C
C
C
C
O
C
C
C
C
C
C
C
C
C
butanoato de secbutila
C
O
C
C
C
C
C
C
C
O
N
H
C
C
C + O
C
C
C
C
C
C
C
N
C
C
C
C
C
C
C
OH
(butanol 2)
+
C
C
C
C
Identifique os produtos formados ao reagirmos pentanodiato de metila
com etil amina.
O
H
O
C
C
C
C
C
+2 N
C
O
O
H
O
C
C
C
C
C
C
C
C
C
C
C
C
N
H2
C
C
+2 O
N
H2
C
C
C
O
C
C
O
C
O
C
NH2
C
O
C
C
C
H2N
C
O
C
O
O
C
C
C
+ 2 HO
C
N
H
N
H
C
C
C
3) Reação com hidroxi amina
Nesse caso forma-se um álcool e uma N – hidroxi amida
9
O
O
R
C
+
O
R
N
H2
OH
R
C
O
H2N
R
OH
O
R
O
C
+
N
H2
O
R
R
OH +
R
C
OH
N
H
OH
4) Éster Dietil Malônico e Carbamida
H2
N
O
C
O
Et
H2C
C
+
O
2EtOH
+
O
H
C
N
H2C
C
O
O
C
O
N
H2
Et
Tautomeria
O
H
N
N
H2C
C
C
N
OH
OH
C
C
O
O
N
N
OH
OH
"ácido
barbitúrico"
5) Éster etílico com etóxido de sódio
Serve para obter β ceto ésteres
Suponhamos a reação do acetato de etila com etóxido de sódio.
Se esta reação ocorrer segundo o mecanismo convencional, não haverá
formação de nenhuma espécie química nova.
10
O
O
H3C
C
+
O
C
H2
O
CH3
C
H2
CH3
C
C
O
C
O
C
C
C
O
H3C
C
+
O
C
H2
O
CH3
C
H2
CH3
O carbono α do éster, devido ao efeito indutivo da carbonila tem
densidade eletrônica baixa. A base etóxido presente retira este próton
com facilidade porque ele está fracamente ligado ao carbono α. Forma-se
um ânion carbônio, que faz um ataque nucleófilo à carbonila de outra
molécula do éster, levando à formação de um β ceto éster e da base
etóxido.
O
H2 C
H
C
O
OEt
+
EtOH + H2C
OEt
C
OEt
O
O
O
C
O
C
CH2 +
CH3
C
EtO
EtO
C
C
C
EtO
OEt
O
O
C
EtO
C
H2
C
CH3
+ EtO
Numa última etapa a base etóxido retira um próton do β ceto-éster
dando origem a um álcool. Acidulamos e temos a formação do produto
final.
11
H
O
C
C
O
C
CH3
O
EtO
C
H
O
C
C
C
CH3 +
C
OH
EtO
+
O
C
C
H
O
C
C
C
O
+
CH3 + H
C
E tO
Et O
H
O
C
C
CH3
H
3 ceto, butanoato de etila
(β ceto butirato de etila)
Quais seriam os produtos formados se utilizássemos como
reagentes metóxido de sódio e butanoato de metila?
O
C
C
C
O
C
O
+
O
C
H3C
CH3
OH + C
C
C
C
O
Na
H
C
O
O
C
C
O
O
C
C
C +
O
C
C
C
C
C
C
C
O
C
C
C
C
O
C
C
C
O
C
C
C
O
O
C
C
C
C
C
C
O
C
C
C
C
C + O
CH3
C
O
C
H
C
C + H3C
OH
O
C
C
O
C
C
C
H
C
O
C
C
C
O
C
C
C
O
C
+
C + H
C
C
O
C
C
C
O
2 etil, 3 ceto hexanoato
de metila
6) Éster malônico
12
O hidrogênio do carbono α deste éster está fracamente ligado ao
mesmo, devido à ação das duas carbonilas: qualquer base forte pode
retirar um desses prótons, dando origem a um ânion carbônio que se
estabiliza por ressonância. (duplamente estabilizado)
O
O
C
C
OEt
H
C
OEt
+
H
OH
H2O +
C
O
H
O
C
C
OEt
OEt
Obs: a base presente também pode “atacar” o carbono da
carbonila. Para diminuir esta probabilidade, utiliza-se o éster etílico ou
metílico.
A obtenção do ânion é importante porque serve para obtermos
novas ligações entre carbonos.
Exemplo 1:
Se misturarmos uma solução, que contenha esse ânion com um
haleto orgânico, obteremos um derivado do éster malônico.
O
O
C
C
OEt
C
+
O
H
C
δ+
H3C
I
δ-
H3C
I
+
OEt
C
O
H
C
OEt
OEt
Éster metil dietil malônico
ou
Metil, malonato de dietila
Exemplo 2:
Reação do éster malônico em meio básico com cloreto de acetila.
13
O
O
O
O
C
H3C
C
C
OEt
OEt
C
+
C
O
H
C
Cl +
CH3
C
O
O
H3C
O
H
Cl
OEt
C
OEt
C
OEt
C
C
Cl
O
H
C
OEt
Obs: Descarboxilação
Ocorre com certa facilidade quando tivermos duas carboxilas
ligadas num mesmo carbono.
O
O
C
C
OH
C
O
∆
H2C
O
OH
H3C
+ CO2
OH
+
C
C
O
OH
C
HO
Aplicação
O que ocorre quando tentamos descarboxilar o éster acetil dietil
malônico?
1)
trata-se esse éster com uma base.
2)
sal formado é tratado com um ácido inorgânico.
3)
O ácido acetil malônico obtido é aquecido dando origem a um β ceto
ácido.
14
éster acetil dietil malônico ou acetil malonato de dietila
O
O
H
C
C
O
C
+ 2 OH
O
C
∆
C
+ 2H
+
O
O
CH3
C
O
OEt
CH3
C
C
O
OEt
Observação: a base
OH também pode abstrair o próton do
carbono α formando outro produto.
O
C
O
C
O
OH
C
∆
O
CH3
CO2
+
H3C
C
O
C
H2
C
C
OH
Ácido 3 ceto (β ceto)
butanóico
ou
Ácido β ceto butírico
OH
- Identificar X, Y, Z na seqüência reacional:
O
O
C
C
OEt
C
NaOH
C
C
C
C
X
HCl
Y
Z
∆
O
C
OEt
O
O
O
O
C
C
C
C
C
C
C
C
OEt
O
C
+ 2 OH
+
Na
C
+
O Na
+ 2 HO
C
C
C
Et
O
C
C
C
OEt
+
O Na
X
15
O
O
O
O
C
C
C
C
O
C
C
C
C
OH
+
C
+ 2 HC l
O
C
C
+
Na
C
C
+ 2 Na C l
O
C
C
C
O Na+
O
C
OH
Y
O
C
C
O
O
OH
C
C
C
-
O
C
∆
CO2 + C
C
C
C
OH
C
C
OH
Z
C
C
ácido α propil,
β ceto butanóico
ou
Ácido α propil
β ceto butírico
O aquecimento da 2 carboxi, 2 aceto carboxi, ciclo hexanona 1
também leva a descarboxilação.
O
O
O
C
C
O
C
OH
C
O
C
OH
∆
OH
CO2 +
H
2 aceto carboxi
ciclo hexanona 1
7) Clivagem de β ceto ésteres.
Esses compostos, ao reagirem com bases diluídas e concentradas,
formam produtos diferentes. Por exemplo: se a base for diluída teremos
uma reação de saponificação comum. Se reagirmos o β ceto éster com
soda cáustica concentrada e quente, teremos duas possibilidades de
16
reação.
O
H
O
O
C
C
C
O
2
C
H3C
C
C
C
H
+ EtOH
-
+
O Na
OEt
2
1
2
OH (diluída)
OH (concentrada)
1
O
C
H2
C
C
O
O
C
H3C
C
O
C
+ H2C
OEt
C
OH
OEt
OH
O
H3C
C
O
C
+ H3C
+
C
O Na
OEt
Aplicação
Existe um β ceto éster chamado 2 ceto ciclo hexil, metanoato de
etila. Esse composto ao ser tratado com soda cáustica concentrada e
quente dá origem a um derivado de cadeia alifática.
O
HO
C
OE t
+
O
OH
+
Na
C
O
O
OEt
O
OH
O
C
O
OEt
C
C
C
C
C
C
+ H
OEt
O
O
C
O
O
C
C
HO
C
C
C
C
C
OEt
Heptanodiato monoácido de Etila
A base
OH
também pode “atacar” o carbono de carbonila do
17
éster, diminuindo o rendimento do processo.
Exercícios
1)
A reação do anidrido 2 metil pentanóico com butanol 2/piridina forma
um ácido e um éster. Represente, com mecanismos, esta preparação.
2)
Ao reagirmos brometo de 2 etil pentanodiila com excesso de etóxido
de sódio obtemos um sal e um éster. Represente, com mecanismos,
esta preparação.
3)
Quando colocamos a reagir brometo de 2 etil pentanodiila com
excesso de fenil metanol obtemos um HX e um éster. Represente,
com mecanismos, esta preparação.
4)
Em presença de FeBr3, anidrido hexanóico reage com éter
disecbutílico originando um éster. Represente com mecanismos, esta
preparação.
5)
A benzil cetena quando colocada a reagir com ligeiro excesso de fenil
metanol forma um éster. Represente, com mecanismos, esta
preparação.
6)
A reação do ácido 3 metil pentanóico com 2 metil propanol 2/H+
origina um éster e água, através de uma cisão “alquil – oxigênio”.
Represente, com mecanismos, esta obtenção.
7)
A reação do ácido metil butanodióico com 2 metil propanol 1/H+
origina um éster e água, através de uma cisão “acil – oxigênio”.
Represente, com mecanismos, esta obtenção.
8)
Ao reagirmos o ácido oxálico (etanodióico) com excesso de buteno
2/H+, obtemos um éster. Represente, com mecanismos, esta
obtenção.
9)
Numa industria existe um tanque esférico de 3m de diâmetro,
contendo anidrido butanóico (d = 0,880 g/L) até 7/8 de sua
capacidade. Existe também um outro tanque cilíndrico (d = 2m; h =
3,5 m) contendo éter diisopropílico (d = 0,805 g/mL) até 8/9 de sua
capacidade. De que modo estas espécies químicas devem ser
misturadas para que a reação química entre elas (em presença de
FeCl3) forme a maior quantidade possível de éster, com R = 85%?
10) Represente com mecanismos, a equação da reação que ocorre
quando colocamos a reagir 2 etil hexanodiato de butila com excesso
de soda cáustica.
18
11) Idem quando o éster é o 2 etil pentanoato de benzila.
12) Ao reagirmos um óleo vegetal denominado “triestearato de glicerila”
com excesso de potassa cáustica, obtemos glicerina (propanotriol) e
um sal orgânico (sabão) com E = 90%. Para a fabricação de 150.000
barras desse sabão, de 80g cada uma, pede-se:
a- o mecanismo;
b- as massas das espécies envolvidas;
c- o volume de solução 11 N de base necessário.
13) Ao reagirmos butanodiato de etila com excesso de benzil amina
obtemos uma amida e um álcool. Para o aproveitamento de 60
tambores contendo o éster inicial (d = 0,970 g/mL) e supondo-se E =
93%, pede-se:
a- o mecanismo;
b- as massas das espécies envolvidas.
14) Uma indústria precisa obter 7500 L de butanol 2 através de reação
entre álcool e a hidroxiamina. Supondo-se R = 84%, pede-se:
a- o mecanismo;
b- as massas das espécies envolvidas.
15) A reação entre o éster propil, butil malônico (dietil) com a uréia forma
um “ácido barbitúrico”, com E = 80%, que é utilizado na forma de
comprimidos, como medicação de ação calmante. Para a fabricação
de 4 x 109 comprimidos de 500 mg cada um, contendo 10% deste
princípio ativo, pede-se:
a- o mecanismo;
b- as massas das espécies envolvidas.
16) A reação de ésteres etílicos com etóxido de sódio origina “β ceto
ésteres”. Baseando-se nesta informação, represente, com
mecanismos, as espécies obtidas quando colocamos a reagir etóxido
de sódio com pentanoato de etila. Calcule, supondo R = 78%, as
massas das espécies envolvidas para produzir 10000 L do β ceto
éster em questão (d = 1,067 g/mL).
17) A descarboxilação ocorre com certa facilidade, sob a ação do calor,
quando temos duas carboxilas ligadas a um mesmo átomo de
carbono. Represente, com mecanismos, as descarboxilações:
a- ácido isopropil malônico (propanodióico);
b- ácido secbutil, acetil malônico.
19
18) A clivagem de β ceto ésteres ocorre em presença de bases fortes
concentradas, sob a ação do calor. Represente, com mecanismos, a
clivagem do β ceto pentanoato de propila em presença de potassa
cáustica concentrada. Calcule as massas das espécies envolvidas,
com R = 90%, para o aproveitamento de 2500 L de solução 14 N da
base em questão.
19) A hidrólise ácida do 1,4 diciano butano origina NH3 e um diácido
orgânico. Em seguida este diácido foi colocado a reagir com excesso
de butanol 1/H+, dando origem a um éster e água. Finalmente, o éster
foi posto a reagir com excesso de soda cáustica, formando um sal
orgânico e um álcool. Para a obtenção de 2000 L de solução 5 N
contendo este sal orgânico. Pede-se:
a- os mecanismos;
b- as massas das espécies envolvidas.
20) Num certo procedimento, colocamos a reagir 2000 L de butanoato de
metila (d = 0,920 g/mL) com metóxido de sódio, havendo formação de
um β ceto éster, que numa fase seguinte, foi posto a reagir com
solução 12 N de soda cáustica. Sabendo-se que 70% deste β ceto
éster reagir segundo um processo de “clivagem” e que os 30%
restantes segundo o mecanismo tradicional, pede-se:
a- os mecanismos;
b- as massas das espécies envolvidas;
c- o volume de solução básica utilizado.
NOÇÕES DE SÍNTESE ORGÂNICA
ACETATO DE AMILA
1 – Reagentes
Álcool amílico: 27,0 mL (d = 0,832 g/mL)
Ácido acético glacial: 15,0 mL (d = 1,05 g/mL)
Ácido sulfúrico concentrado: 1,0 mL (d = 1,84 g/mL)
2 – Espécies complementares
Solução de carbonato de sódio a 10%
Sulfato de sódio anidro
20
3 – Técnica
Em um balão de 250 mL, colocar 27,0 mL de álcool amílico, 15,0
mL de ácido acético glacial e 1,0 mL de ácido sulfúrico concentrado.
Ao balão, colocado sobre uma fonte de aquecimento, adaptar um
separador de Dean Stark, e a este, um condensador de refluxo.
Aquecer a mistura durante 45 min, sendo que, por ser mais densa,
a água formada irá ficar retida no tubo coletor.
Adicionar 15,0 mL de solução de Na2CO3 a 10%, com agitação.
Verificar o pH da fase aquosa (que deverá estar ligeiramente alcalino).
Decantar, transferindo o produto para um erlenmeyer contendo 5g
de Na2SO4 anidro. Fechar o erly e agitar periodicamente durante 15
minutos.
Filtrar com papel pregueado (seco), diretamente para um balão de
destilação seco.
Aquecer, recolhendo o produto que destila entre 148/149°C.
4 – Reação (R = 80%)
O
H 3C
C
+ H3C
OH
(CH2)3
CH2OH
H2SO4
O
H3C
C
+ H2O
O
(CH2)4CH3
5 – Constantes físicas
Líquido incolor, com odor de essência de banana; PE = 149°C; d20
=0,875 g/mL; solúvel em etanol, éter etílico e acetato de etila. Muito pouco
solúvel em água.
6 – Equipamento
21
7 – Questões
1)
Represente o mecanismo deste procedimento.
2)
Se existir reagente em excesso, quantificá-lo.
3)
Qual a % de catalisador utilizada, em função dos reagentes
presentes?
4)
Quais as massas dos produtos obtidos?
5)
Dentro das proporções estequiométricas, quais massas das espécies
envolvidas para a obtenção de 5000 L de éster?
6)
Idem, dentro das proporções do processo.
7)
Qual a função da solução de Na2CO3 a 10%?
8)
Qual a função de Na2SO4 anidro?
9)
De que modo a água é separada neste procedimento?
10) Como podemos avaliar o grau de pureza do éster obtido?
22
NOÇÕES DE SÍNTESE ORGÂNICA
SÍNTESE DO FTALATO DE DIMETILA
1 – Reagentes
anidrido ftálico: 50,0g.
Álcool metílico (metanol): 100,0 mL (d = 0,810 g/mL).
H2SO4 concentrado: 8,0 mL (d = 1,84 g/mL)
2 – Espécies complementares
Solução aquosa de Na2CO3 saturada.
CaCl2 anidro.
Água destilada.
3 – Técnica
Num balão de 250 mL, colocar 50,0 g de anidrido ftálico. Num
erlenmeyer de 250 mL colocar 100 mL de metanol, adicionando aos
poucos, sob corrente de água, os 8,0 mL de H2SO4 concentrado.
Transferir a mistura metanol/H2SO4 para o balão onde se encontra
o anidrido ftálico. Adaptar um condensador de refluxo e aquecer em
banho maria durante 120 minutos, sob agitação moderada. Retirar o
condensador de refluxo, e substituí-lo por um sistema para destilar o
excesso de metanol.
Verter o éster obtido em 100 mL de água destilada fria e transferir
esta mistura para um funil de separação.
Decantar o éster obtido. Neutralizar com solução de Na2CO3
saturada, controlando o pH final. Lavar com água destilada. Dessecar
com CaCl2 anidro e filtrar.
4 – Constantes físicas
Líquido oleoso, ligeiramente aromático; PE = 283,7°C; d20 = 1,194
g/mL, solúvel em etanol, éter etílico e clorofórmio. Pouco solúvel em
23
água.
5 – Questões
a) Representar o mecanismo deste procedimento.
b) Se existir reagente em excesso, quantificá-lo.
c) Quais as massas dos produtos obtidos, supondo-se R = 79%?
d) Dentro das proporções estequiométricas, quais as massas das
espécies necessárias para a obtenção de 2000 L deste éster?
e) Dentro das proporções do processo, quais as massas das
espécies necessárias para a obtenção de 3000 L deste éster?
f) Porque a adição do H2SO4 no metanol deve ser lenta?
g) Porque o éster obtido é colocado em água destilada?
h) Porque o éster obtido é “lavado” com água destilada?
i) Quais as funções do CaCl2 e da solução saturada de Na2CO3?
24
CAPÍTULO 4
AMIDAS
São
os
compostos
derivados
dos ácidos orgânicos pela
substituição da hidroxila por um grupo “NH2”
Processos de obtenção
1) Amonólise de Brometos de acila
Trata-se de uma reação de substituição nucleofílica, onde o
amoníaco é o agente nucleofílico.
O
R
δ
O
+
C
O
O
+
NH3
Br
R
C
NH3
R
+
C
Br
HBr + R
C
NH2
NH3
Br
→ Por aquecimento ou neutralização elimina-se o HBr
2) Aminólise de haletos de acila.
Esse processo serve para obter amidas substituídas.
O
R
δ
O
+
C
O
+
Cl
N
H2
R
R
C
N
H2
R
Cl + R
C
N
H2
Cl
R
O
HCl + R
C
N
R
pode ser neutralizado
3) Amonólise de cetenas.
O
R
H
C
+
δ
C
O + NH3
R
H
C
C
NH3
25
O
H
C
R
H2
C
R
C
O
C
NH2
NH3
B
(Pode ser outro mol de NH3 )
4) Aminólise de cetenas
Esse processo também serve para obter amidas substituídas.
O
R
H
C
C
R
H
C
C
O +
N
H2
R
R
C
H
C
H2
C
C
O
N
H2
R
O
R
N
H2
R
N
H
R
B
Complete a equação química:
Y
cetena
N - Benzil, N - Metil Hexanoamida
Resolução:
O
H
C
C
C
C
C
C
O +
N
C
C
C
C
C
C
H
H
N
C
C
C
C
C
C
C
H
C
O
C
C
N
H
C
C
C
C
C
O
H2
C
C
C
N
C
C
B
5) Amonólise de anidridos
O
R
O
R
NH 3
O
O
R
C
C
+
O
NH 3
R
C
NH3
C
O
R
C
O
+
R
C
O
O
26
O
R
O
C
+ R
C
NH2
OH
→ Quais são os produtos formados na amonólise dos seguintes
anidridos:
(a) Anidrido butanodióico
O
O
C
O
C
C
C
O + NH3
C
C
O
C
C
O
NH3
O
C
NH3
O
C
C
C
C
O
C
C
C
HO
NH2
O
O
O
C
C
C
C
C
O
C
C
NH2 + OH
NH2
∆
O
C
C
NH2
C
O
O
C
C
O
H2O +
C
OH
C
NH
C
O
C
O
butanoimida
ou
succinimida
OH
Outro mecanismo sugerido para esta transformação é:
O
O
C
C
C
C
NH2
C
C
O
C
C
H
O
segue o procedimento
proposto anteriormente!
1º
O
H
O
NH2
(b) Anidrido Ftálico
O
O
C
C
O
C
O
+ NH3
NH3
O
C
O
27
O
O
O
C
NH3
C
NH2
C
C
O
C
OH
C
NH2
OH
O
O
O
O
O
C
C
NH2
C
+ OH
NH
H2O +
C
O
O
ftalimida
6) Aminólise de anidridos
O
O
R
C
R
C
R
+ N
H2
O
R
C
N
H2
R
O
O
R
C
O
O
R
O
C
O
N
H2
R
+ R
C
O
R
C
O
N
H
R + R
C
OH
→ Qual é a imida formada na reação entre o Anidrido Ftálico e a Bi fenil
amina?
Resolução:
O
O
C
O
+
H
N
O
C
O
H
N
C
C
O
28
O
O
C
C
N
C
O
C
O
HO
O
O
O
C
N
OH +
Ph
C
HO
Ph
C
Ph
N
Ph
C
O
O
O
O
C
C
Ph
OH +
N
C
∆
N
H
N
+ OH
C
Ph
Fenol
O
O
N - Fenil Ftalimida
→Completar as seguintes equações químicas:
P2O5
∆
ácido orgânico
C
C
C
C
C
amina
X
O
O
C
+
OH
C
2,2 dimetil pentanoamida e
àcido 2,2 dimetil pentanóico
O
P
O
O
P
C
∆
C
C
O
C
C
C
O
O
H
C
O
C
C
P
O
O
O
P
O
O
O
C
C
C
C
C
+
HO
P
O
C
C
C
O
O
O
C
P
C
C
C
O
C
C
+
C
C
C
C
HO
C
C
29
C
C
C
C
O
C
C
O
H
O
C
C
C
C
C
C
C
C
-H
+
C
O
C
C
C
C
C
anidrido
2,2 dimetil
pentanóico
C
O
C
C
C
C
C
C
C
O
C
C
C
C
O
O
C
C
C
C
C
O
C
C
C
C
C
O
C
C
C
C
O
+
C
C
C
C
C
O
C
C
O
C
C
C
C
C
C
C
O
NH3
C
C
C
O
C
C
O
C
C
NH3
C
C
C
C
C
+ NH3
C
C
C
C
+
NH2
C
C
ácido 2,2 dimetil pentanóico
C
O
C
C
C
C
OH
C
2,2 dimetil pentanoamida
7) Reação de Schmidt
Utiliza-se uma cetona como produto inicial. Dissolve-se a cetona
numa solução aquosa ácida, a qual se adiciona “azoteto de hidrogênio”.
Ocorre uma reação de adição nucleofílica do nitrogênio ao carbono, a
30
eliminação de nitrogênio (N2) e a migração de um grupo alquil ou aril. O
produto final é uma Amida Substituída.
R
C
O
+ H
R
R1
C
OH + N
H
R1
H
N
N
N
N
N
OH
R
C
OH
N2 + R1
∆
OH
C
R1
N
H
R1
R
N
H
OH
R1
R
O
C
+ Cl
N
H
C
HCl + R1
C
R
N
H
R
pode ser
neutralizado
Qual a amida formada se utilizarmos como produto inicial a
acetofenona (metil, fenil cetona)?.
O
C
OH
C + H
C
C + N
H
N
N
A representação inicial deste mecanismo também poderia ser:
O
C
OH
CH 3 + H
C
CH 3 +
N
N
N
H
OH
OH
C
C
C
N
H
N
N
N
H
C + N2
31
OH
C
O
C + Cl
N
H
HCl +
C
N
H
C
N - Metil benzamida
8) Aminas / PCl3 / ácidos orgânicos.
Primeiro há um ataque nucleofílico da amina ao PCl3.
H
H
Cl
R
N
H2
+
P
Cl
Cl
R
N
+
P
Cl
Cl
HCl
+
R
N
PCl2
Cl
H
H
H
Cl
H
N
P
N
H
Cl
H
N
P
N
R
P
N
R
Cl
R
N
H2
+
R
N
+
P
R
R
+
Cl
HCl
+
R
Cl
H
H
R
H
N
P
H
N
R
∆
R
H
N
P
N
Cl
R
+
Cl
HCl
+
R
N
H
Em seguida, o ácido reage com o fosfazo composto formado,
levando à obtenção da amida substituída.
O
O
R
C
H
+ N
R
P
N
R
C
H
N
R
OH
P
N
R
P
N
OH
R
O
R
C
N
P
H
O
R
N
R
R
C
+
N
H
R
R
32
P
N
R
+
OH
P
N
R
OH
Numa terceira etapa, uma outra molécula de ácido reage com a
amina fosforada.
O
O
R
C
+ N
R
R
C
N
R
OH
P
OH
OH
P
OH
O
R
O
C
+
OH
R
C
N
R
N
R
P
OH
P
OH
O
O
R
R
C
+
N
C
OH
N
R
P
OH
R
HO
P
OH
O
R
O
C
+
N
HO
P
OH
R
+ HPO2
C
R
N
H
Represente
todas
as
etapas
da
reação
R
que
ocorre ao
misturarmos Pentil amina, PCl3 e ácido benzóico.
C
C
C
C
C
NH2 + PCl3
- 3HCl
C
C
C
C
C
H
N
P
N
C
C
C
C
C
dipentil fosfazo
33
C
C
C
C
O
H
N
C
P
N
C
C
C
C
C
C +
HO
O
C
C
C
C
C
C
C
C
C
C
N
C
P
OH
N
O
OH + C
C
C
C
C
N
C
P
C
C
C
C
C
N
O
C
N
C
C
C
C
C + C
C
C
C
C
N
P
P
OH
N - Pentil benzamida
C
C
C
C
C
N
P +
OH
C
C
C
C
C
N
O
O
C
C
C
C
C
N
P
OH +
C
C
C
C
C
C
N
C
HO
P
OH
HO
O
O
C
C
C
C
C
N
HO
P
C
+
OH
C
C
C
C
C
N
C
HO
P
OH
O
C
C
C
C
C
N
C
+
HO
P
OH
34
O
C
HPO2 +
N
H
C
C
C
C
C
9) Amonólise de Ésteres
Leva à formação de amidas substituídas e de álcoois.
O
O
R
O
C
+ N
H2
R1
O
R2
R
R1
C
N
H2
R2
R
C
+
N
H2
O
O
R1
R2
O
R
C
+ R1
N
H
OH
R2
10) Hidrólise de nitrilas em meio básico inicial.
R
δ+
C
N +
OH
R
C
N + H
R
C
OH
NH
OH
O
R
C
NH
R
C
N
H
R
C
NH2
OH
OH
Β
Se o meio reacional for apenas básico:
+ Na OH
R
C
N
+
Na +
OH
+
OH
R
C
N
OH
35
R
C
N
+
H
OH
R
C
OH
NH
+
OH
OH
O
R
C
NH
+
OH
R
C
+
H
OH
OH
NH
O
O
H
R
C
NH2
PROPRIEDADES QUÍMICAS DAS AMIDAS
1) Propriedades ácidas e básicas
A definição de ácidos e bases segundo Bronsted é a seguinte:
ÁCIDO: é toda espécie química que perde prótons.
BASE: é toda espécie química que recebe prótons.
De acordo com essa definição, as amidas apresentam caráter
anfótero, isto é, podem atuar como ácido ou como base, dependendo da
outra espécie química presente.
O
R
C
O
+ H
R
C
NH2
NH3
base
O
R
O
C
+
N
ácido
H
OH
H2O + R
Na
R1
C
N Na
R1
2) Desidratação
A desidratação das amidas é realizada em presença de
oxicloreto de fósforo, sob refluxo.
36
O
O
O
R
C
+
PCl 2
R
C
PCl 2 +
O
Cl
NH2
Cl
NH2
O
R
C
O
O
P Cl 2 +
Cl
HCl + R
C
O
PCl 2
NH
N
H2
alguns autores propõem
a protonação deste oxigênio,
o que tornaria a reação
mais fácil de ocorrer!
O
R
C
NH +
O
O
PCl2
R
N + HO
C
cianeto
orgânico
ou nitrila
PCl2
hidroxi, oxi
cloreto de
fósforo
A hidrólise ácida de cianetos orgânicos leva à formação dos
ácidos orgânicos correspondentes. Explique, com reações a seguinte
seqüência.
OPCl 3
amida
nitrila
H2O
H
ácido 2 etil hexanóico
+
O
O
O
C
C
C
C
C
C
+
PCl2
C
C
C
C
C
C
O
C
NH2
PCl2
NH2
Cl
C
C
C
O
C
C
C
C
C
C
C
NH2
C
O
PCl2 + Cl
O
HCl + C
C
C
C
C
C
C
NH
O
PCl2
C
37
O
C
C
C
C
C
C
NH + O
PCl2
C
C
cianeto orgânico
HO
PCl 2 + C
C
C
C
C
O
C
N
C
C
C
C
C
C
C
C
C
C
N +H
+
C
C
C
C
C
C
NH + OH2
C
C
C
1º
Β
OH2
C
C
C
C
C
C
C
NH
C
C
C
C
C
C
C
NH2
OH
C
O
C
C
C
C
C
C
C
NH2
C
C
C
C
C
NH2
C
C
OH
Β
C
C
2 - etil hexanoamida
38
O
O
C
C
C
C
C
C
+ OH 2
C
C
C
C
C
C
C
C
NH 2
C
C
OH2
NH2
O
C
C
C
C
C
C
O
+ NH2
NH3 + C
C
C
C
C
C
OH2
OH
C
C
C
C
O NH 3 formado reage com HCl formando H 4N Cl (sólido).
Observação: a sacarina é obtida utilizando o benzeno como
produto inicial, através da seguinte seqüência operacional simplificada:
CH3
+
H3C
CH3
X
Cl
SO3H
H2SO4 /SO3
AlCl3
X
CH3
CH3
SO3H
O
CH3
SO3H
KMnO4
H
C
qualquer
processo de
obtenção
de amidas
O
C
OH
+
SO3H
NH2
SO3H
39
O
C
O
O
C
C
NH2
S
O
-H2O
NH2
∆
S
OH
O
O
S
O
O
O
sacarina
(pouco solúvel
em água)
O
O
C
C
+
NH + Na OH
+H2O
N Na
S
O
NH
OH
S
O
O
O
sacarina, em forma de sal de sódio,
solúvel em água. 300 vezes mais
doce que o açucar.
3) Redução com hidretos
As amidas na presença de H / H
perdem água, dando origem às
aminas correspondentes.
O
OH
O
R
C
+
H
R
+
C
H + H
R
C
H
NH2
NH2
R
C
NH2
+
OH
R
C
H
NH2
NH + H2O
H
H
R
C
H
NH +
H
R
C
+
NH + H
R
C
H2
NH2
H
40
Uma outra proposta para este mecanismo seria:
OH
O
R
OH
C
+
H
R
C
+
NH2
H
R
C
H
NH2
NH2
H
R
C
H
N
H
+
OH
H2O
+
R
C
H
NH
+
H
R
C
H2
NH2
C
NH2
H
H
R
H
C
NH2
R
C
NH2
+
H
R
4) Conversão para aldeídos ou cetonas
Neste processo, utilizam-se amidas substituídas. Para obter
aldeídos, reage-se as amidas com hidretos. O ataque nucleofílico do H
à carbonila leva à rápida formação do aldeído correspondente. Por
destilação separam-se os produtos.
As cetonas são obtidas reagindo-se a amida substituída com
compostos de Grignard ( R
δ+
MgX )
O
O
R
O
C
+
N
H
R
C
N
Me
R
Me
aldeído
Me
R1
N
Me
Me
O
O
Me
C
+
N
+
H
H
R
C
Me
Me
MgCl
δ+
R
C
N
Me
MgCl
Me
R1
41
O
O
Me
R
C
N
R1
MgCl
Me
R
C
Me
Me
δ−
N
Me
R1
+
ClMg
N
Me
cetona
Me
δ+ δ−
+ HOH
HN
+
Mg (OH) Cl
Me
MgCl
δ+
Observação: Uma outra proposta para este mecanismo está
representada no ítem “10” deste capítulo. Vejam!
5) 3 fenil propenoamida
O
C
C
C
NH2
Em
quais
posições
ocorrem
as
substituições
no
núcleo
benzênico?
A ressonância que prevalece nesse composto é a seguinte:
O
C
C
C
NH2
Se esta hipótese for verdadeira, teremos o seguinte híbrido de
ressonância:
δ
+
R
δ+
δ
+
Quando reagimos esse composto com HNO3 / H2SO4, obtemos um
alto rendimento de compostos substituídos na posição meta, o que
42
indica que a ressonância que predomina é a representada anteriormente.
As mesmas considerações são válidas para a N – Fenil Acetamida,
comercialmente chamada de acetanilida:
O
C
C
N
H
6) Acetanilida
Para esse caso as reações de substituição ocorrem com
rendimento apreciável nas posições orto, para, indicando que a
ressonância predominante é a seguinte:
O
C
C
δ−
δ−
R
N
H
δ−
7) Reação com R – COOH
São reações de dupla-troca que ocorrem na temperatura de
ebulição da mistura.
Esse processo tem interesse prático quando os produtos
obtidos têm pontos de ebulição bem diferentes e podem ser separados.
O
R
O
C
NH2
R
C
O
+
OH
R1
C
NH2
O
C
R1
HO
Observação: O mecanismo deste procedimento é semelhante ao
ítem “2” da obtenção de anidridos! Vejam!
43
Exemplo 1:
O
H
O
C
+ H3C (CH2)7
CH
CH
(CH2)7
C
NH2
OH
exemplo 1)
formamida ou
metanoamida
ácido octadeceno 7, óico
O
H
C
O
+ H3C (CH2)7
CH
CH
(CH2)7
C
OH
NH2
ácido fórmico
octa deceno 7, amida
Exemplo 2:
H2N
O
Ph
C
O
C
+
OH
O
Ph
H2N
C
NH2
+ CO2 + NH3
(g)
(g)
O
H2N
C
OH
ácido carbâmico
(muito instável)
Exemplo 3:
H2N
O
C
C
+
OH
O
C
O
NH2
H2N
N
+ CO2 + NH3
(g)
(g)
N
Observação:
Os
mecanismos
destes
procedimentos
são
semelhantes ao ítem “2” da obtenção de anidridos! Vejam!
8) Hidrólise ácida e básica
Nessa hidrólises, formam-se como produtos finais os ácidos
orgânicos correspondentes.
No caso da hidrólise ácida, a primeira etapa é um ataque eletrófilo
do H+ ao oxigênio da carbonila. Na hidrólise básica a primeira etapa é um
ataque nucleófilo do OH
ao carbono da carbonila.
44
Ácida:
O
R
C
OH
OH
+ H
R
R
C
NH2
C
NH2
NH2
OH
OH
R
C
+
OH2
R
C
NH2
O
H
B
NH2
H
OH
R
OH
C
NH2
+
H
R
C
OH
OH
NH3
NH3
O
C
+
+
C
OH
B
HB +
R
C
OH
NH3
R
OH
OH
R
+
OH
HCl
H4N Cl
Básica:
O
O
R
C
O
+
OH
R
C
NH2
OH
R
C
+
NH2
OH
NH2
Neutralizando o meio reacional:
Na NH2 + HCl
NH3 + HCl
+
Na
Cl
-
+ NH3
H4N Cl
45
9) Reação com hipohalitos – Rearranjo de Hoffman.
A primeira etapa é uma adição nucleófila do nitrogênio ao
bromo do ácido hipobromoso, com eliminação da base
OH ,
e
subseqüente formação de água.
O
R
O
+ Br
C
OH
R
C
+
NH2
N
H2
OH
Br
A segunda etapa é a adição de base. Com essa adição forma-se
água e brometo de sódio. Obtém-se, intermediariamente um nitrogênio
deficiente de elétrons: para esse nitrogênio é atraído o radical R da
carbonila, com formação de um isocianato. Se houver base em excesso,
o
isocianato
formado
reage
com a
mesma
formando
a
amina
correspondente com a eliminação de gás carbônico (ocorre uma
descarboxilação).
O
R
O
C
+
H
N
OH
R
C
R
N
C
O
R
N
+
Na
N
C
O
isocianato
Br
+
Decomposição do ISOCIANATO ( OH / H )
O
R
N
C
O +
OH
R
N
C
O
∆
OH
R
N
C
∆
OH
O
R
N
+
C
R
N H + CO 2
OH
Adição de um ácido
R
NH + H
R
NH2
46
Se a amida inicial fosse a butanoamida, qual seria a amina final?
10) Reação com compostos de Grignard
Obtém-se sempre cetona como produto final. Se a mistura final
for hidrolisada, obtém-se além da cetona, uma amina e um sal básico de
magnésio.
O
O
R
C
+
δ − éter
R
R
C
R + MgCl
NR2
MgCl
δ+
NR2
O
R
C
R + MgCl
NR2
δ−
R2N
δ+
δ+
MgCl + H
δ−
OH
R2NH + Mg (OH) Cl
→ Identifique todos os produtos envolvidos na reação do cloreto de Etil
magnésio com a N, N Dimetil butano Amida.
C
O
C
C
C
+
C
N
C
O
C
MgCl
éter
C
C
C
C
C
N
C
C
+ MgCl
C
C
O
C
C
C
C
C
C
C + N
C
hexanona 3
MgCl
47
C
N
MgCl
+
δ+ δ−
HOH
C
N
NH
+
Mg(OH)Cl
C
dimetilamina
11) Reação com ácido nitroso
A reação com ácido nitroso leva à formação de um sal de
diazônio, que é instável e sob aquecimento se decompõe, formando gás
nitrogênio e um cátion acílio. Se a reação for feita em meio aquoso,
obtemos como produto final um ácido orgânico.
O HNO2 dá origem ao N2O3.
2HNO2
H2O + O
N
O
N
O
O
O
O
R
C
N
+
R
C
N
H2
N
H
N
NH2
O
N
N
H
N
N
O +
NO2
O
O
HNO2 + R
C
O
O
R
C
O
N
H
N
O
R
C
O
Β
(Pode ser a água ou o NO2)
O
R
C
O
N
N
OH + H
R
C
N
N
OH2
48
H2O + R
C
N
N
O
O
O
R
C
N
N
R
∆
C
+ N2 (g)
Em meio aquoso, forma-se o ácido correspondente
O
R
C
O
+ OH2
R
O
-H
C
R
C
OH2
OH
12) Rearranjo de Curtius
Forma-se também um sal de diazônio que se decompõe
formando isocianato.
O
R
C
O
NH2
O
HNO2
R
C
N
N
N
N2 + R
C
N
O
R
C
N
O
C
N
R
O
C
N
R
Se fizermos a hidrólise do isocianato, obteremos:
R
N
C
O +
OH 2
R
N
C
O
OH2
O
R
N
C
O
Β
1°
OH 2
R
N
H
C
OH
49
O
R
N
H
C
R
∆
N
CO 2
OH
H
R
NH2
OH
C
O
Exercícios
1)
Identifique, com mecanismos, os produtos formados nos seguintes
procedimentos:
a - amonólise do brometo de pentanodiila;
b - Aminólise do iodeto de butanodiila, quando se utiliza a benzil
amina.
2)
Identifique, com mecanismos, os produtos formados nos seguintes
procedimentos:
a - amonólise da benzil cetena;
b - aminólise da benzil cetena, quando se utiliza a benzil amina.
3)
Identifique, com mecanismos, os produtos formados nos seguintes
procedimentos:
a - amonólise do anidrido pentanodióico;
b - aminólise do anidrido pentanodióico, quando se utiliza a
isobutil amina.
4)
A hidrólise do cianeto de propila (butanonitrila) em meio básico e
depois ácido origina uma amina e um sal. Identifique-os, com os
respectivos mecanismos.
5)
A reação do butanodiato de etila com a propil amina forma uma
diamida e um álcool, com E = 72%. Para aproveitamento de toda a
propil amina (gás) contida num tanque esférico de d = 4m, a 27°C, e
pressão normal, pede-se:
a - o mecanismo;
b - as massas das espécies envolvidas.
6)
A desidratação da hexanoamida em presença de OPCl3 forma uma
nitrila com R = 90%. Em seguida, esta nitrila foi submetida a uma
50
hidrólise ácida formando um ácido orgânico, com R = 91%. Quando
utilizarmos 6 ton desta amida, pede-se:
a - o mecanismo;
b - as massas das espécies envolvidas.
7)
A redução da pentanoadiamida com H+ / :H- forma uma diamina, com
E = 80%. Para a obtenção de 25 ton desta diamina, pede-se:
a - o mecanismo;
b - as massa das espécies envolvidas.
8)
A reação da N,N dietil butanoamida com cloreto de propil
magnésio/H2O forma um sal básico, uma amina e uma cetona.
Represente estes procedimentos com os respectivos mecanismos.
9)
Represente, com mecanismos, as hidrólises ácida e básica da
hexanodiamida.
10) A reação da propanodiamida com HNO2 sob aquecimento, e depois
com H2O forma um diácido orgânico e outros produtos. Para a
obtenção de 3500 L de solução aquosa 2,8 N desse diácido, pede-se:
a - o mecanismo;
b - as massas das espécies envolvidas.
NOÇÕES DE SÍNTESE ORGÂNICA
BENZAMIDA
1- Reagentes
Cloreto de benzoila: 10 mL (0,086 mol)
Amônia concentrada: 50 mL (d = 0,88 g/mL)
2- Aparelhagem
Frasco de Erlenmeyer de 250 ml, proveta de 50 mL, funil de
Buchner e frasco de Kitasato de 250 mL.
3- Técnica
No frasco de Erlenmeyer de 250 mL, colocar 50 mL de solução
de amônia concentrada e resfriar em gelo.
51
Adicionar, com agitação constante e gota a gota, 10 mL de
cloreto de benzoila. Trabalhar em capela.
Filtrar a benzamida em funil de Buchner e lavar com pouca água
fria. Recristalizar com cerca de 50 mL de água quente. Secar ao ar.
4- Rendimento
Varia entre 80 a 85%.
5- Tempo de reação
É de aproximadamente 2 h.
6- Caracterização
PF = 132/4°C, sólido branco, muito pouco solúvel em água fria,
muito solúvel em água quente e etanol, ligeiramente solúvel em benzeno
frio, muito solúvel em benzeno quente.
7- Aplicações
É utilizada como intermediária em sínteses orgânicas.
8- Questões
1)
Represente o mecanismo.
2)
Existe reagente em excesso? Quanto?
3)
Quais as massas dos produtos obtidos nestas condições?
4)
Dentro das proporções do processo, quais as massas de reagentes
necessárias para fabricar 500 kg da benzamida?
5)
Dentro das proporções estequiométricas, quais as massas de
reagentes necessárias para fabricar 500 kg de benzamida?
6)
Por que a solução de amônia deve ser resfriada em gelo?
7)
Por que a adição do cloreto de benzoila deve ser feita gota a gota?
8)
Por que a lavagem da benzamida deve ser feita com água fria?
9)
Como separamos a benzamida obtida das outras espécies químicas?
52
10) O que é recristalização e para que serve?
REFERÊNCIA BIBLIOGRÁFICA
SOARES, BLUMA GUENTHER. Teoria e técnicas de preparação,
purificação e identificação de compostos orgânicos. Editora
Guanabara. Rio de Janeiro, 1998.
53