UNESP- Instituto de Química
Química Orgânica Experimental
(Licenciatura em Química)
Preparação da Acetanilada
Docente:
Prof. Dr. José Eduardo de Oliveira
Discentes:
Adriano dos Santos
Dimas Batista Mineiro
Objetivos
• Demonstrar breve
histórico, curiosidades e
propriedades da
acetanilida (figura ao lado)
Acetanilida
• Demonstrar a síntese
do composto, se
preocupando com
mecanismos e
procedimentos
Conteúdo - Abordagens
• Introdução: O que é a Acetanilida? Aspectos
históricos, aplicações e características
• Revisão: Conceitos para entender a síntese
• Preparação da Acetanilida: Procedimento,
técnicas e mecanismos
• Segurança e cuidados na síntese
Introdução
• O que é acetanilida?
Amida
Derivada do para-aminofenol
Cristais brancos inodoros
MM = 135,16 g/mol / PF: 113-116 ºC
Solubilidade: 1 g se dissolve em 185 mL
de água, 20 mL água em ebulição; 3,4 mL
de etanol, 3 mL de metanol, 4 mL acetona
LD50 (gestão): 800 mg/Kg
Pode formar ligações de hidrogênio
(Curiosidade -Química Supramolecular)
Molécula da acetanilida
Introdução
• Aspectos Históricos
• Também conhecido como N-fenilacetamida (IUPAC)
• Foi utilizado como analgésico e antitérmico (1886), com
o nome de antifebrina (Curiosidade)
• Porém apresentou problemas e foi substituída
(quantidade controlada pelo governo)
Problemas no organismo
• Pode ser utilizado como reagente em algumas reações
Revisão
Conceitos para entender a síntese
Acetilação
• Envolve todas as reações que resultem na
introdução de um grupo acila em um composta
orgânico
• Acetilação de amina (produzindo amida)
envolve uma reação ácido-base de Lewis:
•Base de Lewis: Amina
•Ácido de Lewis: Molécula que contém
carbono carboxílico.
Grupo Acetila ou Etanoila
Conceitos para entender a síntese
Adição nucleofílica-eliminação no carbono acila
Solução Tampão:
Sua importância na reação
Solução que tem a propriedade de manter a
concentração do íon H3O+ constante, ou seja, o valor
do pH constante, ao se adicionar quantidades
relativamente pequenas de íons H3O+ ou OH-. Essas
soluções são preparadas a partir da mistura de ácidos
fracos e suas respectivas bases conjugadas ou suas
bases fracas e seus ácidos conjugados.
Na síntese proposta da acetanilida, o tampão (ácido
acético/ acetato de sódio) é utilizado a fim de
impedir a protonação da amina reações de hidrólise.
Preperando a Acetanilida
Quem são o ácido e a base de Lewis na preparação da acetanilida ?
Anilina é a base, e o ácido?
O ácido pode ser:
Cloreto de Acetila: Reage vigorosamente, liberando HCl, que converte metade
da amina no seu cloridrato (sal), tornando-a incapaz de participar da reação,
diminuindo o rendimento.
Anidrido Acético: Preferido nas reações de laboratório devido a sua velocidade
de hidrólise ser mais lenta do que a acetilação da anilina (em soluções
aquosas)
Podem também ser: Ésteres, Ácidos Carboxílicos e sais carboxílicos
Na síntese proposta, será utilizado o anidrido acético como reagente acilante
Preperando a Acetanilida
Reagente
Quantidade
Anilina
15,5 g
Ácido Acético Glacial
16,7 g (16 mL)
Acetato de Sódio anidro 4,2 g
Anidrido Acético
Utensílios
18,3 g (17 mL)
Segurança e
Descuido
Propriedades Físicas
Fluxograma
4,2g de acetato de sódio anidro
16,7g de ácido acético glacial (16,0 mL)
em béquer de 500 mL
2. Adicionar
lentamente
1. Triturar em almofariz
4,2g de acetato de sódio triturado
Suspensão de ácido acético e
Acetato de sódio anidro
3. Agitação magnética constante
Cuidado!!!!
Reação rápida e
exotérmica
4. Adicionar em pequenas porções
15,5g de anilina
5. Adicionar
18,3g (17,0 mL)
de anidrido acético
Acetanilida + Anilina(traços) + Ácido acético + Anidrido acético(excesso) + impurezas
6. Adicionar
250 mL de água
Sistema bifásico
LÍQUIDO: Ácido acético, anilina, acetanilida
SÓLIDO: Acetanilida + impurezas
7. Resfriar
8. Filtrar à vácuo
FILTRADO:
Ácido acético + Anilina + impurezas
SÓLIDO:
Acetanilida hidratada + impurezas
9. Lavar o precipitado várias
vezes com água gelada
Descartar em frasco específico
10. Secar em dessecador a vácuo
Acetanilida seca e impura
Embalada e corretamente rotulada
11. Pesar e determinar
o rendimento
Acetanilida seca + impurezas
12. Determinar o ponto de fusão
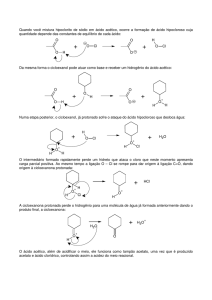
Mecanismo da reação
• Mecanismo Principal
• Mecanismo de Hidrólise
• Há necessidade da utilização do tampão ácido
acético/acetato de sódio ?
Calculando o Rendimento
C8H9ON +
C6H7N + C4H6O3
1mol
1mol
1mol
93.13g
102.09g
137.17g
m =15.5g m = 18.3g
m=?
V ~ 17 mL
d = 1.080 g/mL
Cálculo do reagente
limitante
93.13 ------ 102.09
15.50 ------ X
X = 16.99 g
∴1.3g de excesso
C2H4O2
1mol
60.05g
Massa de acetanilida:
93.13 ------- 137.17
15.50 ------- Y
Y = 22.83 g
(para 100% de rendimento)
Técnicas
• Trituração (maceração)
• Agitação Magnética
• Lavagem de precipitado
• Filtração à vácuo
Secagem de precipitados
• Medição de ponto de fusão
Bibliografia
• Vogel, A. I., Química Orgânica, USP, 3a ed.,
RJ, (1981)
• The Merck Index, 12º Edição
• Soares, B. G. et al,
Guanabara, RJ, (1988)
Química
Orgânica,
• Merat, L. M. O. C. e Gil, R. A. S. S, Química
Nova, 5, 779, (2003)
• Aakeroy, C. B. et al, Dalton Trans., 3956 (2003)
• www.wikpedia.com.br
Obrigado
pela
atenção
FIM
Derivados do p-aminofenol
O
O
HN
HN
CH3
CH3
p-aminofenol
NH2
O
OH
paracetamol
CH3
fenacetina
O
HN
CH3
OH
Acetanilida
VOLTAR
Química Supramolecular
Química “além da molécula”
Ex: Cu(Ac)2(Iso)2].2 CH3OH (Ac= íon acetato, Iso =
isonicotinamida) – Moléculas da Iso interagindo via
ligações de hidrogênio do tipo N-H··O=C
Estrutura Monomérica do
composto
Cu(Ac)2(Iso)2].2CH3OH
Química Supramolecular
• Molécula da Isonicotinamida e suas interações de
hidrogênio do tipo N-H··O=C
Química Supramolecular
Estrutura Polimérica do Composto Cu(Ac)2(Iso)2].2CH3OH
VOLTAR
Curiosidade
Calendário do Produto químico da
Companhia Antikamnia de St Louis
(Missouri-EUA), um almanaque singular
porque em todas as ilustrações os
protagonista são esqueletos. Os
calendários
publicados companhia
entre 1897 e 1901, com as aquarelas
do doutor e do artista local Louis
Crucius. O Antikamnia (” contra a dor ")
era a base de acetanilida, bicarbonato
do sódico, ácido cítrico e outros.
VOLTAR
Efeitos adversos da Acetanilida no Organismo
A acetanilida é metabolizada no organismo a paracetamol
(acetaminofen), causando:
• Metahemoglobinemia
• Anemia Hemolítica
• Nefrite
Metahemoglobina
Condição clínica originada pela conversão excessiva da
hemoglobina em metahemoglobina, que é incapaz de ligar-se e
transportar oxigênio.
Fe(II) → Fe(III) (Ferro da molécula de heme)
Anemia Hemolítica
Uma anemia devido à hemólise, que é a quebra
anormal de hemácias nos vasos sanguíneos
(hemólise intravascular) ou em outro lugar do corpo
(extravascular)
Hemólise: Tubo da esquerda e
central sem hemólise, tubo da
direita com hemólise
Nefrite
Nefrite (também chamada glomerulonefrite) é um termo
usado para descrever enfermidades renais, nas quais a
parte filtrante do rim (glomérulo) está inflamada.
VOLTAR
Exemplo de Reação com
Acetanilida
• Obtenção da p-bromoanilina
VOLTAR
Utensílios
Kitassato
Funil de Büchner
Béquer de 500 mL
Trompa de água
Almofariz e pistilo
Proveta graduada
VOLTAR
Mecanismo Principal
VOLTAR
Hidrólise (meio ácido)
O
O
C
HN
+
H
OH
C
C
CH3
HN
H
HN
CH3
CH3
+
H
NH
OH
+
-H
+
OH
C
H
OH
NH
CH3
CH3
-H
+
OH
C
HN
+
H
H2O
OH
OH2
+
-H
+
H
OH
CH3
+
+
C
+
H
NH2
O
+
H3C
+
H
-H
C
+
OH
O
+
H
H3C
VOLTAR
C
OH
Há necessidade do tampão ?
Porcentagem de utilização atômica (%A) :
%A = P.M. do produto desejado / Σ P.M. das substâncias produzidas
Permite avaliação rápida da quantidade de rejeitos da operação
Não considera os solventes utilizados e o rendimento
Fator E:
Fator E = Σ massas dos produtos secundários / massa do produto desejado
Considera todas as substâncias utilizadas na reação, incluindo os solventes
(exceto água) e a parcela de reagentes não convertidos.
Quanto maior E → maior é a massa de rejeito utilizada (menos aceitável é o
processo do ponto de vista ambiental)
Há necessidade do tampão ?
MELHOR
RESULTADO
VOLTAR
Pulverização
(Trituração do sólido em almofariz)
O objetivo da trituração é dividir o material finamente,
aumentando sua superfície de contato:
• A trituração deve ser homogênea.
• Não deve-se bater com o pistilo no almofariz e sim fazer
movimentos circulares.
• A fim de não perder material durante a trituração, pode-se
colocar sobre o almofariz um pedaço de papel.
VOLTAR
Almofariz e pistilo
Agitação Magnética
• Emprega-se
um
campo rotativo de
força
magnética
para
induzir
velocidade variável
a ação de agitação
dentro
de
recipientes abertos
e fechados
VOLTAR
Filtração à Vácuo
Importante: Lava-se o precipitado, ates da filtração, com
pequena quantidade de solvente frio, para remover traços
da solução mãe (solvente quente pode dissolver alguma
quantidade de cristal)
Vantagens: Aumenta a velocidade de filtração e deixa
menor quantidade de impurezas e de solvente no sólido
(devido á sucção provocada pelo vácuo)
Filtração a vácuo
Aparelhagem: Um kitassato,
provido de um funil de Buchner,
é ligado à um
segurança – vazio-,
frasco
de
que por sua vez está conectado à
uma trompa d’água.
•
•
Cortar um círculo de papel de filtro,
cujo diâmetro deve ser de 1 à 2 mm
menor que o diâmetro interno do funil;
coloca-se o papel no funil à cobrir os
orifícios do funil.
Umedecer o papel de filtro com o
solvente, ligar a bomba de vácuo e
iniciar a filtração. Terminada a
filtração, abrir a torneira do frasco de
segurança ou a entrada de ar entre o
kitassato e o frasco de segurança,
antes de desligar a bomba de vácuo.
VOLTAR
Lavagem de Precipitado
• Antes da filtração a vácuo, os cristais devem ser
lavados com uma pequena quantidade de solvente
frio, para remover qualquer traço da solução águamãe que pode ter ficado aderida na superfície do
cristal.
• O volume do líquido de lavagem, necessário para
remover o material estranho, deve ser o menor
possível, pois nenhum composto é completamente
insolúvel.
• A lavagem é mais eficaz quando se lava com
diversas parcelas de líquido de lavagem
O líquido de lavagem deve seguir
as seguintes condições:
• Não dissolver quantidades apreciáveis do precipitado;
• Não formar produto volátil ou insolúvel com o
precipitado;
• Ser facilmente volatilizado na temperatura de secagem
do precipitado.
• Em geral não se deve usar água pura
VOLTAR
Secagem do precipitado
• Coloca-se o produto em papel de filtro absorvente
sobre um vidro de relógio; cobre-se o conjunto com
outro vidro, placa de Petri ou papel absorvente (para
proteger de poeira); deixa-se em repouso em
ambiente seco (pode ser ao sol).
• Em estufa ou mufa (para p.f. maior que 100°C)
coloca-se o sólido em vidro de relógio ou cápsula de
porcelana e leva-se à estufa; em geral, pequenas
quantidades à 110 °C por 30 min. Para filtração à
vácuo, leva-se o precipitado ainda sobre o papel
para a estufa.
VOLTAR
Medição do ponto de fusão
•
•
•
•
•
Uma pequena porção do material é aquecida vagarosamente em
um aparato especial equipado com um termômetro.
Temperaturas a serem anotadas: A primeira é o ponto de degelo
(a amostra começa a se liquefazer), e a segunda é o ponto de
fusão (amostra totalmente fundida)
O ponto de fusão de substâncias cristalinas puras é uma
propriedade física da substância, sendo usualmente insensível a
mudanças de pressão (dentro de limites razoáveis), isto é, a fusao
ocorre a uma faixa estreita de temperatura (0,5-1,0ºC) – Por isso é
usada como critério de avaliação de pureza.
A presença de impurezas acarreta, geralmente, um alargamento
na faixa de fusão, além de abaixar a temperatura de fusão.
O ponto de fusão da acetanilida: 113º-116º C (Verifica-se valores
em torno de 84 °C devido à formação de um sistema binário entre
água e acetanilida).
VOLTAR
Anilina
• Sinônimos: aminobenzeno; fenilamina; óleo de anilina.
• Aparência: líquido oleoso; sem coloração ou marrom;
odor fraco; afunda lentamente na água.
Estado
Líquido
Sintomas
VENENOSO, SE EXPOSTO À
PELE. IRRITANTE PARA OS
OLHOS. VENENOSO, SE
INGERIDO.
Tratamento
REMOVER ROUPAS E SAPATOS
CONTAMINADOS E ENXAGUAR COM
MUITA ÁGUA. MANTER AS
PÁLPEBRAS ABERTAS E ENXAGUAR
COM MUITA ÁGUA.
Ácido Acético Glacial
• Sinônimos: ácido etanóico, ácido acético, ácido de vinagre.
• Aparência: líquido aquoso, sem coloração, odor forte de vinagre,
afunda e mistura com água, produz vapores irritantes.
Estado
Sintomas
Tratamento
Vapor
IRRITANTE PARA O NARIZ E A
GARGANTA. SE INALADO, CAUSARÁ
TOSSE, NÁUSEA, VÔMITO OU
DIFICULDADE RESPIRATÓRIA.
MOVER PARA O AR FRESCO. SE A
RESPIRAÇÃO FOR DIFICULTADA OU
PARAR, DAR OXIGÊNIO OU FAZER
RESPIRAÇÃO ARTIFICIAL.
Líquido
PREJUDICIAL, SE INGERIDO. QUEIMARÁ
OS OLHOS. QUEIMARÁ A PELE.
NÃO PROVOCAR O VÔMITO.
MANTER AS PÁLPEBRAS ABERTAS E
ENXAGUAR COM MUITA ÁGUA.
REMOVER ROUPAS E SAPATOS
CONTAMINADOS E ENXAGUAR COM
MUITA ÁGUA.
Acetato de Sódio Anidro
• Sinônimos: sal anidro;
• Aparência: composto cristalino incolor
Estado
Sintomas
Sólido
Dor de garganta se
inalado.
Vermelhidão e
irritação se em
contato com a pele
e com os olhos.
Causa irritação no
trato digestivo se
ingerido
Tratamento
inalação: Remover para local arejado e repousar. Se
cessar a respiração, aplicar método de reanimação
cardiopulmonar.
contato com os olhos: Lavar imediatamente com muita
água por, pelo menos, 15 minutos.
contato com a pele: Lavar imediatamente com muita
água e sabão até que toda a substância seja removida
da pele.
ingestão: Se a vítima estiver consciente, beber de 2 a 4
copos de água ou leite. Chamar auxílio médico.
Anidrido Acético
•
•
Sinônimo: Anidro Etanóico;
Aparência: líquido aquoso, sem coloração, odor forte de vinagre,
afunda e reage lentamente com água, produz vapores irritantes
Estado
Sintomas
Tratamento
Vapor
IRRITANTE PARA O NARIZ E GARGANTA. SE
INALADO, CAUSARÁ NÁUSEA, VÔMITO E
DIFICULDADE RESPIRATÓRIA. QUEIMARÁ OS
OLHOS.
MOVER PARA O AR FRESCO. SE A
RESPIRAÇÃO FOR DIFICULTADA
OU PARAR DAR OXIGÊNIO OU
FAZER RESPIRAÇÃO ARTIFICIAL.
MANTER AS PÁLPEBRAS
ABERTAS E ENXAGUAR COM
MUITA ÁGUA.
Líquido
PREJUDICIAL, SE INGERIDO. QUEIMARÁ OS
OLHOS. QUEIMARÁ A PELE.
MANTER AS PÁLPEBRAS
ABERTAS E ENXAGUAR COM
MUITA ÁGUA. REMOVER ROUPAS
E SAPATOS CONTAMINADOS E
ENXAGUAR COM MUITA ÁGUA
Atenção no Descarte
SUBSTÂNCIA
Anilina
Anidrido Acético, Ácido
Acético
Acetato de Sódio
DESCARTE
Pequenas quantidades,
devem ser na forma diluída
e nunca pura, nunca ser
misturado com outros
rejeitos químicos
Devem ser neutralizados e
diluídos com água antes de
serem descartados na pia
Pode ser jogado na pia,
diluído.
Propriedades Físicas
VOLTAR