Capítulo II
Fenómenos de Transporte
Fenómenos de transporte: aspectos gerais
Movimento molecular
• De que depende o movimento aleatório das moléculas?
• TEMPERATURA
Física Aplicada 2013/14 |MICF | FFUP
2
Fenómenos de transporte: aspectos gerais
MOVIMENTO NA FASE GASOSA
• De que depende a velocidade movimento das moléculas?
Da temperatura
Da massa da molécula
Para uma dada temperatura e para uma determinada molécula pode-se
calcular:
◦ a probabilidade de uma molécula ter uma velocidade particular
◦ a velocidade média para todas as moléculas
Física Aplicada 2013/14 |MICF | FFUP
3
Fenómenos de transporte: aspectos gerais
•MOVIMENTO NA FASE LÍQUIDA
• De que depende a velocidade movimento das moléculas?
Da temperatura
Do tamanho e forma da molécula
Física Aplicada 2013/14 |MICF | FFUP
4
Fenómenos de transporte: aspectos gerais
Propriedades fundamentais que se podem transportar:
◦ Quantidade de movimento (ou momentum)
◦ Quantidade de energia
◦ Quantidade de massa
Gradiente de velocidade
Força
Gradiente de temperatura
Gradiente de concentração
Física Aplicada 2013/14 |MICF | FFUP
5
Onde pode ocorrer o transporte?
No seio de um fluido
Entre um fluido e um sólido
Exemplos:
Um fluido que circula através de uma conduta, dissipa energia por atrito, que se
traduz num transporte de quantidade de movimento entre as regiões com
velocidades distintas.
Um sistema com regiões a diferentes temperaturas (diferentes concentrações de
energia) transporta energia desde a região mais quente até à mais fria.
Uma mistura de 2 ou mais componentes com regiões com diferentes
concentrações transporta matéria desde a zona mais concentrada até à menos
concentrada.
Física Aplicada 2013/14 |MICF | FFUP
6
Equação geral do transporte molecular
Qualquer que seja o fenómeno de transporte molecular (quantidade de
movimento, energia ou massa) há uma equação que lhes é comum. Nestes
processos de transporte é necessário calcular a velocidade de
transferência no seio de um meio quando há uma força produtora do
movimento
Força causadora do movimento
Velocidade do processo de transporte
Resistência
Matematicamente é expresso por:
x
d
dx
propriedade
x Propriedade de Fluxo
2
m
.
s
Física Aplicada 2013/14 |MICF | FFUP
7
Transporte de moléculas em solução
Diálise
Difusão
Osmose
Numa solução os solutos são transportados devido a forças impulsoras que
podem ser : gradientes de concentração; potencial eléctrico ou pressão
Física Aplicada 2013/14 |MICF | FFUP
8
Transporte de moléculas em solução
Electroforese
Sedimentação
Viscosidade
Numa solução os solutos são transportados devido a forças impulsoras que
podem ser : gradientes de concentração; potencial eléctrico ou pressão
Física Aplicada 2013/14 |MICF | FFUP
9
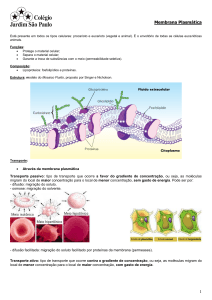
Fenómenos de transporte: Diálise e osmose
Osmose - difusão selectiva do solvente através de uma membrana semi-permeável
Diálise- processo físico-químico pelo qual duas soluções (de concentrações diferentes),
são separadas por uma membrana semipermeável, após um certo tempo as espécies
passam pela membrana para igualar as concentrações
Física Aplicada 2013/14 |MICF | FFUP
10
Propriedades de Transporte
Difusão e Sedimentação – medem o transporte de massa
Viscosidade – mede o transporte de momento
Electroforese- mede o transporte de carga
Dão indicação sobre as moléculas: tamanho, forma
Física Aplicada 2013/14 |MICF | FFUP
11
Propriedades de transporte: aplicações
Usadas para
Analisar
Separar
Purificar
Partículas celulares, proteínas e ácidos nucleicos
Sedimentação – permite o fraccionamento baseado nas diferenças dos
coeficientes de sedimentação que dependem da massa da partícula, do seu
formato e da densidade relativamente ao solvente
Electroforese de gel – usada para separar proteínas nativas que diferem entre
si pela carga ou proteínas desnaturadas que diferem entre si por uma unidade
peptídica ; usada para separar ácidos nucleicos que diferem entre si por um
nucleótido e por isso determinar a sua sequência; separa fragmentos de DNA
Física Aplicada 2013/14 |MICF | FFUP
12
Fenómenos de transporte
DIFUSÃO
Física Aplicada 2013/14 |MICF | FFUP
13
Difusão
A qualquer temperatura diferente do zero absoluto,
independentemente do estado de agregação (gasoso,
líquido ou sólido) as partículas estão constantemente
em movimento
O movimento das partículas está associado a colisões e
o movimento das partículas é em zig-zag
O movimento aleatório das partículas de
soluto é devido aos choques entre elas e
as moléculas de solvente, devido à
agitação térmica
Física Aplicada 2013/14 |MICF | FFUP
14
O movimento Browniano
Em solução, as partículas de soluto estão em contínuo
movimento devido à energia térmica do sistema =
Movimento Browniano.
As moléculas de soluto colidem continuamente com as
moléculas de solvente e a energia cinética transferida às
partículas de soluto
provocam o seu movimento
aleatório, através da solução.
Movimento Browniano de
uma partícula de soluto
Se existir uma diferença de concentração de soluto entre
duas zonas da solução, existirá uma migração (difusão) do
soluto das regiões de elevada concentração para as
regiões de baixa concentração, até haver igualdade de
concentração, nas duas regiões. No equilíbrio, a difusão
pára embora as moléculas de soluto continuem a moverse. Não há migração porque o gradiente de concentração
desaparece.
Física Aplicada 2013/14 |MICF | FFUP
15
Representação gráfica da difusão
Física Aplicada 2013/14 |MICF | FFUP
16
Difusão
As moléculas deslocam-se de uma região de elevada
concentração para outra de menor concentração
Transporte de massa como consequência das diferenças espaciais
na concentração
Física Aplicada 2013/14 |MICF | FFUP
17
Difusão e Movimento Browniano
A velocidade com que as moléculas de soluto migram
através do solvente depende do tamanho e da forma
das partículas.
O parâmetro que descreve esse movimento é chamado
Coeficiente de Difusão
Movimento Browniano de
uma partícula de soluto
Albert Einstein mostrou que:
1
D 2 cm 2 s 1
r
À medida que o raio molecular aumenta, D decresce com o quadrado do raio porque
aumentam as fricções entre solvente e soluto
Einstein definiu o tempo médio necessário para que as moléculas migrem, de um ponto
para outro
dx
2
2Dt
Física Aplicada 2013/14 |MICF | FFUP
18
Difusão e movimento Browniano
dx
2
2Dt
(dx)2 – quadrado do deslocamento
médio (distância difundida)
Relação de Einstein – mostra o tempo médio necessário para que as moléculas
de soluto migrem, de um ponto para outro.
Física Aplicada 2013/14 |MICF | FFUP
19
Como medir a diusão?
Através do fluxo de difusão
Fluxo de difusão (J) - – quantidade de soluto que se
difunde através da unidade de área, por unidade de
tempo, na direcção x
Física Aplicada 2013/14 |MICF | FFUP
20
Fluxo de difusão
É usado para determinar a velocidade com que a
difusão ocorre
Pode ser dada em função do número de átomos por
área e tempo (at/m2.s) ou em termos do fluxo de massa
(kg/m2.s)
M = massa difundida através do plano;
A = Área do plano;
t = tempo de difusão
Física Aplicada 2013/14 |MICF | FFUP
21
Gradiente de concentração
o
o
o
o
o
A força que promove a difusão é a existência de um gradiente de
concentração
O termo “gradiente” descreve a variação de uma dada propriedade
em função da distância, na direcção de X
Se o material exibe uma variação linear da concentração com a
distância, na direcção X , diz-se que o gradiente de concentração é
constante na direcção X
Gradiente de concentração = (dc/dx) = (c/x)
dC/dx (Kg/m3): pode ser encontrado a partir da inclinação da reta
em um determinado ponto da curva de perfil de concentração
Física Aplicada 2013/14 |MICF | FFUP
22
Difusão e gradiente de concentração
Gradiente de oncentração (C) de átomos ou moléculas de em
função da direcção (x) na amostra
oA força que promove a difusão é a
existência de um gradiente de
concentração
oSe o material exibe uma variação linear
da concentração com a distância, na
direcção X , diz-se que o gradiente de
concentração é constante na direcção X
oGradiente de concentração = (dc/dx) =
(c/x) (Kg/m3): pode ser encontrado a
partir da inclinação da reta em um
determinado ponto da curva de perfil de
concentração
Física Aplicada 2013/14 |MICF | FFUP
23
Difusão em estado estacionário
A difusão em estado estacionário ocorre a uma velocidade
constante ou seja: uma vez que o processo começa, o número de
átomos (ou moles) que atravessam uma dada interface (fluxo) é
constante ao longo do tempo .
Como traduzir isto?
dc
constante c f x é uma função linear
dx
e
dc
0
dt
Física Aplicada 2013/14 |MICF | FFUP
24
Difusão em estado estacionário
Física Aplicada 2013/14 |MICF | FFUP
25
Difusão em estado não estacionário
A difusão é um processo dependente do tempo no qual a
velocidade de difusão é função do tempo
dc
varia com o tempo
dx
e
dc
0
dt
Física Aplicada 2013/14 |MICF | FFUP
26
Primeira Lei de Fick
O fluxo de difusão é proporcional ao gradiente de concentração
D : coeficiente de difusão;
Sinal negativo: indica que o fluxo se dá na direção
decrescente do gradiente.
3
moles
dc moles cm
J 2 D
cm
cm s
dx
Então : D cm
2
s
Física Aplicada 2013/14 |MICF | FFUP
27
Coeficiente de Difusão: Significado
•
O coeficiente de difusão D:
indica a taxa de movimentação atómica;
tal como as reacções químicas, a difusão é um processo activado
termicamente (dependente da temperatura) e relaciona-se com a
difusividade através de uma equação do tipo da equação de Arrhenius.
D0 = inclui factores tal como deslocamento da partícula, frequência vibracional
das espécies que se difundem , etc (m2/s)
Ea= energia de activação da difusão (J/mol )
R = constante dos gases (8,314 J/mol K)
T = temperatura absoluta (K)
Física Aplicada 2013/14 |MICF | FFUP
28
Coeficiente de difusão: equação de Arrhenius
O coeficiente de difusão dá uma ideia da “velocidade de difusão”
Depende:
da natureza das moléculas em questão
da concentração do soluto
da temperatura
D D0e
Ea
RT
Difusividade
D0= (cont)T= m2/s
Ea= energia activação para a difusão (J/mol)
Física Aplicada 2013/14 |MICF | FFUP
29
Coeficientes de Difusão
Dados de difusão de alguns elementos
Física Aplicada 2013/14 |MICF | FFUP
30
Determinação do coeficiente de difusão
Medir a quantidade de material que é
transferido, através da unidade de área e
por unidade de tempo.
Usar um disco de vidro poroso de
espessura x, para separar duas soluções
de diferentes concentrações
x
D J
c2 c1
J=
cm-2 s-1
ou g
cm-2 s-1
C2, C1 = mol cm-3 ou g cm-3
x = cm
D = cm2 s-1
A velocidade de transferência do
material (mol s-1 ou g s-1) através do disco
pode ser medida usando um marcador
radioactivo.
A área efectiva do disco poroso é
determinada por calibração do mesmo
com uma substância cujo coeficiente de
difusão é conhecido
J é obtido dividindo a velocidade de
transferência do material pela área efectiva
do disco poroso
Física Aplicada 2013/14 |MICF | FFUP
31
1ª Lei de Fick: um exemplo de difusão em estado
estacionário
Um exemplo:
A difusão de Na+ através da
membrana celular.
Se a concentração de Na+
intracelular for 50 g/m3 e a
concentração extracelular for
200 g/m3 , o coeficiente de
difusão for 2x10-9 m2/s e a
espessura da parede celular
for 30 nm, qual é a velocidade
de transporte de sódio através
da membrana?
Assuma que as concentrações
em ambos os lados da
membrana são constantes com
o tempo e que o fluxo é
estacionário.
J D
dc
dx
200 g m3 50 g m3
J 2 10 m s
10,0 gm 2 s 1
9
30 10 m
9
2
Física Aplicada 2013/14 |MICF | FFUP
32
Segunda Lei de Fick
O tratamento quantitativo do processo de difusão em estado não
estacionário é formulada através de uma equação parcial diferencial
J varia com o tempo;
C é dada em termos tanto do tempo quanto da posição:
◦ Situação mais próxima da real;
◦ O perfil de concentração é dado por uma equação diferencial:
2ª Lei de Fick;
Física Aplicada 2013/14 |MICF | FFUP
33
Lei de Fick aplicada à difusão através de membranas
Fenómenos de Transporte
Difusão através das membranas
Física Aplicada 2013/14 |MICF | FFUP
35
Difusão através das membranas: aplicação da lei de Fick
Suponha um soluto que passa através da bicamada lipídica de
espessura “x” e área “A”, desde um compartimento onde se
encontra com uma concentração C1 , até outro onde a
concentração é C2.
A difusão do soluto (fluxo) na bicamada é
caracterizado por:
V Dm A
C C1m D A C1m C2m
C
Dm A 2 m
m
d
d
d
C1m = conc. do soluto na zona de maior
concentração da membrana
C2m = conc. do soluto na zona de menor
concentração da membrana
x = espessura da membrana
Física Aplicada 2013/14 |MICF | FFUP
36
Difusão através das membranas: aplicação da lei de Fick
Experimentalmente só se conhece a concentração do soluto no
seio da solução (C1 aq e C2 aq ). Por isso é necessário relacionar a
concentração do soluto nos dois compartimentos aquosos e a sua
concentração na região imediatamente adjacente, dentro da
membrana (Cm).
Esta relação é dada pelo coeficiente de partilha ou de partição
membrana/água
Cmemb
Cagua
-Correlaciona a lipossolubilidade do
soluto
< 1 – substrato polar
> 1 – substrato apolar
Física Aplicada 2013/14 |MICF | FFUP
37
Difusão através das membranas: aplicação da lei de Fick
Cm C1m C2 m
C m C1m C2 m
C C1 C2
Introduzindo na expressão anterior
v
C C2
Dm 1
J ( fluxo )
A
d
Vem:
Ou:
V Dm A
C C1m D A C1m C2m
C
Dm A 2 m
m
d
d
d
v ADm
C1 C2
d
Física Aplicada 2013/14 |MICF | FFUP
38
Coeficiente de Permeabilidade
O gráfico de fluxo versus diferença de concentração é uma linha
recta cujo declive se designa por coeficiente de permeabilidade, P
(cm/seg)
Traduz a intensidade do transporte através da membrana para uma
diferença de concentração determinada
C1 C2
J Dm
x
ou
donde P
J PC1 C2
Dm
x
O coeficiente de permeabilidade depende:
do coeficiente de difusão na membrana (Dm)
do coeficiente de partição, membrana/água ()
da espessura da membrana (x)
Física Aplicada 2013/14 |MICF | FFUP
39
Coeficientes de permeabilidade da membrana
Física Aplicada 2013/14 |MICF | FFUP
40
Transporte de difusão nas membranas lipídicas
a) Difusão simples
• Os canais são proteínas que
estão integrados na membrana
plasmática
• Os canais iónicos abrem-se em
resposta a um estímulo
específico
b) Difusão facilitada
• O movimento é mais rápido
do que a difusão simples (Vmax
atinge-se mais rapidamente) e
utiliza uma proteína carreadora
com cinética e especificidade
estrutural
Física Aplicada 2013/14 |MICF | FFUP
41
Difusão simples e difusão facilitada
Na difusão simples aplica-se a lei de Fick
Para a difusão facilitada há severas restrições à aplicação da lei de
Fick
A permeabilidade da membrana plasmática para uma substãncia
que se difunde aumenta com a liposolubilidade da substãncia que é
definida pelo coeficiente de partilha.
Física Aplicada 2013/14 |MICF | FFUP
42