Digestão e absorção de proteínas; Rui Fontes
Estrutura, digestão e absorção de proteínas e aminoácidos
1-
As proteínas são formadas por resíduos de aminoácidos ligados entre si (numa cadeia linear) por
ligações covalentes que os químicos designam por ligações amida. No caso particular das proteínas (e
na maioria das ligações entre os resíduos aminoacídicos dos peptídeos), essas ligações também se
costumam designar por ligações peptídicas. As ligações peptídicas são ligações amida que envolvem o
grupo α-amina de um aminoácido e o grupo carboxilo que contém o carbono 1 do aminoácido que o
precede na cadeia (ver Fig. 1)1. A hidrólise destas ligações leva à separação de grupos carboxilo e αamina de dois resíduos de aminoácidos contíguos; consequentemente, a hidrólise completa de uma
proteína leva à separação dos resíduos dos aminoácidos componentes dessa proteína (ver Equação 1).
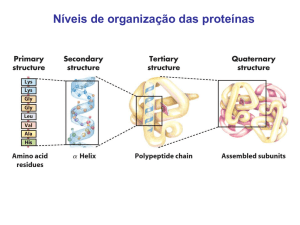
A sequência de aminoácidos de uma proteína designa-se por estrutura primária e escreve-se pela
mesma ordem com que são incorporados durante a sua síntese nos ribossomas: do aminoácido que
contém o grupo α-amina livre (o terminal amina) até ao aminoácido que está no outro extremo da
cadeia e contém o grupo carboxilo do carbono 1 livre (o terminal carboxilo).
Equação 1
proteína ou peptídeo com n resíduos aminoacídicos + n-1 H2O → n aminoácidos livres
2-
Numa dada proteína, para além da estrutura primária, existem, pelo menos, mais dois níveis de
estrutura: a estrutura secundária e a terciária. A estrutura secundária diz respeito à forma como os
aminoácidos que estão relativamente próximos na cadeia primária se relacionam entre si no espaço
tridimensional. Sequências com estruturas tridimensionais tipificadas são as hélices α e as strand β, as
“fitas” β que compõem as folhas pregueadas β. As hélices α e as strand β, assim como as sequências
menos estruturadas de maior (loops ou “alças”) ou menor comprimento (turns ou “voltas”) que ligam as
“sequências mais estruturadas” entre si são componentes da estrutura secundária das proteínas.
Nas hélices α existem ligações hidrogénio (não covalentes) que se estabelecem entre o átomo de
oxigénio de um grupo carboxilo e o átomo de azoto (de uma ligação peptídica) de resíduos
aminoacídicos que estão próximos na sequência aminoacídica (intervalos de quatro resíduos). A ligação
diz-se “hidrogénio” porque há um átomo de hidrogénio (o que está ligado de forma covalente ao azoto)
que estabelece a “ponte” entre o azoto e o oxigénio.
No caso das folhas pregueadas β, o mesmo tipo de ligações une as strand β que são componentes de
uma dada folha pregueada.
3-
A estrutura terciária das proteínas também se refere à estrutura tridimensional da cadeia aminoacídica
mas, neste caso, diz respeito às relações entre resíduos que estão distantes na cadeia. Ao contrário do
que acontece nas estruturas primária e secundária, as ligações que determinam a estrutura terciária
envolve as cadeias laterais dos aminoácidos, ou seja, a cadeia de átomos que se liga ao carbono α e que
é diferente de aminoácido para aminoácido. Os tipos de ligações que se estabelecem entre as cadeias
laterais de resíduos aminoácidos distantes na cadeia são maioritariamente não covalentes e incluem
ligações iónicas, hidrogénio e hidrofóbicas.
(1) Um exemplo de uma ligação iónica entre cadeias laterais de resíduos aminoacídicos é a que se pode
estabelecer entre o grupo carboxilato do carbono 5 do glutamato (ao pH das células o grupo carboxílico
está desprotonado e, por isso, tem carga negativa) e o grupo amina do carbono 6 da lisina (que está
protonado ao pH das células e, por isso, tem carga positiva).
(2) Um exemplo de uma ligação hidrogénio entre cadeias laterais de aminoácidos é a que se pode
estabelecer entre o átomo de oxigénio do grupo hidroxilo presente no carbono 3 da serina (ou da
treonina) e o átomo de oxigénio do grupo amida do carbono 5 da glutamina (ou do carbono 4 da
asparagina); ver Fig. 2.
(3) As “ligações hidrofóbicas” podem existir entre cadeias laterais hidrofóbicas como as que existem,
por exemplo, nos aminoácidos ramificados, na metionina e na fenilalanina (ver Fig. 2).
1
Quando um resíduo aminoacídico contém um outro grupo carboxílico para além do que corresponde ao carbono 1
(como são os casos do glutamato e do aspartato) e é esse grupo que está envolvido na ligação amida a ligação não se
designa de peptídica; às vezes a designação utilizada nestes casos é “ligação pseudo-peptídica”. Um exemplo disto é a
ligação entre os resíduos de glutamato e de cisteína no glutatião (γ-glutamil-cisteinil-glicina).
Página 1 de 8
Digestão e absorção de proteínas; Rui Fontes
(4) Há um tipo de ligação covalente que pode participar na definição da estrutura terciária de proteínas:
a ligação dissulfureto entre dois resíduos de cisteína que sofreram oxidação e perderam (cada um)
um átomo de hidrogénio para um oxidante2.
4-
Uma proteína tem estrutura quaternária quando é constituída por, pelo menos, duas cadeias
aminoacídicas que podem ser iguais ou distintas; diz-se, nestes casos, que a proteína é oligomérica. As
ligações entre as diferentes cadeias (as subunidades do oligómero) envolvem as cadeias laterais dos
resíduos aminoacídicos e são, em geral, da mesma natureza das referidas acima para o caso da estrutura
terciária (incluindo as ligações dissulfureto entre cisteínas de subunidades distintas).
5-
Quando uma proteína é desnaturada (por aquecimento, ação de detergentes iónicos ou de solventes
orgânicos, de um meio muito ácido ou muito alcalino, de concentrações elevadas de ureia, agentes
redutores, etc.) desaparecem total ou parcialmente as estruturas secundária, terciária e quaternária, mas
não a estrutura primária: a cadeia (ou cadeias) aminoacídica passa a ter, em parte ou no seu todo, um
“enrolamento ao acaso”. Quando uma proteína fica desnaturada perde as suas atividades biológicas
porque a geometria tridimensional dos locais em que interagia com outras proteínas ou outras moléculas
orgânicas ou inorgânicas deixa de existir. Uma outra consequência da desnaturação é que a proteína em
questão passa a ser melhor substrato de enzimas proteolíticas. Na maioria dos casos a desnaturação é
irreversível mas, às vezes, a remoção do agente que provocou a desnaturação e condições apropriadas
permitem que a proteína que foi desnaturada readquira a sua conformação nativa.
6-
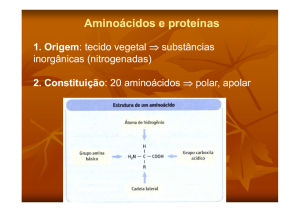
O aminoácido mais simples é a glicina (CH2NH2COOH; com 2 átomos de carbono e 1 de azoto:
2C,1N). A cadeia lateral da glicina é constituída apenas por um átomo de hidrogénio e, porque nenhum
dos carbonos da glicina é assimétrico, não existem enantiómeros da glicina. Com exceção do caso da
glicina, o carbono 2 dos aminoácidos é um carbono assimétrico; ou seja, os quatro substituintes ligados
ao carbono 2 (ou α) são todos distintos: (1) o grupo amina, (2) o carbono carboxílico, (3) um átomo de
hidrogénio e (4) uma “cadeia lateral” que distingue os diferentes aminoácidos entre si. Os aminoácidos
que fazem parte das proteínas são todos α-aminoácidos e, com exceção da glicina, são todos de tipo L3.
Isto significa que, quando os aminoácidos são orientados de acordo com a convenção de Fischer, o
grupo α-amina fica voltado para a esquerda. Ou seja, quando os carbonos 1, 2 e 3 estão alinhados na
vertical, o carbono 2 está no plano do papel e os carbonos 1 e 3 estão atrás do plano do papel, o grupo
NH2 ligado no carbono 2 fica para cá do plano do papel e voltado para a esquerda. Na Fig. 3 está
representada a alanina L estando a sua molécula orientada de acordo com a convenção de Fischer.
7-
Os aminoácidos podem ser classificados tendo em conta características químicas estruturais da cadeia
lateral.
Na glicina [2C,1N] e na alanina [3C,1N] a cadeia lateral é muito simples: no primeiro caso é um átomo
de hidrogénio e no segundo um grupo metilo (-CH3).
Nos “aminoácidos ramificados” (o que inclui a valina [5C,1N], a isoleucina [6C,1N] e a leucina
[6C,1N]) a cadeia lateral é uma cadeia alifática ramificada que tem 3 carbonos no caso da valina e 4 nos
casos da leucina e da isoleucina.
Nalguns aminoácidos a cadeia lateral contém grupos hidroxilo e, assim, a expressão “aminoácidos
hidroxilados” refere-se à serina [3C,1N,1OH], à treonina [4C,1N,1OH] e à tirosina [9C,1N,1OH].
Dois aminoácidos que fazem parte das proteínas contêm átomos de enxofre e, assim, a expressão
“aminoácidos sulfurados” refere-se à cisteína [3C,1N,1S] e à metionina [5C,1N,1S].
Dois aminoácidos contêm grupos carboxilo no último carbono (o aspartato [4C,1N] e o glutamato
[5C,1N]). Nos valores de pH do meio interno os grupos carboxilo das cadeias laterais dos ácidos
glutâmico e aspártico (pKa de cerca de 4) sofrem protólise e são, de facto, grupos carboxilato tendo
carga negativa. Porque os grupos carboxilo são dadores de protões, o glutamato e o aspartato são
chamados de aminoácidos acídicos.
2
No plasma sanguíneo existem moléculas de cistina. As moléculas de cistina podem descrever-se como sendo o
resultado da oxidação dos grupos tiol de duas moléculas de cisteína com o consequente estabelecimento de uma ligação
dissulfureto: cisteína-S-S-cisteína.
3
Alguns polipeptídeos bacterianos (incluindo bactérias existentes no lúmen do colon dos seres humanos) contêm
aminoácidos D, mas não existem aminoácidos D nas proteínas bacterianas. Na tradução proteica todos os aminoácidos
incorporados são L (com exceção da glicina que não tem enantiómeros).
Página 2 de 8
Digestão e absorção de proteínas; Rui Fontes
Há dois aminoácidos que contêm grupos amida (sem carga elétrica) no último carbono: a asparagina
[4C,2N] e a glutamina [5C,2N]. A asparagina distingue-se do aspartato por conter um grupo amida em
vez de um carboxilato no último carbono (o 4); o caso da glutamina em relação ao glutamato é
semelhante mas o carbono em questão é, neste caso, o 5.
Frequentemente os aminoácidos lisina [6C,2N], arginina [6C,4N] e também a histidina [6C,3N] são
associados à expressão “aminoácidos básicos”. A lisina contém um grupo amina no último carbono (o
carbono 6) em que o pKa é 12,5; ou seja, nos valores de pH existentes no meio interno, este grupo
amina está sempre protonado. Uma situação semelhante acontece no caso da arginina: a arginina
contém um grupo guanidina [1C,3N] ligado ao carbono 5. O pKa do grupo guanidina é de 10,8 e, por
isso, nos valores de pH existentes no meio interno, este grupo químico está sempre protonado4.
A expressão “aminoácidos aromáticos” refere-se aos aminoácidos que têm um anel aromático na
cadeia lateral. É o caso da fenilalanina [9C,1N] que tem um anel benzénico [6C], do seu derivado
hidroxilado tirosina [9C,1N,1OH], do triptofano [11C,2N] que tem um anel indol [8C,1N] e da
histidina [6C,3N] que tem um anel imidazol [3C,2N]5.
Assim, a tirosina tanto pode ser incluída nos aminoácidos aromáticos como nos hidroxilados e a
histidina tanto pode ser incluída nos aminoácidos aromáticos como nos básicos.
A prolina [5C,1N] é o único aminoácido presente nas proteínas em que o grupo α-amina é uma amina
secundária: ou seja, o azoto do grupo α-amina liga-se simultaneamente ao carbono α e ao carbono 5
formando um anel heterocíclico com 4 carbonos e 1 azoto6.
Na Fig. 2 estão representadas as estruturas dos aminoácidos referidos acima, classificados de acordo
com o grau de hidrofobicidade da cadeia lateral.
8-
Todos e cada um dos aminoácidos referidos no ponto anterior estão presentes na esmagadora maioria
das proteínas e são incorporados durante o processo de tradução. Curiosamente existe um outro
aminoácido que também é incorporado durante a tradução proteica, mas que só existe em algumas
poucas proteínas (de que é um exemplo a peroxídase do glutatião). Trata-se da selenocisteína
[3C,1N,1Se] e, como o nome indica, é, estruturalmente, muito semelhante à cisteína: a única diferença é
que em vez do átomo de enxofre contém um átomo de selénio. (De facto, também é muito semelhante à
serina: em vez do átomo de oxigénio do grupo hidroxilo tem um átomo de selénio).
9-
Alguns aminoácidos existentes em algumas proteínas não são incorporados durante a tradução. São
exemplos a hidroxiprolina [5C,1N,1OH], a hidroxilisina [6C,2N,1OH] e a metil-histidina [7C,3N].
Estes aminoácidos resultam de modificações químicas (catalisadas por enzimas) que ocorrem durante o
processamento que ocorre após a tradução. O colagénio é a proteína mais abundante no organismo
humano e é rica em resíduos de hidroxiprolina contendo também resíduos de hidroxilisina. As proteínas
mais abundantes nas células musculares (também se designam por fibras musculares) são a actina e a
miosina e, nestas proteínas, muitos dos resíduos histidina estão metilados num dos azotos do anel
imidazol.
10-
Nas células existem muitos outros aminoácidos que são intermediários do metabolismo, mas que não
fazem parte de proteínas ou de polipeptídeos: são exemplos a ornitina, a citrulina, a taurina e o
semialdeído do glutamato.
4
Na histidina a cadeia lateral contém um anel heterocíclico com 3 carbonos e 2 azotos designado por imidazol. Apesar de
ser costume classificar a histidina como um aminoácido básico, a verdade é que o pKa da forma livre do anel imidazol é
6,0 e não será muito diferente de 6 quando a histidina é um resíduo de uma proteína. Assim, é de prever que, ao contrário
do que acontece nos casos da arginina e da lisina, a cadeia lateral da maioria das moléculas livres e dos resíduos de
histidina estejam na forma desprotonada. Apesar de, na histidina, a forma protonada só predominar sobre a forma
desprotonada quando o pH do meio é inferir a 6, é frequente agrupar-se a histidina com os outros dois aminoácidos
básicos.
5
Enquanto nos anéis benzénicos (presentes na fenilalanina e na tirosina) os átomos que formam o anel são todos átomos
de carbono, os anéis indol e imidazol dizem-se heterocíclicos porque contêm átomos de carbono e de azoto. O anel indol
(presente no triptofano) pode ser descrito como um anel benzénico ligado a um anel pirrol [4C,1N].
6
Nalguns livros de texto a prolina é classificada como sendo um iminoácido. Na opinião do autor deste texto, a expressão
não é adequada porque num grupo imina existe um átomo de azoto ligado a um átomo de carbono através de uma ligação
dupla e não é isto que acontece na prolina.
Página 3 de 8
Digestão e absorção de proteínas; Rui Fontes
11-
Para além de serem importantes constituintes das células e do espaço extracelular, as proteínas são
também importantes componentes da dieta constituindo na dieta ocidental típica cerca de 15% do valor
calórico total (cerca de 100 g/dia). Tal como os glicídeos, também as proteínas da dieta são hidrolisadas
durante o processo digestivo por ação catalítica de enzimas. O ambiente em que as enzimas digestivas
atuam também é importante e, neste contexto, tem importância a secreção de ácido clorídrico pelas
células parietais do estômago e a neutralização deste ácido pelo bicarbonato (HCO3-) presente no suco
pancreático e na bílis.
12-
O ácido clorídrico é segregado nas células parietais do estômago podendo o pH do estômago ser da
ordem de 1-2. O processo envolve a conversão do CO2 em ácido carbónico por ação catalítica da
anídrase carbónica (ver Equação 2) e a subsequente dissociação do ácido carbónico (protólise) em
bicarbonato + protão no citoplasma das células parietais (ver Equação 3). No polo apical (luminal)
destas células a ATPase do H+/K+ catalisa a troca de H+ que sai (contra gradiente) por K+ que entra
(também contra gradiente); a componente exergónica do processo é a hidrólise do ATP. No transporte
de Cl- do sangue para o lúmen estão envolvidos transportadores: no polo basal (contraluminal) existe
um antiporter que troca Cl- (que entra para a célula) por HCO3- (que sai para o sangue); no polo apical
existe um canal iónico que permite a saída do Cl- para o lúmen. Assim, quando as células parietais são
estimuladas a segregar ácido clorídrico para o lúmen do estômago, o bicarbonato que resultou da
dissociação do ácido carbónico vai alcalinizar o plasma sanguíneo.
As células que forram o estômago não são normalmente agredidas pelo ácido porque estão protegidas
pelo muco (que é rico em mucina, uma glicoproteína muito resistente à ação hidrolítica das protéases).
O pH ácido do estômago tem importância na digestão gástrica porque é o pH adequado para a ação das
enzimas que aqui atuam (lípase gástrica e pepsina) e provoca desnaturação das proteínas da dieta
facilitando o acesso das enzimas à cadeia aminoacídica destas proteínas.
A estimulação da secreção ácida resulta de estímulos nervosos (via nervo vago), da ação parácrina da
histamina (sintetizada por células, designadas por enterocromafins, localizadas por debaixo da mucosa
gástrica) e da hormona gastrina. A gastrina é sintetizada por células endócrinas localizadas na mucosa
gástrica e, para além de estimular a secreção de ácido, também estimula a secreção das enzimas
digestivas gástricas por células que são designadas por células principais.
Equação 2
Equação 3
13-
CO2 + H2O ↔ H2CO3
H2CO3 ↔ H+ + HCO3-
Ao contrário da lípase gástrica e da pepsina, as enzimas que atuam no lúmen do duodeno e do intestino
têm pHs ótimos próximos da neutralidade. No lúmen do duodeno o ácido do estômago é neutralizado
pelo HCO3- dos sucos pancreático e biliar produzindo-se ácido carbónico que, rapidamente (mesmo na
ausência de anídrase carbónico), se converte em CO2 e H2O (ver Equação 3 e Equação 2). O CO2 é um
gaz que passa por difusão simples (não mediada) para o sangue e acaba por sair do organismo nos
pulmões. O pH 7-8 do lúmen intestinal é adequado para a ação das enzimas digestivas
pancreáticas e intestinais. O bicarbonato é sintetizado e segregado num processo em que também
participa a anídrase carbónica (ver Equação 2 e Equação 3) e que ocorre nas células dos canalículos
pancreáticos. Tal como nas células parietais do estômago, através da ação da anídrase carbónica e a
subsequente protólise formam-se protões e iões bicarbonato no citoplasma das células (ver Equação 2 e
Equação 3). No entanto, ao contrário do que acontece nas células parietais, o bicarbonato sai no polo
luminal (via trocador Cl-/HCO3-) sendo um componente do suco pancreático, enquanto o protão sai para
o sangue no polo basal via transporte ativo primário ou secundário.
O estímulo para a secreção de bicarbonato tem origem na secretina, uma hormona sintetizada por
células endócrinas situadas no epitélio intestinal. A secretina também tem ação estimuladora na
secreção exócrina pancreática de enzimas digestivas mas, neste papel, tem maior relevância a
colecistocinina. A colecistocinina é uma outra hormona sintetizada por outras células endócrinas
situadas no mesmo epitélio intestinal e, para além de estimular a secreção de enzimas digestivas
pancreáticas (pelas células acinares do pâncreas), também estimula a contração da vesícula biliar e a
consequente descarga de bílis no lúmen duodenal. A síntese destas duas hormonas é estimulada pela
presença de oligopeptídeos no lúmen duodenal; estes oligopeptídeos resultaram da ação da pepsina nas
proteínas da dieta.
Página 4 de 8
Digestão e absorção de proteínas; Rui Fontes
14-
Na digestão das proteínas que, num dado momento, estão presentes no lúmen do tubo digestivo
participam protéases (hidrólases de proteínas) com origem nas células principais do estômago
(pepsina), nas células acinares pancreáticas (tripsina, quimotripsina, elástase e carboxipeptídase A e
B) e nos enterócitos (aminopeptídases e dipeptídases). Por ação destas enzimas ocorre rotura das
ligações peptídicas das proteínas gerando-se peptídeos com tamanho cada vez menor e, no final do
processo, aminoácidos.
A pepsina, a tripsina, a quimotripsina, a elástase e a enteropeptídase (ver abaixo) dizem-se
endopeptídases porque catalisam a rotura de ligações peptídicas situadas no “interior” da estrutura
primária dos seus substratos. Pelo contrário, as carboxipeptídases (libertam o aminoácido da
extremidade carboxílica), as aminopeptídases (libertam o aminoácido da extremidade amina) e as
dipeptídases dizem-se exopeptídases porque atuam em ligações peptídicas das extremidades e da sua
ação catalítica resulta a libertação de aminoácidos. Embora sejam muito inespecíficas no que se refere
aos seus substratos, cada uma das enzimas proteolíticas atua preferencialmente em ligações peptídicas
que envolvam determinados aminoácidos e estas “preferências” são diferentes de enzima para enzima7.
As protéases e peptídases digestivas são capazes de catalisar a hidrólise das proteínas da dieta, das
proteínas que fazem parte das células da mucosa que “descamam” (em constante renovação), assim
como das próprias enzimas digestivas (que também são proteínas 8 ). De facto, se admitirmos uma
ingestão diária de cerca 60-80 g de proteínas na dieta, uma massa semelhante de proteínas endógenas é
diariamente vertida no lúmen digestivo e apenas uma fração menor (o equivalente a cerca de 10 g de
proteínas/dia) de produtos de origem proteica aparece nas fezes [1]. A maior parte do azoto das fezes é
constituinte das proteínas das bactérias que povoam o intestino grosso. Estas bactérias usam os produtos
nitrogenados que escaparam à absorção no intestino delgado como substratos do seu metabolismo
aminoacídico e para a sua síntese proteica [2].
15-
A pepsina é segregada no estômago como um zimogénio inativo (pepsinogénio) que, em contacto com
o pH ácido do estômago, se hidrolisa gerando a enzima ativa (pepsina) e um polipeptídeo inativo (ver
Equação 4). A separação do polipeptídeo torna o centro ativo da enzima acessível aos seus substratos. A
ativação do pepsinogénio também ocorre por autocatálise: a própria pepsina tem atividade hidrolítica
sobre o pepsinogénio promovendo a ativação deste a pepsina.
Equação 4
16-
zimogénio + H2O → enzima ativa + polipeptídeo inativo
As protéases de origem pancreática também são segregadas como zimogénios inativos; são o
tripsinogénio, o quimotripsinogénio, a pró-elástase e as pró-carboxipeptídases A e B.
No duodeno e jejuno proximal, a enteropeptídase (às vezes impropriamente designada por
enteroquínase) catalisa a hidrólise do tripsinogénio levando à formação de tripsina (ver Equação 4). (A
enteropeptídase é uma endopeptídase e, por isso, na sua ação sobre o tripsinogénio, resulta a tripsina e
um polipeptídeo inativo.) A tripsina formada vai, por sua vez, catalisar a hidrólise do
quimotripsinogénio, da pró-elástase e das pró-carboxipeptídases A e B levando à formação de enzimas
ativas, que se designam, respetivamente, por quimotripsina, elástase e carboxipeptídases A e B (ver
Equação 4). Até há pouco tempo pensava-se que, à semelhança do que acontece no caso do
pepsinogénio/pepsina, a tripsina podia hidrolisar a ligação peptídica que leva à conversão de
tripsinogénio em tripsina, mas não é essa a convicção atual; esta conversão é estritamente dependente
da ação da enteropeptídase [2]. A enteropeptídase é uma ectohidrólase que está “ancorada” na
membrana apical dos enterócitos do intestino delgado proximal com o centro ativo voltado para o
lúmen. Esta localização faz com que a ativação do tripsinogénio e a consequente ativação dos outros
zimogénios apenas ocorra no lúmen do tubo digestivo.
7
A pepsina atua preferencialmente em ligações peptídicas em que o aminoácido que participa com o grupo carboxilo é
um aminoácido aromático e hidrofóbico (concretamente o triptofano, tirosina, fenilalanina ou leucina); ou seja, se
representarmos a proteína alvo pela sequência AA(1-N terminal)-…-AA(x-1)-AA(x)-…-AA(carboxilo terminal), a pepsina tem
preferência por ligações peptídicas AA(x-1)-AA(x) em que o aminoácido AA(x-1) é um dos aminoácidos listados acima. No
caso da quimotripsina a preferência é semelhante. No caso da tripsina o aminoácido AA(x-1) é a arginina ou a lisina e no
caso da elástase é a glicina, a alanina ou a serina.
8
As enzimas digestivas são extensamente glicosiladas e isto faz com que sejam relativamente maus substratos da ação
digestiva; por isso, a sua hidrólise ocorre de forma relativamente lenta e a sua inativação é tardia.
Página 5 de 8
Digestão e absorção de proteínas; Rui Fontes
17-
Da ação combinada das enzimas proteolíticas pancreáticas e da pepsina resultam alguns aminoácidos
livres e polipeptídeos, mas a digestão destes últimos continua por ação de outras ectohidrólases
(aminopeptídases e outras peptídases) que, tal como a enteropeptídase, estão ancoradas na membrana
apical dos enterócitos. (A fosfátase alcalina é também uma ectohidrólase da membrana dos enterócitos
que catalisa a desfosforilação hidrolítica de fosfoproteínas.) Estes processos podem levar à formação de
aminoácidos livres no lúmen intestinal, mas a absorção pode ocorrer em fases menos avançadas da
digestão das proteínas [3].
18-
A absorção ocorre nos enterócitos, cuja membrana apical tem múltiplas projeções em forma de
“dedo” que se designam de microvilosidades: ao conjunto dá-se o nome de bordadura em escova. Por
sua vez, os enterócitos e outras células do epitélio intestinal formam uma camada epitelial contínua que
limita projeções digitiformes que se designam de vilosidades intestinais. Quer as microvilosidades quer
as vilosidades intestinais contribuem para aumentar enormemente a área de absorção. A absorção das
proteínas é um processo complexo podendo fazer-se na forma de aminoácidos, de dipeptídeos, de
tripeptídeos ou mesmo de proteínas inteiras.
19-
No polo apical dos enterócitos, o transporte dos aminoácidos envolve vários simportes em que, na
maioria dos casos, o Na+ é cotransportado com os aminoácidos (transporte ativo secundário em que o
componente exergónico é o transporte de Na+)9. No caso dos di- e tripeptídeos o único transportador
conhecido é um simporte peptídeo/H+ (PEPT1; da expressão inglesa “peptide transporter 1”)
altamente inespecífico relativamente aos aminoácidos constituintes do peptídeo transportado [3]. A
energia envolvida neste transporte é, pelo menos em parte, a que resulta do gradiente eletroquímico do
protão. Os protões têm tendência a entrar nas células devido ao potencial elétrico ser negativo no
interior, acoplando (via PEPT1) a entrada de di- e tripeptídeos. Os protões presentes no lado luminal da
membrana apical dos enterócitos resultaram da ação de um trocador Na+/H+ que catalisa a troca de um
protão que sai para o lúmen por um ião Na+ que entra a favor do gradiente eletroquímico.
20-
Os di- e tripeptídeos e outros peptídeos incompletamente digeridos que foram absorvidos são
maioritariamente hidrolisados por diversas peptídases do citoplasma dos enterócitos.
Na membrana baso-lateral (polo basal) dos enterócitos, os múltiplos sistemas transportadores de
aminoácidos são distintos dos que existem no polo apical e, na maioria dos casos, são uniportes, não
envolvendo cotransporte de iões inorgânicos. Na maioria dos casos, os aminoácidos que entraram para
os enterócitos ou foram aí libertados via hidrólise de peptídeos entram na corrente sanguínea através do
sistema porta hepático. No entanto, alguns aminoácidos (com particular destaque para a glutamina) são,
em grande parte, oxidados nos enterócitos sendo aqui importantes nutrientes do ponto de vista
energético [3]. O transporte catalisado pelos uniportes da membrana baso-lateral é passivo, ou seja, o
sentido em que ocorre depende do gradiente de concentrações: participam na absorção de aminoácidos
dos enterócitos para o sangue mas, em condições metabólicas em que os enterócitos estão a consumir
aminoácidos presentes no plasma sanguíneo, catalisam o transporte de aminoácidos em sentido inverso.
21-
Apesar de existirem enzimas capazes de hidrolisar completamente as proteínas da dieta, algumas
moléculas escapam ao processo e podem aparecer intactas no plasma sanguíneo. A absorção de
proteínas inteiras pode ocorrer por dois mecanismos. Um deles, designado por transcitose, envolve a
endocitose no polo luminal dos enterócitos e a subsequente exocitose no polo basal. O outro, designado
por transporte paracelular, envolve a passagem das moléculas proteicas através dos espaços entre os
enterócitos; isto pode ocorrer quando há lesão das junções impermeáveis (tight junctions) que
normalmente impedem esta passagem. A entrada de moléculas proteicas do lúmen intestinal para o
sangue é mais frequente nos bebés que nos adultos e permite que os anticorpos presentes no leite
materno desempenhem um papel na proteção do bebé. No entanto, uma outra consequência é a maior
propensão para a ocorrência de alergias alimentares nos bebés.
1. Matthews, D. E. (2006) Proteins and aminoacids in Modern Nutrition in Health and Disease (Shils, M. E., ed) pp. 23-61,
Lippincott, Phyladelphia.
2. Moughan, P. & Stevens, B. (2013) Digestion and absorption of proteins in Biochemical, physiological and molecular aspects of
human nutrition (Stipanuk, M. H. & Caudill, M. A., eds) pp. 162-178, Elsevier, St. Louis.
9
No caso de aminoácidos com carga global positiva (como a arginina e a lisina) o transporte pode não depender do Na+,
mas depende também da ação da ATPase do Na+/K+: a energia envolvida no processo é o potencial elétrico negativo no
interior das células (criado pela ATPase do Na+/K+) que atrai os aminoácidos com carga global positiva.
Página 6 de 8
Digestão e absorção de proteínas; Rui Fontes
3. Daniel, H. (2004) Molecular and integrative physiology of intestinal peptide transport, Annu Rev Physiol. 66, 361-84.
Fig. 1. O tetrapeptídeo seril-valil-alanil-glicina. Os peptídeos são designados nomeando os aminoácidos
constituintes da extremidade amina até à extremidade carboxilo. Com exceção do aminoácido da extremidade
carboxilo os outros aminoácidos são referidos substituindo os seus nomes pelos nomes dos respetivos acilos.
Por exemplo em vez de alanina escreve-se alanil, em vez de valina escreve-se valil, etc; a alanil-glicina é um
dipeptídeo que contém o grupo carboxilo da alanina ligado por uma ligação peptídica à glicina.
Página 7 de 8
Digestão e absorção de proteínas; Rui Fontes
Fig. 2: Vinte aminoácidos dos 21 aminoácidos que são incorporados nas proteínas durante a
tradução.
Fig. 3: Estrutura da alanina que existe nos seres vivos (alanina L).
Página 8 de 8