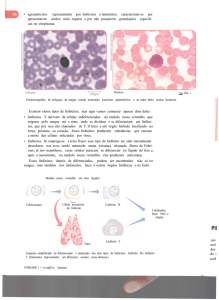
O linfócito B origem e diferenciação em plasmócito.
por Renato Beilner Machado
A produção dos linfócitos B, primariamente acontece no saco vitelínico, fígado
fetal e medula óssea e após o nascimento a produção dos linfócitos B se limita apenas a
medula óssea.
A medula óssea garante um microambiente ideal para o desenvolvimento dos
linfócitos B e todas as outras células hematopoiéticas. Há na medula óssea uma célula
tronco pluripotente que tem como característica uma alta plasticidade, onde é capaz de
se diferenciar em qualquer célula sanguínea. Esta célula tronco pluripotente, quando
recebe estímulos específicos pode se diferenciar em um progenitor linfóide comum
(CLP) ou em um progenitor mielóide comum (CMP). Tanto o CLP quanto o CMP
continuam tento uma certa plasticidade, pois o CMP é capaz de se diferenciar nos
granulócitos, monócitos, eritrócitos e plaquetas, enquanto o CLP esta comprometido a
se diferenciar em linfócitos B, linfócitos T, células NK e NKT.
Há 2 tipos de nichos presente na medula óssea: o nicho vascular e o nicho
osteoclástico. O nicho osteoclástico é formado por uma variedade de células como
osteoblastos e células estromais. Nesse nicho há produção de algumas quimiocinas e
citocinas como, interleucina 7 (IL-7) e CXCL12. Os CLPs que expressam o receptor
CXCR4 é atraído para este nicho através da quimiocina CXCL12.
Quando o CLP chega neste nicho, haverá uma interação delas com as células do
estroma através da interação das moléculas VCAM-1 presente nas células do estroma,
com a molécula VLA-4 presente no CLP. Após esta interação "primária", a molécula Ckit que é expressa pelas CLP interagem com o SCF (stem cell factor) das células do
estroma. Esta interação promoverá uma cascata bioquímica que gerará a transcrição de
fatores de transcrição como, E2A e PU.1. Uma tirosina quinase chamada de tirosina
quinase de Bruton's também atuará nessa fase onde o CLP passa a ser um pró-B
precoce. Nessa transição de CLP para pró-B precoce acontecerá o início da
recombinação DJ da cadeia pesada da imunoglobulina. Os fatores de transcrição E2A e
PU.1 irão promover a transcrição de outros fatores de transcrição que atuarão na
formação da cadeia α da interleucina 7 e na transição da célula pró-B precoce para a
pró-B tardia, onde haverá a recombinação da região DJ com a V, formando assim a
cadeia pesada da imunoglobulina.
A transição do pró-B tardio para o pré-B grande é marcado pela presença do
receptor α da interleucina 7 e a formação de um pré-BCR. Este pré-BCR é formado pela
região pesada da imunoglobulina que é funcional, juntamente com uma falsa cadeia
leve, formada por λ5 e V-pré BCR.
A atuação da IL-7 na célula pré-B grande, fará a transcrição dos fatores E2A e
EBF-1 que resultará na ativação do fator LEF-1. Este último fator é essencial para a
expansão (divisão) do pré-B grande em pré-B pequeno. Na fase de pré-B pequeno não
haverá mais a expressão do pré-BCR e estas células sofrerão a influência de TGF- β.
TGF- β é importante para fechar a região gênica que codifica para a cadeia pesada da
imunoglobulina, impedindo que a RAG1 e RAG2 atuem novamente nessa região,
propiciando assim que estas enzimas RAG1 e RAG2, Artemis e Tdt, atuem na região
gênica que codifica para a cadeia leve da imunoglobulina. Quando a recombinação
somática da cadeia leve gera uma proteína funcional, ela se unirá a cadeia pesada e será
transportada para a membrana externa da célula. Além da geração das cadeias leves e
pesadas funcionais é necessário a correta interação entre Igα e Igβ pelas pontes de
dissulfeto. Após a geração do BCR com as cadeias leve e pesada a célula se torna uma
célula B imatura. Nesta fase haverá a seleção positiva e negativa, onde os linfócitos B
que reconhecerem o próprio passam pela edição da cadeia leve da imunoglobulina,
enquanto que os linfócitos B que não reconhecerem o próprio, além de IgM começam a
expressar IgD. Este linfóctio B está pronto para sair da medula óssea e ir para os órgãos
linfóides secundários, como linfonodos, baço e tecido linfóide associado a mucosa
(MALT) para terminarem sua maturação.
Os linfócitos B que saem da medula óssea, vão para a corrente sanguínea e
entram nos linfonodos pelas artérias eferentes, enquanto a linfa chega pelos vasos
aferentes. Microrganismos que penetram no organismo são reconhecidos e capturados
por células apresentadoras de antígenos (APCs) e são drenados para a linfa e
direcionado aos linfonodos ou os microrganismos podem entrar na linfa sem auxílio das
APCs.
O contato do patógeno com o linfócito B fará com que ele reconheça o patógeno
e se torne um B blasto. Este contato pode ativar o linfócito B e estimular a produção de
IgM de baixa afinidade que ajudará na resposta humoral primária, onde estes anticorpos
IgM se ligarão ao antígeno (opsonizando) facilitando o reconhecimento por APCs que
possuem um receptor para a porção Fc das imunoglobulinas. Esta célula é chama de
plasmócito de vida curta.
Outro caminho que o linfóctio B pode percorrer é ir para o centro germinativo.
No linfonodo existe duas áreas: área de linfócito T e área de linfócito B. O linfócito T
reconhece o antígeno através de células dendríticas foliculares e são ativados. Na zona
de linfócito B haverá a apresentação do antígeno ao linfócito B, que será processado e
expressado via MHC II. Haverá uma down regulação nos receptores de quimiocina
CXCR5 e uma up regulação do receptor CXCR7. Com isso o linfócito B sairá da zona
de B ao encontro do linfócito T. Quando acontece a interação perfeita entre o linfócito T
e B, haverá a expressão de CD40L, ocorrendo assim a interação de CD40 e CD40L.
Esta interação ativará fatores de transcrição como AID que é a enzima essencial para a
troca de classe das imunoglobulinas. Se não acontece a interação forte entre o linfócito
T e B, o linfócito B volta e refaz a hipermutação somática.