Unidade Barreiros
Professor(a):
Marlon Cordeiro
Data da Prova:
/
Disciplina:
Química
/ 2013
Série:
Revisão
1ª série
Turma:
Aluno(a):
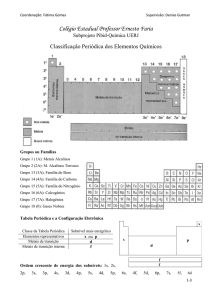
1. Os
elementos
na
tabela
periódica
encontram-se em ordem crescente de:
a.
b.
c.
d.
e.
Número de massa
Número atômico
Massas atômicas
Reatividade química
Pesos atômicos
7. O ar é uma mistura de vários gases.
Dentre eles, são gases nobres:
Nitrogênio, Oxigênio, Argônio
Argônio, Hidrogênio, Nitrogênio
Hélio, Hidrogênio, Nitrogênio
Hélio, Argônio, Neônio
Nitrogênio, Oxigênio, Hidrogênio
a.
b.
c.
d.
e.
2. Cada elemento químico tem associado ao
seu nome um símbolo que o representa. Escolha
a(s) opção(ões) que associa(m) corretamente
nomes e símbolos.
01. S= Enxofre, F = Flúor
02. Ag = Prata, O = Oxigênio
04. Pb = Chumbo, Po = Potássio
08. C = Carbono, Au = Ouro
16. N = Nitrogênio, H = Hélio
32. Fe = Ferro, Na = Sódio
64. Hg = Mercúrio, P = Polônio
3. Pertence aos metais alcalinos o elemento:
a.
b.
c.
d.
e.
Ferro
Cobre
Potássio
Oxigênio
Magnésio
4. É um metal alcalino terroso o elemento:
a.
b.
c.
d.
e.
Sódio
Flúor
Potássio
Estrôncio
Ferro
5. Pertence à família dos calcogênios o:
a.
b.
c.
d.
e.
a.
b.
c.
d.
e.
N
O
I
F
Cl
6. Qual dos elementos representados abaixo
é um halogênio?
P
Na
C
Br
S
8. Fazendo a associação entre as colunas
abaixo, que corresponde às famílias de
elementos segundo a tabela periódica, a
seqüência numérica será:
I – Gases Nobres
II – Metais Alcalinos
III – Metais Alcalinos Terrosos
IV – Calcogênios
V – Halogênios
(
(
(
(
(
a.
b.
c.
d.
e.
)
)
)
)
)
Grupo
Grupo
Grupo
Grupo
Grupo
1,
2,
3,
3,
5,
2,
3,
2,
2,
2,
1A
2A
6A
7A
0
3,
4,
5,
4,
4,
4,
5,
4,
5,
3,
5
1
1
1
1
9. Um átomo X tem um próton a mais que um
átomo Y. Com base nessa informação, assinale
a alternativa correta:
Se Y for um alcalino terroso, X será um metal
alcalino.
b. Se Y for um gás nobre, X será um halogênio
c. Se Y for um metal de transição, X será um
gás nobre
d. Se Y for um gás nobre, X será um metal
alcalino
e. Se Y for um halogênio, X é um calcogênio
10. Das alternativas indicadas a seguir, qual é
constituída por elementos da tabela periódica
com propriedades químicas distintas?
a.
a.
b.
c.
d.
He, Ne, Ar
Mg, Ca, Sr
Li, Be, B
F, Cl, Br
11. Nos garimpos utiliza-se mercúrio para
separar o ouro das impurezas. Quando o
mercúrio entra em contato com a água dos rios,
causa uma séria contaminação: é absorvido por
microorganismos,
ingeridos
pelos
peixes
pequenos, os quais são devorados pelos peixes
grandes, que são usados na alimentação
humana. Podemos prever, com o auxílio da
tabela periódica, que o elemento pertencente à
mesma família do mercúrio é:
a.
b.
c.
d.
e.
Platina
Carbono
Cobre
Argônio
Zinco
12. Analise as afirmativas abaixo:
I.
O número do período não indica o
número de camadas dos átomos desse
período.
II.
Um átomo da família 2A apresenta 2
elétrons na última camada.
III.
Os elementos de uma mesma família
apresentam propriedades químicas
semelhantes.
IV.
Os elementos transurânicos são todos
os elementos situados antes do urânio
na tabela periódica.
V.
Os elementos de transição interna
estão
contidos
nas
séries
dos
lantanídeos e na série dos actinídeos.
Assinale a alternativa correta:
a.
b.
c.
d.
e.
III, IV e V.
II, III, IV e V.
I, II e III.
II, III e V.
I, II, III e V.
13. Os metais são elementos que apresentam
1, 2 ou 3 elétrons no último nível energético.
Constituem cerca de 76% dos elementos da
tabela periódica. São bons condutores de
eletricidade e calor, são dúcteis e brilhantes.
Marque com um X os elementos abaixo que são
metais.
(
(
(
(
(
(
(
)
)
)
)
)
)
)
c.
d.
e.
15. O nitrogênio, fósforo e potássio são
utilizados na formulação de adubos e
aparecem nos rótulos com a sigla NPK.
Estes elementos são classificados na
tabela periódica como:
a.
b.
c.
d.
e.
a.
b.
c.
d.
e.
Flúor
Cloro
Bromo
Iodo
Astato
17. Um elemento químico A apresenta
propriedades químicas semelhantes à do
Oxigênio. A pode ter configuração
eletrônica:
a.
b.
c.
d.
e.
1s2
1s2
1s2
1s2
1s2
2s2
2s2
2s2
2s2
2s2
2p6
2p6
2p6
2p6
2p6
3s2
3s2 3p1
3s2 3p3
3s2 3p4
18. Os elementos que possuem na última
camada:
I.
4s2
II.
3s2 3p5
III.
2s2 2p6
IV.
2s1
Classificam-se dentro dos grupos da tabela
periódica respectivamente como:
a. Alcalino-terroso, halogênio, alcalino e gás
nobre.
b. Halogênio, alcalino-terroso, alcalino e gás
nobre.
c. Gás nobre, halogênio, calcogênio e gás
nobre
d. Alcalino-terroso, halogênio, gás nobre e
alcalino
e. Alcalino-terroso, calcogênio, alcalino e gás
nobre.
Fósforo
Chumbo
Cobre
Sódio
Enxofre
Potássio
Estanho
B, Al e Sb
Ge, As e Sb
Metal, não metal e metal.
Não metal, não metal e metal.
Gás nobre, metal e metal.
Metal, metal e não metal.
Semimetal, metal e não metal.
16. Dentre os halogênios, nas condições
ambientes de pressão e temperatura, o
único líquido é:
19. O elemento químico que apresenta
configuração eletrônica 1s2 2s2 2p6 3s2 3p3
está localizado, na tabela periódica:
14. Dos grupos de elementos químicos que
compõe
a
tabela
periódica,
são
semimetais ou (matalóides):
a.
b.
P, Se e Sn
Be, Mg e Ca
Ar, Kr e Xe
a.
b.
c.
No quarto período e grupo 3A
No terceiro período e grupo 3A
No quarto período e grupo 2A
d.
e.
No segundo período e grupo 3B
No terceiro período e grupo 5A
20. Considerando que um elemento químico
apresenta número atômico Z = 34,
assinale a alternativa correta.
a.
b.
c.
d.
e.
Pertence ao 5º Período da tabela periódica.
O elemento químico em questão se situa no
4º período da tabela periódica e pertence ao
grupo 2A, família dos alcalinos terrosos.
O elemento em questão pertence ao grupo 7A
dos halogênios e ao 4º Período da tabela
periódica.
O elemento químico pertence ao grupo B,
metais de transição.
O elemento químico pertence ao grupo 6A
calcogênios, e ao 4º período da tabela
periódica.
26. O elemento da família dos gases nobres
que apresenta a maior energia de
ionização é o:
a.
b.
c.
d.
e.
27. Do terceiro período da tabela periódica, o
elemento mais eletronegativo é o:
a.
b.
c.
d.
e.
a.
b.
c.
d.
e.
1s2
1s2
1s2
1s2
1s2
2s1
2s2
2s2
2s2
2s2
23. Os médicos costumam prescrever às
pessoas que apresentam pressão alta uma dieta
com baixo teor de sódio. Na verdade, a
recomendação médica refere-se à ingestão de
íons sódio (Na+) quando consumimos
principalmente sal de cozinha (Na+Cl-).
a. Entre o íon Na+ e o átomo Na, qual
tem menor raio atômico?
24. Dentre os metais alcalinos terrosos, o que
tem maior caráter metálico é o:
a.
b.
c.
d.
e.
Be
Sr
Ca
Ba
Mg
25. Um elemento que tem raio atômico
grande e pequena energia de ionização,
provavelmente, é um:
a.
b.
c.
d.
e.
a.
b.
c.
d.
2p1
2p5
2p6 3s2 3p5
2p6 3s2 3p6 4s1
Metal
Semimetal
Halogênio
Não metal
Gás nobre
Na
P
Ar
Al
Cl
28. Eletronegatividade é uma propriedade
periódica importante. Em relação a essa
propriedade,
assinale
a
alternativa
correta:
21. Dada a distribuição eletrônica 1s2 2s2 2p6
3s2 3p6 4s2 3d10 4p5, indique o período e o
grupo a que pertence este elemento e que
elemento é este.
22. O elemento de maior eletronegatividade é
o que apresenta a seguinte configuração
eletrônica:
Rn
Xe
Kr
Ar
He
e.
O potássio é mais eletronegativo que o cálcio
O carbono é mais eletronegativo que o silício
O sódio é o mais eletronegativo de todos os
elementos.
O flúor é o menos eletronegativo de todos os
elementos
O frâncio é o mais eletronegativo de todos os
elementos
29. Dados os seguintes elementos químicos,
indique as proposições corretas:
a.
b.
c.
d.
e.
O
O
O
O
O
Li
Fr
He
F
Cl
Al
flúor é mais eletronegativo que o frâncio
elemento lítio é um metal alcalino.
elemento hélio é um gás nobre
elemento cloro pertence à família 7A
elemento alumínio é um semimetal
30. A energia liberada quando um elétron é
adicionado a um átomo neutro gasoso é
chamada de:
a.
b.
c.
d.
e.
Entalpia de formação
Afinidade eletrônica
Eletronegatividade
Energia de ionização
Energia de ligação
GABARITO:
1.B 2. 43 3. C 4. D 5. B 6. D
7.D 8. B 9.D 10.C 11.E 12. D
13. Chumbo, Cobre, Sódio, Potássio, Estanho
14. B 15.B 16.C 17.E 18.D 19.E 20.E
21. 4° Período, Grupo 7ª 22. C 23.Na+
24. D 25.A 26.E 27.E 28. B 29.A,b,c,d
30. B