Aula: 28
Temática: Efeito da Temperatura na Velocidade de Reação
Em grande parte das reações, as constantes de velocidade aumentam
com o aumento da temperatura. Vamos analisar esta dependência.
A teoria de Arrhenius parte do princípio de que é necessária a colisão entre
as moléculas para que ocorra uma reação. O fato das reações terem
velocidades diferentes levou Arrhenius a elaborar a proposta de molécula
ativada. Assim, somente a colisão entre as moléculas ativadas é efetiva para a
formação do produto. As moléculas ganham e perdem energia através das
colisões; quando uma determinada molécula atinge uma energia mínima para
reagir, esta se torna ativada. O choque (colisão) entre moléculas ativadas leva
à formação de produto.
Experimentalmente, para muitas reações o gráfico ln k × 1/T caracteriza uma
reta, cuja equação da reta é expressa, normalmente, na forma da equação de
Arrhenius:
ln k = ln A −
Ea
RT
Quando 1/T tem valor zero, o parâmetro A, dado pela ordenada à origem, é
chamado fator pré-exponencial ou fator de frequência. O parâmetro Ea
obtido pelo coeficiente angular da reta (− Ea / R) é chamado energia de
ativação. Estes dois parâmetros são os parâmetros de Arrhenius.
A energia de ativação é a energia mínima necessária para as moléculas
reagirem. Como Ea determina o coeficiente angular da reta (ln k × 1/T), quanto
mais alta a energia de ativação, mais forte a dependência entre a constante de
velocidade e a temperatura. No gráfico esta tendência se apresenta por uma
reta mais inclinada. A independência da constante de velocidade em relação à
temperatura é indicada por uma energia de ativação nula. Se a energia de
ativação tiver valor negativo representa a diminuição da constante de
FÍSICO-QUÍMICA
velocidade com o aumento da temperatura. Este comportamento indica que o
mecanismo da reação é complicado.
Na discussão da variação da constante de velocidade em função da
temperatura interpretamos os parâmetros de Arrhenius como puramente
empíricos. A equação de Arrhenius exposta anteriormente pode ser escrita
como:
k = Ae − E
a
RT
Sendo a energia de ativação, Ea, a energia cinética mínima que os reagentes
devem ter para que os produtos sejam formados, usando como exemplo uma
reação em fase gasosa, na qual são numerosas as colisões por segundo,
apenas uma pequena parte destas colisões envolve energia suficiente para
provocar a reação. A quantidade de colisões com energia superior à energia de
ativação é dada pela distribuição de Boltzmann, por e-Ea
/ RT
. Então, o fator
exponencial da equação indica a fração de colisões que possuem energia
suficiente para que a reação avance, ou seja, a fração de colisões ativadas.
O fator pré-exponencial, A, é uma medida do número de colisões total,
independente da energia. Logo, se multiplicamos o número de colisões total
pela fração de colisões ativadas, temos como resultado uma medida das
colisões bem-sucedidas.
Nos casos das reações que não apresentam gráfico ln k × 1/T retilíneo, a
relação entre a constante de velocidade e a temperatura não uma função de
Arrhenius. A energia de ativação pode ser então, definida:
Ea = RT 2
d ln k
dT
Aqui a energia de ativação é obtida a partir do coeficiente angular da tangente
à curva de ln k × 1/T, em qualquer temperatura, para dependência não linear.
FÍSICO-QUÍMICA
Para os casos nos quais as constantes de velocidade teóricas diferem das
experimentais, definimos um fator de correção P chamado fator estérico ou de
probabilidade da teoria da colisão. P não afeta o valor de Ea calculado
graficamente.
k = PAe − E
a
RT
O fator estérico P tem valores altos para as reações que requerem uma
orientação das moléculas ativadas e para as reações em cadeia (exemplo de
reação em cadeia é a reação entre hidrogênio e bromo para formação de HBr).
Para as reações em que Ea se distribui pelas várias ligações no complexo
ativado, P tem valor baixo. Já para as reações catalíticas, esta expressão não
se aplica.
A teoria do complexo ativado é fundamentada na teoria de Arrhenius, porém
propõe um equilíbrio entre os reagentes e o estado de transição, conhecido
também como complexo ativado. A molécula ativada é continuamente formada
e consumida, quer seja pela reação que leva ao produto, quer seja pela reação
que volta a reagente. Vejamos a representação da reação, onde C# = complexo
ativado:
A + B C# → Produtos
Pela teoria do complexo ativado a equação de k fica:
k=
RT ∆ S R −∆ H RT
e
e
Nh
#
#
onde N é o número de Avogadro; h é a constante de Planck; ∆#S é a entropia
de ativação (variação de entropia entre complexo ativado e reagentes); ∆#H é a
entalpia de ativação (entre o complexo ativado e os reagentes). Esta variação
de entalpia é:
∆# H = Ea − mRT
m = 1 para sólidos e líquidos
m = 2 para gases
A energia de Gibbs de ativação, ∆#G, é escrita como:
FÍSICO-QUÍMICA
∆#G = ∆# H − T∆# S
Lembremos sempre que a reação espontânea é identificada pela variação da
energia de Gibbs negativa.
Exercícios Propostos
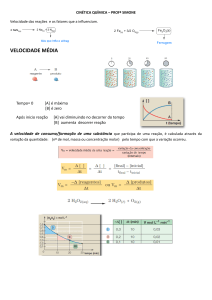
1. A velocidade inicial de uma reação depende da concentração de uma
substância J conforme a seguinte tabela:
[J]0 / 10-3 mol L−1
5,0
8,2
17
30
v0 / 10-7 mol L−1 s−1
3,6
9,6
41
130
Determine a ordem da reação em relação a J e calcule a constante de
velocidade.
2. A lei de velocidade da reação do exercício 2.1 é v = k [A] [B]. Quais as
unidades de k? Dar a lei de velocidade em termos das velocidades de
formação e de consumo de:
a) A
b) C
Estudamos na aula de hoje a dependência entre as constantes de
velocidade e a temperatura. Para tal discussão analisamos a teoria de
Arrhenius ou teoria das colisões da qual definimos seus parâmetros, como a
energia de ativação. Analisamos também a teoria do complexo ativado, e que
estão inseridas as grandezas termodinâmicas.
FÍSICO-QUÍMICA
FÍSICO-QUÍMICA