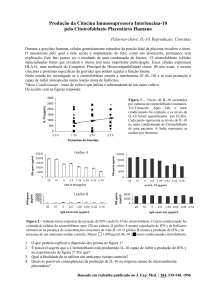
GBPs: Imunidade contra patógenos intracelulares
Já está bem estabelecido que a citocina pró-inflamatória IFN-γ exerce um papel central
na defesa do hospedeiro contra infecções, uma vez que camundongos deficientes da citocina ou
seres humanos com mutações no receptor de IFN-γ são mais suscetíveis a diversos agentes
infecciosos. Acredita-se que o IFN-γ regula a expressão de mais de 1.200 genes, dentre os quais
estão presentes alguns mediadores da resposta imune. Um subconjunto proeminente destes
genes induzidos por IFN-γ inclui uma família de proteínas ligadoras de GTP, coletivamente
denominadas de GTPases, que hidrolisam o GTP em GMP, e desta forma desempenham
diversas funções nas células. Existem 4 sub-famílias de GTPases que contribuem para as
respostas imunes contra uma grande variedade de patógenos, sendo as GBPs (guanylate-binding
proteins) proteínas candidatas envolvidas na imunidade contra microrganismos intracelulares
em humanos, uma vez que são altamente induzidas por IFN-γ. Já foi reportado a participação
destas proteínas na atividade antiviral contra o vírus da estomatite vesicular (VSV) e o vírus da
encefalomiocardite (CMCV) in vitro, no entanto os efeitos antimicrobianos e o mecanismo de
ação das GBPs é ainda limitado. Recentemente, Tietzel e colaboradores, demonstraram que
estas proteínas possuíam um papel na inibição do crescimento de Chlamydia trachomatis. Em
células HeLa infectadas com C. trachomatis e transfectadas com hGBP-1 e hGBP-2, ambas
foram capazes de se localizar na membrana de inclusão da clamídia. Para a hGBP-1, a
localização na membrana de inclusão não requer o domínio de ligação de GTP mas é mediado
pelo domínio helicoidal, que é a região C-terminal de α-hélice onde contém o sítio CaaX para a
adição de lipídeos. Tanto a hGBP-1 como a hGBP-2 sozinhas, foram capazes de inibir o
crescimento de C. trachomatis e esta inibição mostrou ser dependente do domínio GTPase da
hGBP-1. A atividade anti-clamídia é aumentada em conjunção com o tratamento com uma dose
sub-inibitória de IFN-γ (0.05ng/ml), que foi também acompanhada pela diminuição do tamanho
das inclusões. Juntos estes resultados sugerem que as hGBP-1 e hGBP-2 estão envolvidas na
resposta do INF-γ contra a clamídia atuando como proteínas potencializadoras do efeito desta
citocina. No entanto, os mecanismos pelos quais as hGBPs exercem suas atividades
antibacterianas ainda são desconhecidos. Tais mecanismos de ação foram inicialmente
desvendados por Kim e colaboradores. Através de modelos de infecção por Listeria
monocytogenes ou Micobacterium bovis de macrófagos murinos pré-ativados com IFN-γ, as
Gbps 1 e 7 foram identificadas como sendo as principais envolvidas na proteção do hospedeiro
contra bactérias sensíveis a morte induzida por IFN-γ. Os autores observaram que Gbp 7 é
essencial para a associação das moléculas gp91phox-p22phox com as moléculas p40phox-p47phoxP67phox , sendo que essa associação leva a formação do complexo da NADPH oxidase e,
consequentemente, produção de O2-. Além de Gbp 7 ser importante para a proteção oxidante
induzida por IFN-γ contra bactérias intracelulares, esta GTPase também se liga à molécula
Atg4b, participando da formação da membrana do autofagossoma. Concomitante a este
mecanismo ocorre a ligação de Gbp1 à molécula p62. O papel de Gbp 1 na fusão do
autofagossoma ao lisossoma foi demonstrado pelo consumo de p62 (molécula responsável pelo
transporte de peptídeos antimicrobianos ubiquitinados para o autofagossoma) após sua ligação à
Gbp 1. Esses resultados mostram que existe uma cooperação entre as diferentes Gbps na
promoção de uma resposta oxidativa e na entrega de peptídeos antimicrobianos ao
autofagossoma, promovendo uma ampla proteção ao hospedeiro contra diferentes classes de
patógenos. Estes dois trabalhos contribuem para o melhor entendimento das propriedades e dos
mecanismos de ação pelos quais as GBPs estão envolvidas na defesa contra infecções por
patógenos intracelulares.