Avaliação do infiltrado inflamatório e da expressão de IFN-γ e IFN-γ R1,
em mulheres com lesão benigna, neoplasia intraepitelial cervical e
carcinoma epidermóide invasor.
Diego Oliveira Xavier
Ouro Preto – MG - Brasil
Marçode 2014
Universidade Federal de Ouro Preto
Escola de Farmácia
Programa de Pós-Graduação em Ciências Farmacêuticas
(CiPharma)
Avaliação do infiltrado inflamatório e da expressão de IFN-γ e IFN-γ R1,
em mulheres com lesão benigna, neoplasia intraepitelial cervical e
carcinoma epidermóide invasor.
Dissertação apresentada ao Programa de
Pós-Graduação
em
Ciências
Farmacêuticas da Escola de Farmácia da
Universidade Federal de Ouro Preto,
para obtenção do Título de Mestre em
Ciências Farmacêuticas.
Discente: Diego Oliveira Xavier.
Orientador: Cláudia Martins Carneiro.
Ouro Preto – MG - Brasil
Março de 2014
X3a
Xavier, Diego Oliveira.
Avaliação do infiltrado inflamatório e da expressão de IFN-γ e IFN-γ R1, em
mulheres com lesão benigna, neoplasia intraepitelial cervical e carcinoma
epidermóide invasor [manuscrito] / Diego Oliveira Xavier. – 2014.
71f.: il. color., grafs.; tabs.
Orientadora: Profa. Cláudia Martins Carneiro.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Escola de
Farmácia.
Área de concentração: Terapêutica, Vacinas, Diagnóstico e Prognóstico das
Doenças.
1. Colo uterino. 2. Células T. 3. Câncer. 4. Citocinas. I. Carneiro, Cláudia
Martins. II. Universidade Federal de Ouro Preto. III. Título.
Catalogação: [email protected]
Universidade Federal de Ouro Preto
Escola de Farmácia
Programa de Pós-Graduação em Ciências Farmacêuticas
(CiPharma)
Dedico este trabalho...
Aos meus pais, Cleber e Edna e aos meus irmãos,
Hugo, Erica e Cleber Jr.
Aqueles que compartilham minha vida.
Agradecimentos
Aos meus pais, Cleber e Edna, pelos exemplos diários de vida. Por cada gesto que me
permitiu seguir meu caminho.
Á Profa. Dra. Cláudia Martins Carneiro, minha orientadora. Por ter me recebido e permitido
fazer parte de seu trabalho e vida. Por ter me dado à chance de transformar meus desejos em
trabalhos, cultivar minhas ideias e ampliar minha visão. Criando uma ponte, que agora liga
meus sonhos com a realidade. Eternamente grato!
Ao Prof. Dr. Laser Oliveira, pela amizade, disposição e inestimáveis informações que
colaboraram para a realização deste projeto.
As Profas. Dra. Angélica Alves Lima e Andrezza Vilaça Belo Lopes pelas considerações na
banca de qualificação.
Aos meus professores de graduação, que foram os primeiros a me guiar para vida acadêmica:
Andres, Andrezza, Maria Carolina e Silvia Passos Andrade.
Á Tânia e Maria, pela atenção, profissionalismo e carinho com que sempre me prestaram nas
inúmeras vezes em que precisei.
Aos meus companheiros e amigos de mestrado, que dividiram comigo seus sonhos e
ambições. Em especial: Flávia Monteiro, Izabel (Zabelê), Cris, Rita, Ana Paula Alves, Ana de
Battisti, Karen e Shiara. Obrigado pelos incontáveis momentos insanos e cômicos.
Aos meus amigos da especialização em citologia, por terem me dado o gosto da companhia e
as primeiras alegrias em Ouro Preto.
Aos meus amigos de moradia ouro-pretana, Jeferson, Rodrigo e Gustavo. Pelas aventuras e
desventuras que compartilhamos.
Aos amigos de nossa casa “Subterrâneo”: Tandy, Júlia, Gil,Amanda, Atiley, Fernanda,
Daiana, Larissa, Ligia, Leticia, Catarine e Roana.
Aos funcionários do programa de Pós-Graduação em Ciências Farmacêuticas.
Á UFOP, CNPq e CAPES, pelo financiamento e apoio dado a este projeto.
Ás pacientes, cuja carne foi motivo de nosso estudo.
Aos meus grandes e para toda vida amigos: Eduardo, Carlos, Bruno, Fernando e Priscila.
Aos que momentaneamente fizeram parte e deram alegria a minha vida, cujos rostos passam
agora, como flashes em minha mente.
A todos, meu Muito Obrigado!
“A ausência da evidência não significa evidência da ausência.”
Carl Sagan
Sumário
1
INTRODUÇÃO ............................................................................................................. 4
2
REVISÃO DA LITERATURA .................................................................................... 16
3
4
2.1
O Sistema Imune e a Imunovigilância ao Câncer ................................................... 17
2.2
Colo do útero ......................................................................................................... 18
2.3
NeoplasiaIntraepitelial Cervical (NIC) ................................................................... 20
2.4
Papilomavirus humano (HPV) ............................................................................... 21
2.5
Resposta imune contra o HPV................................................................................ 23
2.6
IFN-γ e o Receptor IFN-γ R1 ................................................................................. 24
2.7
Imunoistoquímica(IHQ) ......................................................................................... 26
OBJETIVOS ................................................................................................................ 28
3.1
Objetivo geral ........................................................................................................ 29
3.2
Objetivos específicos ............................................................................................. 29
METODOLOGIA ........................................................................................................ 30
4.1
Desenho do estudo ................................................................................................. 31
4.2
Amostragem .......................................................................................................... 31
4.3
Critérios de inclusão, exclusão e organização das amostras .................................... 32
4.4
Histologia .............................................................................................................. 32
4.4.1
Preparo das laminas para coloração em Hematoxilina-Eosina - HE ................. 32
4.4.2
Análise das laminas coradas em HE ................................................................ 32
4.4.3
Quantificação das células inflamatórias (HE) .................................................. 33
4.5
Imunoistoquímica .................................................................................................. 33
4.5.1
Preparação das lâminas ................................................................................... 34
4.5.2
Desparafinização e hidratação ......................................................................... 34
4.6
Padronização imunoistoquímica............................................................................. 34
4.6.1
Recuperação antigênica .................................................................................. 34
4.6.2
Bloqueio da peroxidase endógena ................................................................... 35
4.6.3
Bloqueio da ligação em sítio inespecífico........................................................ 35
4.6.4
Anticorpo primário ......................................................................................... 36
4.6.5
Sistemas de visualização imunoistoquímica .................................................... 36
4.7
Revelação .............................................................................................................. 37
4.8
Contra coloração e montagem das lâminas ............................................................. 37
4.9
Avaliação microscópica das reações imunoistoquímicas ........................................ 37
4.10 Análise estatística .................................................................................................. 38
5
RESULTADOS............................................................................................................ 39
5.1
Quantificação das células inflamatórias (HE) ......................................................... 40
5.2
Quantificação das células imuno marcadas (IHQ) .................................................. 43
5.3
Comparação da capacidade de detecção para o receptor de IFN-γ R1 entre os
sistemas de visualização ................................................................................................... 50
6
DISCUSSÃO ............................................................................................................... 53
CONCLUSÃO ..................................................................................................................... 59
REFERÊNCIAS BIBLIOGRÁFICAS.................................................................................. 61
LISTA DE ILUSTRAÇÕES
Figuras
Figura 1 Anatomia do trato genital feminino. O trato genital feminino é formado pelo trato
reprodutivo superior (útero e cérvice) e trato reprodutivo inferior (a vagina). A junção escamo
colunar (JEC) consiste na região onde o epitélio glandular (endocérvice) encontra o epitélio
escamoso estratificado (ectocérvice). Fonte: Iwasaki, 2010 (Adaptado)................................ 20
Figura 2 Infecção pelo HPV. Através de regiões de microtrauma o HPV tem acesso às células
da camada basal. Após a infecção, o HPV interage com o DNA da célula hospedeira para se
multiplicar. Inicialmente há pouca expressão dos genes precoces. À medida que as células
infectadas amadurecem ocorre amplificação do DNA viral (amplificação dos genes tardios),
montagem e a liberação de novas partículas virais. Cornificada: células superficiais; Granular:
células intermediárias; Espinhosa: células parabasais; Basal: células basais; Derme: estroma.
Fonte:Moody e Laimins, 2010 (Adaptado). .......................................................................... 22
Figura 3 Ação das proteínas virais do HPV. A proteína E5 promove a ativação e ação das
proteínas E6 e E7. E6 inibe a apoptose e promove a imortalização celular causando
instabilidade genômica e transformação da célula para um fenótipo maligno. E7 induz a
proliferação celular, o que pode levar a apoptose, porém como E6 inibe a apoptose, a ação de
E7 também leva a imortalização e consequentemente instabilidade genômica e transformação.
Fonte: Moody e Laimins, 2010 (Adaptado). ......................................................................... 23
Figura 4 Sinalização e transcrição induzida por Interferon. IFN-γ (IFN tipo II) leva a
reorganização das subunidades dos receptores IFNGR1 E IFNGR2 ativando JAK1 e JAK2
formando STAT1. Em seguida ocorre à formação do homodímero de STAT1 que ao entrar no
núcleo se liga a GASs. IFN tipo I (IFN-α e IFN-β) após ativar os receptores IFNAR1 e
IFNAR2 ativando TYK2 e JACK1 fosforilando STAT1 e STAT2. Ocorre a homodimerização
de STAT1 e heterodimerização de STAT1 e STAT2. STAT1 e STAT2 associado com IRF9
formam o complexo ISGF3. Ao entrar no núcleo ISGF3 liga-se a ISREs. JAK (Janus Kinase);
STAT (sinais transdutores e ativadores de transcrição); TYK2 (tirosina kinase 2); ISGF3
(fator gênico estimulado por interferon 3); ISRE (elemento de resposta estimulado por IFN).
Fonte: Dunn, Koebel e Schreiber, 2006 (Adaptado). ............................................................ 26
Figura 5 Marcação imunoistoquímica para o receptor CD3 em amostra de linfonodo (controle
positivo (C+) / negativo(C-) ) e em uma amostra de NIC1.................................................... 44
Figura 6 Marcação imunoistoquímica para o receptor CD4 em amostra de linfonodo (controle
positivo (C+) / negativo (C-) ) e em uma amostra de NIC2. .................................................. 45
Figura 7 Marcação imunoistoquímica para o receptor CD8 em amostra de linfonodo (controle
positivo (C+) / negativo (C-) ) e em uma amostra de NIC2. .................................................. 46
Figura 8 Marcação imunoistoquímica para o receptor CD56(NK) em amostra de linfonodo
(controle positivo (C+) / negativo (C-) ) e em uma amostra de NIC2. ................................... 48
Figura 9 Marcação imunoistoquímica para o receptor IFN-γ em amostra de linfonodo
(controle positivo (C+) / negativo (C-) ) e em uma amostra de NIC3. ................................... 49
Figura 10 Ilustração de uma amostra de carcinoma epidermóide invasor (CEI) corada por HE
e sua respectiva marcação imunoistoquímica para o receptor IFN-γ R1. A) coloração de HE
mostrando região do estroma invadida por células de CEI. B) Marcação para receptor IFN-γ
R1 utilizando o SPLB ADVANCE, mostrando forte marcação citoplasmática. C) Intensidade
de marcação fraca ao utilizar o sistema CSA. D) Ausência de marcação ao se utilizar o
sistema LSAB. Setas indicam marcação citoplasmática. Aumento de 400x. ......................... 52
Gráficos
Gráfico 1 Distribuição das células inflamatórias nas diferentes regiões do colo do útero frente
ao diagnóstico histológico. Número de células inflamatórias presente na região subjacente a
Ectocérvice (A), Ectocérvice metaplásica (B), e de lesão (C). NA, Não Analisado; NIC,
neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor. Valores de p >
0,05...................................................................................................................................... 41
Gráfico 2 Distribuição das células inflamatórias das diferentes regiões do epitélio nas
Neoplasias Intraepiteliais cervicasis (NIC) de graus 1, 2 e 3. Número de células inflamatórias
nas amostras diagnosticadas como NIC 1 (A) NIC 2 (B) e NIC 3 (C). NIC, neoplasia
intraepitelial graus 1, 2 e 3. Linhas conectoras indicam diferença significativa (ANOVA
p=0,0141). ........................................................................................................................... 42
Gráfico 3 Número de células CD3+ frente ao diagnóstico histológico. Significância estatística
representada por *. NIC 1 vs NIC 3 (ANOVA p= 0,0198; Tukey q= 3,617); NIC 1 vs CEI
(ANOVA p= 0,0198; Tukey q= 3,880). NEG, negativo; NIC, neoplasia intraepitelial graus 1,
2 e 3; CEI, carcinoma epidermoide invasor. ......................................................................... 43
Gráfico 4 Número de células CD4+ frente ao diagnóstico histológico. (ANOVA p> 0,05).
NEG, negativo; NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide
invasor. ................................................................................................................................ 45
Gráfico 5 Número de células CD8+ frente ao diagnóstico histológico. Significância estatística
representada por *. NIC 1 vs NIC 3 (ANOVA p= 0,0018; Tukey q= 5,490); NIC 1 vs CEI
(ANOVA p= 0,0018; Tukey q= 5,421).NEG, negativo; NIC, neoplasia intraepitelial graus 1, 2
e 3; CEI, carcinoma epidermoide invasor. ............................................................................ 46
Gráfico 6 Número de células CD56+(NK) frente ao diagnóstico histológico. Significância
estatística representada por *. NIC 1 vs CEI (ANOVA p= 0,0116; Tukey q= 4,095);e por
#
NIC 2 vs CEI (ANOVA p= 0,0116; Tukey q= 4,365). NEG, negativo; NIC, neoplasia
intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor. ........................................ 47
Gráfico 7 Número de células IFN-γ+ frente ao diagnóstico histológico. Significância
estatística representada por * e #. NEG vs NIC 3 (ANOVA p=0,0058; Tukey q= 4,320), NEG
vs CEI (ANOVA p= 0,0058; Tukey q= 4,431). NIC 1 vs NIC 3 (ANOVA p= 0,0079; Tukey
q= 4,255); NIC 1 vs CEI (ANOVA p= 0,0079; Tukey q= 4,383). NEG, negativo; NIC,
neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor. ........................ 49
Gráfico 8 Distribuição da positividade para o receptor IFN-γ R1 entre os sistemas de
visualização imunoistoquímica frente aos diferentes diagnósticos histopatológicos. NEG,
negativo; NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor. 51
LISTA DE TABELAS
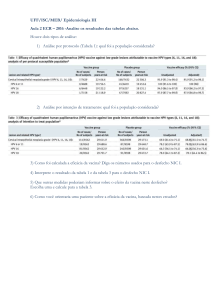
Tabela 1 Expressão do receptor IFN-γ R1 entre os diferentes diagnósticos histopatológicos.
Significância estatística representada por *. Teste exato de Fisher: NEG / NIC 1 / NIC 2 vs
NIC 3 p= 0,0108. NEG, negativo; NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma
epidermoide invasor. ............................................................................................................ 50
Tabela 2 Percentagem de detecção das amostras positivas para o receptor IFN-γ R1 entre os
diferentes sistemas de visualização imunoistoquímica. Significância estatística representada
por * e #. Teste exato de Fisher: SPLB vs LSAB p< 0,0001; CSA vs LSAB p< 0,0001. ...... 50
Tabela 3 Intensidade da marcação para IFN-γ R1 entre o sistema CSA e SPLB. Significância
estatística representada por *. Teste exato de Fisher: POLIMERO vs CSA p< 0,0001. ......... 51
LISTA DE ABREVIATURAS E SIGLAS
APCs - células apresentadoras de antígenos
CD - células dendríticas
CEI- Carcinoma Epidermóide Invasor
CL - células de Langerhans
CSA- CatalyzedSignalAmplification
HE - Hematoxilina-Eosina
HPV - papiloma vírus humano
HSIL- lesão intraepitelial escamosa de alto grau
IFNγ - interferon gama
IFNγ R1 - interferon gama receptor 1
IFNγ Rα - interferon gama receptor alfa
IgA - imunoglobulina A
IgE - imunoglobulina E
IgG - imunoglobulina G
IgM- imunoglobulina M
IHQ- Imunoistoquímica
IL - interleucina
JAK - januskinase
JEC - junção escamo colunar
LB- Lesão Benigna
LCR - longcontrolregion
LSIL - lesão intraepitelial escamosa de baixo grau
LT CD4+ - linfócitos T CD4+
LT CD8+ - linfócitos T CD8+
MHC - complexo peptídeo - complexo maior de histocompatibilidade
NEG - Negativa
NIC1 - neoplasia intra-epitelial cervical grau 1
NIC2 - neoplasia intra-epitelial cervical grau 2
NIC3 - neoplasia intra-epitelial cervical grau 3
OE - orifício externo
PAMPS - padrões moleculares associados a patógenos
PRRs - receptores de reconhecimento de padrões
Rb –retinoblastoma
SA-B- Streptavidina-Biotina
SPLB - Sistemas Poliméricos Livres de Biotina
STAT - sinais transdutores e ativadores de transcrição
TBS - Tris Buffered Saline
TCR - receptores de células T
TNF- Tumor necrosisfactor
Resumo
Objetivo: Quantificar e comparar o número de células inflamatórias totais (linfócitos, neutrófilos,
mastócitos, macrófagos) nas regiões de ectocérvice original, ectocérvice metaplásica (zona de
transformação) e de lesão. Caracterizando a resposta imune local entre lesão benigna (LB), neoplasia
intraepitelial cervical (NIC graus 1, 2 e 3) e carcinoma epidermóide invasor (CEI), pela quantificação
de linfócitos T (CD3+, CD4 +, CD8 +), células natural killer (CD56 +) e a expressão de interferon gama
(IFN-γ). Avaliar a presença de interferon gama receptor 1 (IFN-γ R1), comparando sua positividade
entre o sistema de visualização polimérico livre de biotina (SPLB) e os sistemas baseados em
streptavidina-biotina (SA-B) CSA e LSAB. Metodologia: estudo transversal realizado a partir de
material obtido por biópsia e conização realizadas por cirurgia de alta frequência (CAF) entre 2006 a
2011, onde foram selecionadas 50 amostras, distribuídas em LB (n=10), NIC 1 (n=10), NIC 2 (n=10),
NIC 3 (n=10) e CEI (n=10). A análise do infiltrado inflamatório total foi realizada em lamina corada
por hematoxilina-eosina (HE) e a presença de linfócitos T, células NK, de IFN-γ e IFN-γ R1 foi
realizada pela técnica de imunoistoquímica. A quantificação das células inflamatórias e da citocina foi
feita no estroma subjacente a região da lesão. Os dados foram submetidos ao teste estatístico para
comparação de médias ANOVA, seguido por pós-teste de TUKEY e o teste exato de FISHER foi
utilizado para avaliação dos dados categóricos. Resultados: Não foi encontrado diferença entre o
número de células inflamatórias totais nas diferentes regiões do colo do útero frente ao diagnóstico
histopatológico (p>0,05). Existindo apenas o aumento do número de células na área de lesão NIC 3 em
relação a sua própria região de ectocérvice original (p= 0,0141). Na quantificação das reações de IHQ,
houve maior número de células CD3+, CD8+, CD56+ e IFN-γ em NIC 1 comparado a NIC 3 e CEI (p<
0,05). Não encontramos diferença estatística para a presença de LT CD4+ entre as lesões. O IFN-γ R1
esteve presente em 100% dos casos de LB, NIC 1 e NIC 2, em 40% das amostras de NIC 3 e 70% em
CEI. A positividade para o receptor utilizando os sistemas SPLB e CSA foi superior ao sistema LSAB
(p<0,0001) e a intensidade da marcação demostrada por SPLB foi significativamente maior em relação
sistema CSA (p<0,0001). Conclusão: NIC 1 possui o maior número de linfócitos T, células NK e
IFN-γ, ocorrendo diminuição destes elementos com o agravamento da lesão. A perda do IFN-γ R1 em
casos de NIC 3 e CEI pode justificar a falha em tratamentos com IFN-γ. O SPLB ADVANCE é o
mais indicado para a detecção do receptor IFN-γ R1 em relação aos sistemas SA-B.
Palavras-chave: Colo do Útero, Neoplasia Intraepitelial Cervical, Câncer, Linfócitos T, Citocina,
Imunoistoquímica, Sistema de Detecção Imunoistoquímica.
Abstract
Objective: To quantify and compare the total number of inflammatory cells (lymphocytes,
neutrophils,
mast
cells,
macrophages)
in
the
regions
of
ectocervix
original,ectocervixmetaplasic (transformation zone) and lesion. Featuring local immune
response between benign lesion (LB), cervical intraepithelial neoplasia (CIN grades 1, 2 and
3) and invasive squamous cell carcinoma (SCC), the quantification of T lymphocytes (CD3+,
CD4+, CD8+), natural killer cells (CD56+) and the expression of interferon gamma (IFN-γ).To
evaluate the presence of the interferon gamma receptor 1 (IFN-γ R1), comparing the positivity
of the Biotin-freepolymericvisualization systems (BFPS) and those based on biotinstreptavidin (SA-B) CSA and LSAB.Methodology: A cross sectional study from material
obtained by biopsy and conization performed by high-frequency surgery (HFS) between 2006
to 2011, were selected 50 samples distributed in LB (n=10), NIC 1 (n=10), CIN 2 (n=10),
CIN 3 (n=10) and CIS (n=10). The analysis of the total inflammatory infiltrate was held in
lamina stained by hematoxylin-eosin (HE) and the presence of T lymphocytes, NK cells, IFNγ and IFN-γ R1 was performed by immunohistochemistry. Quantification of inflammatory
cells and the cytokine was made in the underlying stroma region of the lesion. The data were
subjected to statistical test for comparison of ANOVA, followed by Tukey post-test and
Fisher exact test was used to assess categorical data. Results: Not found difference between
the total number of inflammatory cells in different regions of the cervix against the
histopathology diagnosis (p> 0.05). With only the increased number of cells in the lesion area
CIN 3 in terms of their original region of ectocervix (p=0.0141). The quantification of IHC
reactions, a greater number of CD3+, CD8+, NK cells CD56+ and IFN-γ in CIN 1 compared to
CIN 3 and SCC (p<0.05). We found no statistical difference for the presence of CD4+
between the lesions. The IFN-γ R1 was present in 100% of cases of LB, CIN 1 and CIN 2, in
40% of samples of CIN 3 and 70% in SCC. The receptor positivity using SPLB and CSA
systems was higher than the LSAB (p<0.0001) and intensity of the labeling demonstratedby
system SPLB was significantly higher than for CSAsystem (p< 0.0001). Conclusion: NIC 1
has the largest number of T lymphocytes, NK cells and IFN-γ there is a reduction of these
elements with the aggravation of the lesion. The loss of IFN-γ R1 in CIN 3 and SCC can
justify failure to treatment with IFN-γ. The SPLB ADVANCE is the most suitable for the
detection of IFN-γ R1 compared to SA-B systems.
Keywords: Cervical, cervical intraepithelial neoplasia, Cancer, T-Lymphocytes, Cytokine,
Immunohistochemistry, Immunohistochemistry Detection System.
1 INTRODUÇÃO
14
O câncer do colo do útero ainda é a segunda causa de morte por câncer no sexo
feminino em todo o mundo e a primeira em países em desenvolvimento. No Brasil, essa
doença ocupa o segundo lugar, com estimativa de 15.590 novos casos em 2014. Perdendo
apenas para o câncer de mama, tratando-se, portanto, de importante problema de saúde
pública (INCA, 2014).
As lesões do colo do útero se apresentam como uma desorganização do epitélio
escamoso e abrangem alterações não invasivas (NIC 1, NIC 2, NIC 3 e carcinoma in situ) e o
carcinoma epidermóide invasor (CEI).As lesões intraepiteliais escamosas de baixo grau
(LSIL) têm sua origem no epitélio escamoso maduro da cérvice e correspondem a neoplasia
intra-epitelial cervical grau 1 (NIC 1) e alterações associadas ao papiloma vírus humano
(HPV). As lesões intraepiteliais escamosas de alto grau (HSIL) atingem as células com menor
grau de diferenciação. Incluem as displasias moderada e acentuada, as neoplasias intraepiteliais cervicais grau 2 e 3 (NIC 2 e NIC 3) e o carcinoma in situ(INCA, 2014;
MINISTÉRIO DA SAÚDE, 2006; MÜLLER; MAZIERO, 2010).
O CEI desenvolve-se a partir das lesões precursoras NIC 2 e NIC 3. Apresenta, na
maioria dos casos, evolução lenta e sua prevenção consiste em identificar, o mais
precocemente possível, as lesões atípicas no epitélio do colo do útero por meio de exames
como
a
citologia
oncótica
etécnicas
de
histopatologia(SELLORS;
SANKARANARAYANAN, 2003).
ZurHausen em 1974 foi o primeiro a descrever a participação do HPV na oncogênese
cervical, reconhecendo sua capacidade de induzir lesões que podem evoluir de NIC1 ao
carcinoma invasor. Desde a descoberta da relação entre HPV e as lesões cervicais, alguns
grupos de pesquisa têm se dedicado a descrever as taxas em que ocorre a identificação do
DNA do HPV, os tipos mais frequentes e em que grau de lesão são mais comuns(BOSCH et
al., 2008; OLIVEIRA, 2011; ZUR HAUSEN, 2002, 2009).
Há muito se busca compreender os mecanismos envolvidos na transformação maligna
causada pelo HPV e quais as falhas do sistema imunológico na sua identificação e eliminação.
Em relação à resposta imunológica o objetivo tem sido descrever os padrões de resposta
frente à infecção, tipos celulares envolvidos, citocinas e sua quantificação relacionada a cada
tipo de lesão. Acredita-se que nos momentos iniciais do desenvolvimento do carcinoma há
uma polarização da resposta imunológica para o perfil Th1 (imuno-estimulatório), enquanto
nos estágios avançados a atividade inflamatória se desvia para o tipo Th2 (imuno-
15
inibitório)(KEMP et al., 2010; KOBAYASHI et al., 2008; SCOTT et al., 2009; ZHOU;
LEGGATT; FRAZER, 2011).
A definição do perfil inflamatório tem sido realizada através da marcação por
imunoistoquímica seguida da quantificação das células inflamatórias e de seus produtos, no
tecido conjuntivo imediatamente abaixo da lesão e no epitélio em meio à lesão(KOBAYASHI
et al., 2008; MARCOLINO, 2011; ØVESTAD et al., 2010).
Nos trabalhos realizados por imunoistoquímica com objetivo de traçar um perfil
preditor para progressão tumoral, os resultados obtidos têm sido controversos. Devido as
diferentes metodologias empregadas, a presença aumentada de linfócitos tem sido relatada
como indicadora de pior prognóstico, ou como necessária para a regressão das lesões.E em
alguns trabalhos, descrito como não tendo relação com a gravidade da lesão. Da mesma forma
a presença de citocinas pró ou anti-inflamatórias ocorre de maneira não significativa, ou,
como indicadoras de pior ou de melhor prognóstico(ALVES et al., 2010; HELLBERG; TOT;
STENDAHL, 2009; MUNK et al., 2012; ØVESTAD et al., 2010; SILVA et al., 2010).
Ao revisar a literatura, percebe-se que apesar da variedade de tipos celulares e
expressão de citocinas avaliados ou das metodologias empregadas, os trabalhos realizam a
análise de forma isolada, não verificando a relação entre a presença das células inflamatórias e
suas citocinas e se a célula alvo possui os meios necessários para reconhecer e responder aos
estímulos inflamatórios.
Portanto, neste trabalho, optou-se pela quantificação da citocina IFN-γ, por apresentar
importante ação antiviral, e IFN-γ R1(IFN-γ Rα) por ser o receptor constitutivamente
expresso, os linfócitos T CD4 +, T CD8 + e as células natural killer por serem as principais
produtoras desta citocina.
16
2 REVISÃO DA LITERATURA
17
2.1 O Sistema Imune e a Imunovigilância ao Câncer
A imunidade é uma forma especializada de defesa do hospedeiro, seus componentes
formam o sistema imunológico e as respostas geradas podem ser do tipo inata (natural) ou
adquirida (adaptativa)(GORDON MACPHERSON; AUSTYN, 2012).
A especificidade na imunidade inata é direcionada a moléculas características de
patógenos microbianos que não estão presentes nas células de mamíferos. Essas substâncias
são chamadas de Padrões Moleculares Associados a Patógenos (PAMPs) e os receptores
celulares que se ligam a eles são chamados de Receptores de Reconhecimento de Padrões
(PRRs). Seus componentes são barreiras físicas como as superfícies epiteliais e mucosas,
células (macrófagos, neutrófilos, mastócitos, células natural killere células dendríticas),
proteínas do complemento e citocinas(KASTENMÜLLER et al., 2013; WEYD et al., 2013).
A resposta adquirida depois de estimulada possui a capacidade de identificar e
responder com mais intensidade e rapidez a exposições subsequentes ao mesmo antígeno.
Seus componentes são as células denominadas linfócitos T, linfócitos B (que produzem e
liberam os anticorpos IgA, IgM, IgE e IgG) e as células apresentadoras de antígenos (APCs)
(STOPPE; BERNHAGEN; REX, 2013; WEYD et al., 2013).
As APCs compreendem as células de Langerhans (CL), células dendríticas (CD),
macrófagos e linfócitos B, sendo que as mais importantes são as CL e CD. Estas são capazes
de internalizar antígenos exógenos e processá-los para serem apresentados aos linfócitos T
(BOBINET et al., 2012; NATIVIDAD et al., 2013; YOGEV et al., 2012).
O MHC é um receptor expresso na superfície celular das APCs (e de alguns tipos de
célula sobre estresse ou infecção) e é dividido em classe I e classe II. Somente antígenos
expressos corretamente nas moléculas do MHC irão gerar uma resposta imunológica. Os
peptídeos apresentados pelo MHC classe II se originam da proteólise de antígenos
extracelulares, enquanto o MHC classe I apresenta peptídeos derivados da degradação de
proteínas intracelulares. O reconhecimento do MHC é feito pelos receptores de células T
(TCR) associados à co-receptores, dentre eles os receptores CD(BOBINET et al., 2012;
NATIVIDAD et al., 2013; RUDOLPH; STANFIELD; WILSON, 2006; YOGEV et al., 2012).
O receptor CD3 está presente em todos os linfócitos T, já o CD4 é característico dos
linfócitos T auxiliares e o CD8 é encontrado nos linfócitos T citotóxicos (ou citolíticos).
Outras moléculas CD importantessão a CD56 relacionada a células natural killer (NK) e
18
aCD80 ou CD86 presente nas APCs(BLOM; SPITS, 2006; FOURCADE et al., 2013;
RUDOLPH; STANFIELD; WILSON, 2006).
A imunovigilância ao câncer ocorre quando moléculas e células da imunidade inata e
adquirida trabalham juntas para detectar a presença e o desenvolvimento do tumor e destruí-lo
antes que seus efeitos se tornem clinicamente aparentes. Os LT CD4+ e LT CD8+ reconhecem
antígenos específicos do tumor associados às moléculas do MHC classe I e II. Os linfócitos B
liberam anticorpos que reconhecem os antígenos na superfície das células tumorais. Enquanto
as células NK precisam da interação de seus receptores de ativação a moléculas ligantes
expressas no tumor para induzir a lise. Além da proteção através da lise por contato direto, o
sistema imune protege o hospedeiro contra vírus indutores de tumor eliminando ou
suprimindo a infecção viral(BOBINET et al., 2012; CHEN et al., 2012; JUVET et al., 2012;
NATIVIDAD et al., 2013; SMYTH et al., 2012).
Algumas células variantes do tumor podem não ser eliminadas entrando em uma fase
de equilíbrio onde se tornam funcionalmente dormentes e clinicamente inaparentes. Tumor
dormente é o termo utilizado para descrever células tumorais latentes que após décadas
podem ocorrer como uma lesão local ou como metástase. Este estado de dormência é mantido
pelo controle do sistema imune inibindo o crescimento tumoral. Quando há um momento de
imunossupressão no hospedeiro ou quando as células malignas acumulam alterações que
permitem sua evasão ao sistema imune ocorre um novo crescimento tumoral (CHEN et al.,
2012; GARRIDO et al., 2007; GOSS; CHAMBERS, 2010; NATIVIDAD et al., 2013).
As modificações celulares que normalmente conferem às células cancerígenas a
capacidade de evasão ao sistema imune são variadas. Perda das moléculas MHC classe I,
desenvolvimento de insensibilidade ao IFN tipo I e tipo II através da perda do gene que
codifica componentes da sinalização do receptor (IFNAR1, IFNAR2, IFNGR1, IFNGR2,
JAK1, JAK2 e STAT1) são algumas das modificações celulares que levam a uma queda
acentuada da resposta ao tumor(CHEN et al., 2012; GARRIDO et al., 2007; HONG;
LAIMINS, 2013; JUVET et al., 2012; ZUO et al., 2011).
2.2 Colo do útero
O colo do útero é a porção distal do útero e protus na porção superior da vagina.
Possui duas áreas anatomicamente distintas: a ectocérvice e a endocérvice. Esta última
19
compreende a região entre o corpo uterino e o orifício externo (OE) do colo (HICKEY et al.,
2011; SELLORS; SANKARANARAYANAN, 2004) (Figura 1).
A endocérvice normalmente não fica exposta e está revestida por epitélio colunar
(glandular), secretor de muco, que se aprofunda no estroma subjacente, produzindo criptas
denominadas de glândulas endocervicais. A ectocérvice representa a região visível ao exame
especular vaginal. Esta região é coberta por um epitélio escamoso estratificado não
queratinizado, que se reflete a partir dos fórnices vaginais para o colo e se estende
aproximadamente até ao OE. Abaixo desses epitélios encontra-se o estroma, que é formado
por tecido conjuntivo, rico em uma rede capilar para suprimento de oxigênio e nutrientes às
células epiteliais. (HICKEY et al., 2011; SELLORS; SANKARANARAYANAN, 2004)
(Figura 1).
O encontro entre o epitélio escamosoe o epitélio glandular é denominado junção
escamo colunar (JEC) e ocorre de maneira brusca em qualquer local da ecto-endocérvice. A
localização da JEC em relação ao OE é variável durante a vida da mulher e dependente de
fatores como idade, estado hormonal e uso de anticoncepcionais orais(HICKEY et al., 2011;
SELLORS; SANKARANARAYANAN, 2004).
Através de ação hormonal, a JEC move-se em direção à ectocérvice (ectopia)
expondoo epitélio glandular a condições adversas de pH. A exposição das células glandulares
ao meio vaginal ácido estimula a proliferação das células de reserva (hiperplasia de células de
reserva). Com a persistência da exposição a um ambiente irritativo, as células de reserva
sofrem um processo de transformação denominado metaplasia escamosa, no qual estas células
assumem características das células escamosas. A região do colo uterino onde o epitélio
glandular foi substituído pelo epitélio escamoso metaplásico é denominada de zona de
transformação (ectocérvice metaplásica). Essa região representa uma área de intensa
renovação celular que pode ser mais susceptível à transformação neoplásica por fatores
inflamatórios e infecções que um epitélio escamoso original (HICKEY et al., 2011;
SELLORS; SANKARANARAYANAN, 2004).
20
Figura 1 Anatomia do trato genital feminino. O trato genital feminino é formado pelo trato reprodutivo
superior (útero e cérvice) e trato reprodutivo inferior (a vagina). A junção escamo colunar (JEC) consiste na
região onde o epitélio glandular (endocérvice) encontra o epitélio escamoso estratificado (ectocérvice). Fonte:
Iwasaki, 2010 (Adaptado).
2.3 NeoplasiaIntraepitelial Cervical (NIC)
O termo NIC foi inicialmente utilizado em 1968 por Richard e se refere a uma
alteração na diferenciação do epitélio escamoso, que em determinadas condições possui
capacidade para transformação maligna. A classificação de NIC se divide em graus (1, 2 e 3)
e é utilizada para os exames anatomopatológicos. As alterações de NIC 1 tem origem no
epitélio maduro, sem alterações nas células basais. Já as alterações classificadas como NIC 2
possuem alterações celulares displásicascomprometendo até dois terços do epitélio. EmNIC 3
as alterações irão comprometer toda a diferenciação e estratificação do epitélio (MÜLLER;
MAZIERO, 2010; SELLORS; SANKARANARAYANAN, 2004).
O Instituto Nacional do Câncer dos Estados Unidos realizou em 1991 um segundo
simpósio, onde suas recomendações ficaram conhecidas Sistema de Bethesda. O diagnóstico
citológico de Lesão Intraepitelial Escamosa de Baixo Grau (LSIL) passou a abranger ao
diagnóstico histológico de HPV e NIC 1. Enquanto as Lesões Intraepiteliais de Alto Grau
(HSIL) correspondem ao diagnóstico histológico de NIC 2 e NIC 3(MINISTÉRIO DA
21
SAÚDE, 2006; MÜLLER; MAZIERO, 2010; SELLORS; SANKARANARAYANAN,
2004).
2.4 Papilomavirus humano (HPV)
São pequenos vírus de DNA dupla fita circular com 8000 pares de base, envoltos por
um capsídeo, pertencem à família Papillomaviridaee existem mais de 180 tipos.Pelo menos 40
tipos são responsáveis por infecções do trato anogenital(BERNARD; BURK; CHEN, 2010;
DE VILLIERS et al., 2004).
O genoma do HPV pode ser dividido em três partes. Uma parte não codificante
responsável pela regulação e transcrição do HPV chamada LCR (longcontrolregion) e outras
duas regiões codificantes, uma dos genes precoces (E1, E2, E4, E5, E6 e E7) e outra dos
genes tardios (L1 e L2)(BERNARD et al., 2003; DE VILLIERS et al., 2004; ZUR HAUSEN,
2002).
Os genes precoces regulam a fase vegetativa e produtiva do ciclo viral enquanto os
genes tardios codificam as proteínas do capsídeo. Após a infecção, o genoma do HPV se
estabelece como um elemento extracromossômico ou epissomal, não codificando polimerases
ou enzimas necessárias para a replicação viral. Necessitando, portanto, das proteínas de
replicação da célula hospedeira para se manter(BERNARD et al., 2003; DE VILLIERS et al.,
2004; ZUR HAUSEN, 2002).
O ciclo de vida do HPV difere de outras famílias de vírus, pois necessita de células
epiteliais epidérmicas ou da mucosa com capacidade de se proliferar (células basais). Nestas
células a expressão dos genes virais é suprimida, ocorrendo apenas uma baixa expressão de
genes precoces, o que leva a uma proliferação aumentada das células infectadas e sua
expansão lateral. Nas camadas imediatamente acima das células basais a expressão do gene
viral se inicia, o DNA viral é replicado e as proteínas estruturais são formadas. Por último, na
porção superior da epiderme ou da mucosa as partículas virais são montadas e
liberadas(BERNARD et al., 2003; DE VILLIERS et al., 2004; ZUR HAUSEN,
2002)(Figura2).
22
Figura 2Infecção pelo HPV. Através de regiões de microtrauma o HPV tem acesso às células da camada basal.
Após a infecção, o HPV interage com o DNA da célula hospedeira para se multiplicar. Inicialmente há pouca
expressão dos genes precoces. À medida que as células infectadas amadurecem ocorre amplificação do DNA
viral (amplificação dos genes tardios), montagem e a liberação de novas partículas virais. Cornificada: células
superficiais; Granular: células intermediárias; Espinhosa: células parabasais; Basal: células basais; Derme:
estroma. Fonte:Moody e Laimins, 2010 (Adaptado).
|
Os tipos de HPVsque infectam o epitélio e a mucosa que revestem o trato anogenital
foram classificados comode baixo e de alto risco oncogênico. Os tipos HPV-6 e HPV-11 são
os de baixo risco mais comuns, causando verrugas genitais,lesões benignas hiperproliferativas
com limitada capacidade para progressão maligna. Nestas situações as proteínas virais E5, E6
e E7 são produzidas a baixas taxas e mantidas sobre controle ao longo da maturação da célula
hospedeira e da replicação viral. O HPV-16 e HPV-18 são os de alto risco mais prevalentes,
estão relacionados com as displasias de alto grau, que são precursoras do CEI. Nestes tipos de
HPVs os genes E6 e E7 estão super expressos. Dentre os HPVs de alto risco 15 tipos são
encontrados em mais de 99% dos cânceres cervicais (BOSCH et al., 2008; BOULET et al.,
2007; MESPLÈDE et al., 2012; MUÑOZ et al., 2003).
Para o processo de transformação maligna, os genes E5, E6 e E7 e suas proteínas
correspondentes atuam de forma importante. Durante a fase inicial da infecção, E5 estimula o
crescimento celular e inibe o processo de apoptose após lesão do DNA, E6 interage com a
proteína supressora de tumor p53 e E7 com as proteínas da família retinoblastoma (Rb),
bloqueando sua atividade anti-tumorogênica, causando instabilidade cromossômica e
integrando a molécula viral ao DNA da célula hospedeira. Em infecções persistentes ao
interagir na p53, Rb e estimular o crescimento celular as proteínas virais mantém a célula
23
hospedeira no ciclo S de proliferação. Anulando os pontos de verificação, levando ao acúmulo
de mutações no DNA e a progressão maligna(BOSCH et al., 2008; BOULET et al., 2007;
MESPLÈDE et al., 2012)(Figura 3).
Figura 3Ação das proteínas virais do HPV. A proteína E5 promove a ativação e ação das proteínas E6 e E7.
E6 inibe a apoptose e promove a imortalização celular causando instabilidade genômica e transformação da
célula para um fenótipo maligno. E7 induz a proliferação celular, o que pode levar a apoptose, porém como E6
inibe a apoptose, a ação de E7 também leva a imortalização e consequentemente instabilidade genômica e
transformação. Fonte: Moody e Laimins, 2010 (Adaptado).
2.5
Resposta imune contra o HPV
O estado de imunocompetência do hospedeiro desempenha um papel fundamental na
prevenção, duração e resolução das infecções ativas ou subclínicas do HPV. Os mecanismos
de defesa garantem que a maior parte das infecções por HPV de baixo risco se resolva entre 6
a 12 meses e entre 8 a 24 meses as causadas por HPVs de alto risco (BOSCH et al., 2008;
BOULET et al., 2007; MOODY; LAIMINS, 2010).
A presença de uma resposta predominante Th1 parece ser fundamental para a
regressão das lesões de alto grau (NIC2/NIC3), para lesões de baixo grau (NIC1) ou lesão
benigna (como a cervicite crônica inespecífica). Em trabalhos com acompanhamento clínico,
o processo de regressão ocorreu nas pacientes que possuíam um maior número de células próinflamatórias na primeira análise. Ocorrendo também nos casos em que houve ausência ou
baixas quantidades de células e citocinas de perfil antiinflamatório e/ou regulador.Neste
sentido o número aumentado de LT CD3+, LT CD4+ e LT CD8+ bem como citocinas próinflamatórias como IFN-γ tem sido relacionado com um melhor prognóstico(HELLBERG;
24
TOT; STENDAHL, 2009; MONNIER-BENOIT et al., 2006; NEDERGAARD et al., 2008;
ØVESTAD et al., 2010; PIERSMA et al., 2007).
Ainda em relação à predominância de células de perfil pró-inflamatório, existem
trabalhos que não encontraram diferença na presença de tais células ao longo da lesão ou os
descrevem como predominantes e possíveis marcadores da progressão tumoral (ALVES et al.,
2010; MALUF et al., 2008; SILVA et al., 2010; ZIMMERMMANN et al., 2006).
Citocinas promotoras de resposta Th2 foram descritas como marcadoras de pior
prognóstico e presentes em maior quantidade em amostras de CEI intra ou peri-tumoral (DE
VOS VAN STEENWIJK et al., 2010; KOBAYASHI et al., 2008; PIERSMA et al., 2007).
Além dos fenótipos Th1 e Th2, a presença de perfil Treg tem sido descrita como tendo
um importante papel na supressão de Th1, estando mais presente em lesões de maior
gravidade(DE VISSER; EICHTEN; COUSSENS, 2006; KOBAYASHI et al., 2008, 2004;
WILKE et al., 2011).
Em trabalhos com células imortalizadas pelo HPV e tratadas com IFN, demonstraram
que os efeitos antivirais e anti-proliferativos variam em função do tipo de IFN (I ou II) e/ou
do tipo de HPV(CHANG et al., 2002; KANODIA; FAHEY; KAST, 2007). Células tratadas
com IFN tipo I tem uma rápida perda de DNA episomal do HPV (ocorrendo a integração do
DNA do HPV com o DNA da célula hospedeira). Em células imortalizadas por HPV-16 o
IFN-γ inibe a formação de colônias, efeito não observado por IFN-α(OLDAK et al., 2011;
SONG et al., 2008).
Estes dados permitem inferir que apenas o aumento do número de células
inflamatórias ou citocinas do tipo Th1, não é suficiente para garantir a regressão das lesões e a
eliminação do vírus.
2.6 IFN-γ e o Receptor IFN-γ R1
Interferons são fatores solúveis que podem limitar tanto as infecções virais líticas
quanto as não líticas, bem como ativar ou atrair células do sistema imune tais como
neutrófilos, células NK, macrófagos e células dendríticas. Sua classificação em tipo I (IFNα/β) e tipo II (IFN-γ) é baseada em sua sequência e no tipo de receptor utilizado para a
sinalização, IFNAR1 e IFNRA2 para os IFN do tipo I e IFNGR1 e IFNGR2 para o INF do
tipo II (HONG; LAIMINS, 2013; JUVET et al., 2012; LEE et al., 2011; YAN et al., 2013;
ZUO et al., 2011).
25
O IFN-γ apresenta importante papel na modulação de quase todas as respostas imunes,
tais como hematopoiese, diferenciação de células T, atividades antiproliferativas, antitumoral
e antiviral. Promove a diferenciação de células T e B, facilitando a progressão das células
TCD4 + para fenótipo tipo Th1 e a maturação de células TCD8+(JUVET et al., 2012; SONG et
al., 2008; YAN et al., 2013; ZUO et al., 2011).
Um dos mecanismos de ação dos interferons é a ativação da síntese e expressão de
moléculas do MHC classe I, facilitando a apresentação de epitopos virais e aumentando a
capacidade citotóxica dos linfócitos T e das células NK(JUVET et al., 2012; YAN et al.,
2013; ZUO et al., 2011).
O IFN-γ é produzido por células T ativadas e por células NK e induz a expressão de
moléculas MHC classe II na superfície de queratinócitos e monócitos ou macrófagos,
permitindo-os agir como células apresentadoras de antígenos. Consequentemente ativa a
resposta imune antiviral. É produzido durante a infecção viral e se liga a receptores
específicos que desencadeiam eventos intracelulares através das vias Janus Kinase, sinais
transdutores e ativadores de transcrição (STAT)(HONG; LAIMINS, 2013; SARHAN et al.,
2013; WANG et al., 2012; YAN et al., 2013).
Ao se ligar às subunidades IFNGR1 (IFN-γ Rα) e IFNGR2 (IFN-γ Rβ) o IFN-γ ativa
Janus Kinase (JAK) 1 e 2 que estão constitutivamente ligadas a cada subunidade do receptor.
A fosforilação de JAKs forma STAT1 (sinal de transdução e ativação de transcrição 1)
seguindo a formação do homodímero STAT1 (complexo STAT1-STAT1). Este homodímero
entra no núcleo e se liga ao sítio promotor ativado por IFN-γ (GASs). Os interferons do Tipo
1 se ligam às subunidades de seus receptores associados de forma constitutiva a tirosina
kinase (TYK2) e JAK1 respectivamente. A sinalização JAK/STAT induzida por IFN do tipo 1
(α e β) é similar àsinalizaçãode JAK/STAT induzida por IFN-γ (tipo 2). Após a ligação do
IFN tipo 1 em seus receptores (IFNAR1 e IFNRA2) ocorre a ativação de TYK2 e JAC1 que
fosforila STAT1 ou STAT2 seguindo com a homodimerização de STAT1 e STAT2,
ocorrendo associação com fator regulatório de IFN 9 (IRF9). Este processo induz a formação
de um complexo trimérico conhecido como fator gênico estimulado por interferon (ISGF3)
que adentra o núcleo. O ISGF3 liga-se ao elemento de resposta estimulado por IFN (ISREs)
(HONG; LAIMINS, 2013; JUVET et al., 2012; YAN et al., 2013; ZUO et al., 2011) (Figura
4).
26
Figura 4 Sinalização e transcrição induzida por Interferon. IFN-γ (IFN tipo II) leva a reorganização das
subunidades dos receptores IFNGR1 E IFNGR2 ativando JAK1 e JAK2 formando STAT1. Em seguida ocorre à
formação do homodímero de STAT1 que ao entrar no núcleo se liga a GASs. IFN tipo I (IFN-α e IFN-β) após
ativar os receptores IFNAR1 e IFNAR2 ativando TYK2 e JACK1 fosforilando STAT1 e STAT2. Ocorre a
homodimerização de STAT1 e heterodimerização de STAT1 e STAT2. STAT1 e STAT2 associado com IRF9
formam o complexo ISGF3. Ao entrar no núcleo ISGF3 liga-se a ISREs. JAK (Janus Kinase); STAT (sinais
transdutores e ativadores de transcrição); TYK2 (tirosina kinase 2); ISGF3 (fator gênico estimulado por
interferon 3); ISRE (elemento de resposta estimulado por IFN). Fonte: Dunn, Koebel e Schreiber, 2006
(Adaptado).
2.7 Imunoistoquímica(IHQ)
Imunoistoquímica é um método utilizado para a localização de antígenos específicos
em tecidos e células, que se baseia no reconhecimento do antígeno pelo anticorpo. Este
método foi desenvolvido por Coonset. al., em 1940, porém apenas apartir dos anos de 1990
passou a ter aplicações na patologia cirúrgica. Sua utilização se expandiu para a rotina
laboratorial, principalmente para o diagnóstico e classificação de tumores. Além disto, a IHQ
tem sido adaptada para a identificação e demonstração de marcadores preditivos e de
prognóstico(DABBS, 2010; RAMOS-VARA, 2005).
No processo de aperfeiçoamento da IHQ uma série de técnicas e procedimentos tem
sido desenvolvidos, com o intuído de ampliar suas aplicações e a capacidade de identificação
de antígenos.Principalmente os procedimentos para a marcação imunoistoquímica de tecidos
27
fixados em formalina e embebidos em parafina, método amplamente utilizado no diagnóstico
de tumores(DABBS, 2010; RAMOS-VARA, 2005).
O desenvolvimento dos sistemas de visualização tem permitido a detecção de
pequenas quantidades de antígenos e a melhora na qualidade da marcação.Dentre os sistemas
de visualização, existem os baseados na ligação Streptavidina-Biotina (SA-B) e os Sistemas
Poliméricos Livres de Biotina (SPLB). O sistema SA-B apresenta sensibilidade diminuída em
situações de baixa expressão de antígenos, podendo gerar resultados falso negativos. O
Sistema de Amplificação Catalisada ou CSA (CatalyzedSignalAmplification)utiliza-se do
mesmo princípio utilizado no sistema SA-B.Porém, com a utilização da tiramina ligada à
biotina, o que torna a reação até cinquenta vezes mais sensível que o método convencional de
SA-B.Uma grande desvantagem das metodologias baseadas no sistema SA-B é a ligação
inespecífica à biotina endógena que está em grandes quantidades em alguns tipos de tecido,
levando a resultado falso positivo(DABBS, 2010; ROCHA et al., 2009; SHI; GUO; COTE,
1999).
A demanda por maior sensibilidade, reprodutibilidade e simplificação das etapas em
IHQ é crescente. Os procedimentos de múltiplas etapas utilizados pelos métodos SA-B
consomem muito tempo e dificultam o processo de padronização. Os SPLB, principalmente
os de segunda geração, têm alcançado altos níveis de desempenho, sendo consideravelmente
mais sensíveis que o sistema CSA.Além disso, o fato de não possuir ligação inespecífica com
a biotina endógena e normalmente ser um procedimento em duas etapas, possibilita a
utilização do SPLB como metodologia padrão para diagnóstico de tumores(DABBS, 2010;
ROCHA et al., 2009; SHI; GUO; COTE, 1999).
28
3 OBJETIVOS
29
3.1 Objetivo geral
Comparar a resposta imunológica no estroma cervical de mulheres com lesão benigna,
neoplasia intraepitelial cervical e carcinoma epidermóide invasor.
3.2 Objetivos específicos
Quantificar o número de células inflamatóriastotais nas regiões de ectocérvice
original, ectocérvice metaplásica (zona de transformação)e de lesão, nas amostras de colo
uterino.
Comparar a resposta imune entre lesão benigna, neoplasia intraepitelial cervical e
carcinoma epidermóide invasor, pela quantificação de linfócitos T (CD3+, CD4 +, CD8 +),
células natural killer (CD56 +) e a expressão de IFN-γ.
Comparar a presença do receptor IFN-γ R1 entre lesão benigna, neoplasia intraepitelial
cervical e carcinoma epidermóide invasor.
Comparar o sistema de visualização polimérico livre de biotina com os sistemas
baseados em streptavidina-biotina para a avaliação do receptorIFN-γ R1, nos casos de lesão
benigna, neoplasia intraepitelial cervical e carcinoma epidermóide invasor.
30
4 METODOLOGIA
31
4.1 Desenho do estudo
Trata-se de um estudo comparativo, retrospectivo, realizado a partir de material obtido
por biópsia e conização do colo do útero apresentando lesão benigna, neoplasia intra-epitelial
cervical (grau 1, 2 e 3) e carcinoma escamoso invasor.
Este estudo tem como variável dependente o grau da lesão e como variáveis
independentes a presença ou ausência dos marcadores celulares: CD3, CD4, CD8, NK
(CD56), e marcadores para a citocina IFN-γ e seu receptor IFN-γ R1.
4.2 Amostragem
O material utilizado neste trabalho foi selecionado a partir de 150 amostras utilizadas
na dissertação de mestrado defendida em julho de 2012 por Bruna Caroline Vieira Pitol, no
programa de Pós-graduação em Ciências Farmacêuticas da Universidade Federal de Ouro
Preto.
As amostras de biópsias e conização cervicais fixadas em formol e incluídas em
parafina, realizadasno período de 2006 a 2011, foram obtidas dos arquivos do Laboratório
Tafuri localizado em Belo Horizonte, Minas Gerais (MG). .
Fundado
em
1959,
o
Laboratório
Tafuri
realiza
exames
citológicos
e
anatomopatológicos particulares e de diversos convênios, incluindo o SUS. Este laboratório
foi escolhido por ser o local para o qual são encaminhadas as biópsias de mulheres residentes
em Ouro Preto, onde temos realizado diversos trabalhos avaliando a prevalência de HPV e
alterações citológicas da cérvice uterina.
O trabalho realizado anteriormente foi aprovado pelo Comitê de Ética em Pesquisa
(CEP) da Universidade Federal de Ouro Preto (UFOP), CEP No 114/2010, tendo este trabalho
aprovação no comitê de ética, através da inclusão de marcadores inflamatórios protocolado no
oficio CEP N° 015/2013, de 1 de fevereiro de 2013.
32
4.3 Critérios de inclusão, exclusão e organização das amostras
As 150 amostras já haviam sido divididas em 5 grupos (Lesão benigna, NIC 1, 2 e 3,
CEI) com 30 amostras cada. Destas, foram selecionadas 10 amostras de cada grupo,
totalizando 50 amostras.
As amostras selecionadas foram as que ainda possuíam representação da região de
lesão e cujo material fosse suficiente para a realização das análises histopatológicas e
imunoistoquímicas. Das amostras que se adequaram a estas condições, algumas possuíam
mais de um bloco parafinado e, nestes casos, foram escolhidos os blocos já utilizados por
Pitol (2012). As amostras que não atenderam a estes critérios foram excluídas.
Para a adequação a terminologia encontrada nos artigos internacionais e melhor
construção dos gráficos, optamos por substituir o termo lesão benigna (LB), utilizado na
nomenclatura brasileira para laudos histopatológico do colo do útero, para Negativo (Neg).
4.4
Histologia
4.4.1 Preparo das laminas para coloração em Hematoxilina-Eosina - HE
Para a coloração em HE, foi obtido um corte de cada bloco com espessura de 4µm. As
lâminas foram desparafinizadas, coradas e montadas em corador e montador automático
(LeicaAutostainer). Seguindo o procedimento de 10 minutos em hematoxilina e lavadas em
água corrente durante 5 minutos para retirada do excesso do corante. Em seguida foram
banhadas em eosina por 30 segundos. Lavadas em água por 1 minuto e desidratadas em dois
banhos em álcool absoluto e um banho em xilol por 1 minuto.Após este procedimento as
lâminas foram montadas com Entellan e lamínulas.
4.4.2 Análise das laminas coradas em HE
As lâminas foram analisadas por microscopia convencional em campo claro, ocular de
10 x e objetiva de 5, 10 e 40 x visando à correta identificação das áreas a serem fotografadas.
As imagens foram capturadas por uma microcâmera digital Leica DFC340FX acoplada ao
33
microscópio DM5000B,no setor de Microscopia do laboratório multiusuários do NUPEB,
UFOP.
4.4.3 Quantificação das células inflamatórias (HE)
Para análise quantitativa das células inflamatórias totais (linfócitos, neutrófilos,
mastócitos, macrófagos) as amostras foram divididas em três regiões: ectocérvice original,
ectocérvice metaplásica (zona de transformação)e região da lesão. De cada região foram
fotografados 10 campos correspondendo a uma área de 0,7704 mm2.
Para a análise da região da lesão todas as amostras foram incluídas. As amostras
diagnosticadas como CEI não possuíam as regiões de ectocérvice e ectocérvice metaplásica,
não sendo incluídas na análise destes parâmetros. Os casos negativos também não possuíam
representação da região de ectocérvice original. Já a região da ectocérvice metaplásica
corresponde à região em que o diagnóstico foi definido.
As imagens foram obtidas no tecido conjuntivo (estroma) logo abaixo da região da
lesão. No caso do carcinoma epidermóide invasor, foram fotografadas e analisadas as regiões
do conjuntivo ao redor da área de invasão. O programa ImageJ, disponível gratuitamente na
internet (macbiophotonics.ca), foi utilizado para a contagem das células inflamatórias. Os
resultados foram obtidos através de análise quantitativa e expressos em Nocélulas/0,7704
mm2.
4.5 Imunoistoquímica
O processo de padronização se baseou em metodologias já defendidas em dissertações
de mestrado e artigos internacionais que tiveram o mesmo objeto de estudo. Sendo adaptadas
para a realidade de nosso laboratório e em virtude das características das amostras
(GUIMARÃES, 2011; KOBAYASHI et al., 2008; LUCENA, 2011; MALUF, 2007;
MONNIER-BENOIT et al., 2006).
As amostras foram processadas através da técnica de imunoistoquímica, utilizando
anticorpos monoclonais. Os sistemas de visualização testados foramo ImmunoCruz™ Mouse
LSAB Staining System SC-2050, DAKO K1500 CSA (CatalyzedSignalAmplification
System) e DAKO K4068 ADVANCE HRP.Os passos realizados neste procedimento são
descritos a seguir.
34
4.5.1 Preparação das lâminas
A silanização das lâminas foi realizada utilizando solução silano 2% em acetona (2 mL
de silano em98 mL de acetona). As lâminas foram mergulhadas em acetona por 1 minuto.
Colocadas na solução de silano por 10 segundos e em seguida, submetidas a dois banhos de 2
segundos em água destilada. As lâminas foram secas em estufa.
Os cortes histológicos foram realizados no micrótomo rotativo modelo MRP 09 –
LUPETEC com espessura de 4µm sendo distendidos nas lâminas previamente silanizadas.
4.5.2 Desparafinização e hidratação
As lâminas contendo os cortes histológicos foram colocadas em estufa overnigtht na
temperatura de 60°C. Seguiram-se três banhos em xilol por 5 minutos e o processo de
hidratação foi realizado em banhos com concentrações decrescentes de álcool: duas vezes em
álcool absoluto por 5 minutos e uma imersão de 5 minutos nas concentrações de 90%, 80%,
70%, 50%, seguidas por banho de 5 minutos em água destilada e 5 minutos em TBS(Tris-HCl
0,05M, NaCl 0,15M, pH 7,4)
4.6 Padronização imunoistoquímica
4.6.1 Recuperação antigênica
Após o processo de desparafinização e hidratação, os cortes foram submetidos aos
seguintes protocolos de recuperação antigênica:
Imersão em tampão citrato10mM, pH=6,0 pré-aquecido por 1 minuto em micro-ondas
a potencia de 100% seguido por aquecimento a potencia de 90%por 3 vezes de 5
minutos atingindo a temperatura de 98°C.
Imersão em tampão Tris-EDTA, pH=8,0 pré-aquecido por 1 minuto em micro-ondas a
potencia de 100% seguido por aquecimento a potencia de 90%por 3 vezes de 5
minutos atingindo a temperatura de 98°C.
35
Imersão em tampão Tris-EDTA, pH=8,0 pré-aquecido por 1 minuto em micro-ondas a
potencia de 100% seguido por aquecimento a potencia de 70%por 3 vezes de 5
minutos atingindo a temperatura de 92°C.
Imersão em tampão citrato10mM, pH=6,0 e submetido a aquecimento em panela a
vapor por 30 minutos.
O primeiro método apresentou melhor resultado.
Utilizamos para o processo de reativação antigênica o micro-ondas Electrolux MEF28
18L 700W 110/220V.
4.6.2 Bloqueio da peroxidase endógena
O bloqueio é necessário para evitar interferência da peroxidase tecidual na coloração
imunoistoquímica e foi definido por solução 3% de peróxido de hidrogênio em água destilada.
Os cortes histológicos foram incubados nessa solução durante 15 minutos. Em seguida, foram
realizadas 3 lavagens (5 minutos cada) com solução de TBS.
Anteriormente foi testada a incubação das lâminas em 3% de peróxido de hidrogênio em
água destilada por 5 e 20 minutos e também 3% de peróxido de hidrogênio em metanol por 5,
15 e 30 minutos.
4.6.3 Bloqueio da ligação em sítio inespecífico
Foi definido com solução de leite em pó (MOLICO®, Nestlé) a 10% em TBS, durante
30 minutos. Em seguida, foram realizadas 3 lavagens (5 minutos cada) em TBS.
Assim como no bloqueio da peroxidase endógena, foram realizados testes anteriores
com incubações nos tempos de 10 e 15 minutos, seguidos de 3 banhos de 5 minutos em TBS.
36
4.6.4
Anticorpo primário
Os anticorpos utilizados foram:
Anticorpo anti-CD3 (Mouse Monoclonal Antibody), Santa Cruz Biotechnology, clone
PC3/188A, 200µg IgG1 em 1 mL de PBS. Código do produto (SC-20047).
Anticorpo anti-CD4 (Mouse Monoclonal Antibody), Santa Cruz Biotechnology, clone
MT310, 200µg IgG1 em 1 mL de PBS. Código do produto (SC-19641).
Anticorpo anti-CD8 (Mouse Monoclonal Antibody), Santa Cruz Biotechnology, clone
5F10, 100µg IgG1 em 1 mL de PBS. Código do produto (SC-70794).
Anticorpo anti-CD56 (NCAM) (Mouse Monoclonal Antibody), Santa Cruz
Biotechnology, clone 123C3, 200µg IgG1 em 1 mL de PBS. Código do produto (SC7326).
Anticorpo anti-IFN-γ (Mouse Monoclonal Antibody), Santa Cruz Biotechnology,
clone LLO6Z, 100µg IgG2b em 1 mL de PBS. Código do produto (SC-74108).
Anticorpo anti-IFN-γ R1 (Mouse Monoclonal Antibody), Santa Cruz Biotechnology,
clone D3, 200µg IgG1 em 1 mL de PBS. Código do produto (SC-28363).
Os anticorpos foram diluídos em solução BSA 0,1% em TBS e testados utilizando
amostras de tonsila e de linfonodo como controle positivo. A escolha da concentração de
anticorpos utilizada foi definida por testes realizados em amostras de colo do útero. Sendo que
para CD3 a concentração final utilizada foi de 0,004µg/µl, CD4: 0,01µg/µl, CD8: 0,01µg/µl,
CD56: 0,013µg/µl, IFN-γ: 0,005µg/µl e IFN-γ R1: 0,013µg/µl.
4.6.5 Sistemas de visualização imunoistoquímica
Após a incubação com o anticorpo primário, foram realizadas 3 lavagens em solução de
TBS (5 minutos cada) e as lâminas com os cortes foram incubadas com anticorpo secundário.
O SPLB DAKO K4068 ADVANCE™ HRP foi o utilizado para todos os marcadores.
Primeiro as amostras foram incubadas com o ADVANCE™ HRP Link durante 30 minutos a
37°C. Após a incubação, foram realizadas 3 lavagens em solução de TBS (5 minutos cada).
37
Seguidapor incubação com o ADVANCE™ HRP Enzyme por 30 minutos a
37°C.Novamente, foram realizadas 3 lavagens em solução de TBS (5 minutos cada), seguindo
para a etapa de revelação.
Já os sistemas baseados em streptavidina-biotinaImmunoCruz™ Mouse LSAB Staining
System SC-2050 e DAKO K1500 CSA™ foram utilizados somente para o marcador do
receptor IFN-γR1 seguindo os procedimentos indicados nos respectivos kits.
4.7 Revelação
Finalizada a reação com o anticorpo secundário, os cortes foram novamente lavados
com TBS (3 vezes, 5 minutos cada) e incubados com o substrato cromógeno
diaminobenzedina (DAB). O tempo de incubação do substrato foi padronizado em 5 minutos.
A indicação da presença das proteínas é representada por precipitado de coloração marrom no
sítio do antígeno.
4.8 Contra coloração e montagem das lâminas
Após a revelação, os cortes foram lavados durante 5 minutos em água corrente. Em
seguida, as lâminas foram imersas durante 5 segundos em Hematoxilina de Mayer (DAKO) e
lavadas novamente com água corrente durante 1 minuto. Finalmente, as lâminas foram
desidratadas em álcool 96% durante 1 minuto, colocadas para secar a temperatura ambiente e
montadas com lamínula e Entellan.
4.9 Avaliação microscópica das reações imunoistoquímicas
Conforme descrito anteriormente, as laminas foram analisadas por microscopia
convencional em campo claro, ocular de 10 x e objetiva 40 x. As imagens foram capturadas
por uma microcâmera digital Leica DFC340FX acoplada ao microscópio DM5000B, no setor
de Microscopia do laboratório multiusuários do NUPEB, UFOP.
38
A região da lesão foi marcada e fotografada correspondendo com a região de lesão
identificada nas laminas coradas por HE.
Para a avaliação quantitativa das reações de IHQ (CD3, CD4, CD8, CD56 e IFN-γ),
foram fotografados e analisados 10 campos (área de 0,7704 mm2) do estroma subjacente à
região da lesão. Os resultados para o marcador de IFN-γ R1 foram expressos em casos
positivos/negativos.
Para a comparação da intensidade damarcação para IFN-γ R1 entre os sistemas de
visualização, utilizamos a análise semi-quantitativa(por escore) proposta por Coleman e
Stanley (1994) e utilizada por(ALVES et al., 2010; LUCENA, 2011; ROCHA et al., 2009). A
intensidade da marcação citoplasmática foi classificada como ausente (0), fraca (1), moderada
(2) e forte (3).Para fins de estatística os escores 0 e 1, foram agrupados como marcação fraca
e os escores 2 e 3, como marcação forte.
4.10 Análise estatística
Os resultadosobtidos pela quantificação de células inflamatórias totais e por
quantificação dasreações de IHQ foramsubmetidos ao testeestatístico ANOVApara
comparação das médias ± desvio padrão, seguido por pós-teste de TUKEY, sendo os
resultados considerados significativamente estatísticos com p<0,05.
Os dados expressos em percentagem para positividade do receptor IFN-γ R1 e da
comparação entre os sistemas de visualização foram submetidos ao teste exato de Fisher.
Considerando os resultados significativamente estatísticos com p<0,05.
39
5 RESULTADOS
40
5.1 Quantificação das células inflamatórias (HE)
A avaliação histopatológica das amostras foi realizada através da análise quantitativa
das secções coradas por HE. A primeira etapa consistiu em comparar o número de células
inflamatórias nas regiões subjacentes a ectocérvice original, ectocérvice metaplásica e de
lesãoentre o diagnóstico histológico. Na segunda etapa foi comparado o número de células
inflamatórias das três regiões em cada grupo de lesão.
Na quantificação das células inflamatórias não houve diferença estatística entre os
grupos nas diferentes regiões da cérvice uterina. O número de células inflamatórias na região
da ectocérvice original se mantém muito próximo entre os diferentes tipos de lesão (Gráfico
1A). Na região da ectocérvice metaplásica(Gráfico 1B) o número de células inflamatórias
dobra em relação à região de ectocérvice original. Este número aumentado de células
provavelmente ocorre em resposta aos processos irritativos que induzem a metaplasia
escamosa. Em NIC 1 há uma tendência a um número maior de células, porém a variação no
grupo é maior que nas outras lesões. A variação encontrada em NIC 1 pode estar relacionada
com a preservação das camadas epiteliais, na amostra com maior número de células
(1850/0,7704 mm2 ) havia o menor número de camadas epiteliais. Já nas duas amostras com
maior quantidade de camadas epiteliais, foram encontradas as menores quantidades de células
inflamatórias (94 e 96/0,7704 mm2). Já na região da lesão (Gráfico 1C), em NIC 3 observa-se
um número médio de células inflamatórias maior que nos outros grupos, mas esta diferença
não é significativa. O número aumentado de células inflamatórias em NIC 3 incluindo uma
amostra que possuía 1883células/0,7704 mm2acompanha os casos em que ocorre
comprometimento glandular concomitante. A variação entre as médias de NIC 1, NIC 2 e CEI
é muito semelhante.
41
Gráfico 1Distribuição das células inflamatórias nas diferentes regiões do colo do útero frente ao
diagnóstico histológico. Número de células inflamatórias presente na região subjacente a Ectocérvice (A),
Ectocérvice metaplásica (B), e de lesão (C). NA, Não Analisado; NIC, neoplasia intraepitelial graus 1, 2 e 3;
CEI, carcinoma epidermoide invasor. Valores de p > 0,05.
Estroma subjascente à
Ectocérvice original
A
2000
1500
1000
500
NA
NA
0
NEG
No células / 0,7704 mm 2
B
NIC 1
NIC 2
NIC 3
CEI
Estroma subjacente à
Ectocérvice metaplásica
2000
1500
1000
500
NA
NA
0
NEG
C
NIC 1
NIC 2
NIC 3
CEI
Estroma subjacente à Lesão
2000
1500
1000
500
0
NEG
NIC 1
NIC 2
NIC 3
CEI
Diagnóstico histológico
Ao analisar as regiões de cada amostra diagnosticada como NIC (Gráfico 2) é possível
perceber o aumento de células inflamatórias em direção à região da lesão. Apesar de ser
estatisticamente significativo (p=0,0141) apenas quando se compara a região da lesão de NIC
3 com sua própria região da ectocérvice (Gráfico 2C), este resultado pode ilustrar a
capacidade do sistema imune em aumentar sua participação com um maior número de células
no agravamento da lesão.
42
Gráfico 2 Distribuição das células inflamatórias das diferentes regiões do epitélio nas Neoplasias
Intraepiteliaiscervicasis (NIC) de graus 1, 2 e 3. Número de células inflamatórias nas amostras diagnosticadas
como NIC 1 (A) NIC 2 (B) e NIC 3 (C).NIC, neoplasia intraepitelial graus 1, 2 e 3.Linhas conectoras indicam
diferença significativa (ANOVA p=0,0141).
Diagnóstico histológico
NIC 1
A
2000
1500
1000
500
0
Original
No células / 0,7704 mm 2
B
Metaplásico
Lesão
Diagnóstico histológico
NIC 2
2000
1500
1000
500
0
Original
C
Metaplásico
Lesão
Diagnóstico histológico
NIC 3
2000
1500
1000
500
0
Original
Metaplásico
Região do epitélio
Lesão
43
5.2 Quantificação das células imuno marcadas (IHQ)
Entre os imunomarcadores analisados, o marcador para CD3 (Gráfico 3) foi o que
apresentou maior número de células positivas. Dentre os grupos, NIC 1 (LSIL) apresentou
maior média, sendo diferente estatisticamente de NIC 3 (HSIL) (ANOVA p= 0,0198; Tukey
q= 3,617) e de CEI (ANOVA p= 0,0198; Tukey q= 3,880). Na figura 5, está representado o
resultado da marcação imunoistoquímica para o receptor CD3 em amostra de linfonodo
(utilizado como controle positivo/negativo) e uma amostra de NIC1.
Gráfico 3 Número de células CD3+frente ao diagnóstico histológico. Significância estatística representada por
*. NIC 1vs NIC 3 (ANOVA p= 0,0198; Tukey q= 3,617); NIC 1 vs CEI (ANOVA p= 0,0198; Tukey q= 3,880).
NEG, negativo; NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor.
CD3
500
No células / 0,7704 mm2
*
400
300
200
*
*
NIC3
CEI
100
0
NEG
NIC1
NIC2
44
Figura 5 Marcação imunoistoquímica para o receptor CD3 em amostra de linfonodo (controle positivo
(C+) / negativo(C-) ) e em uma amostra de NIC1.
Em relação aos LT CD4+(Gráfico 4) não houve diferença estatística entre os grupos.
Apesar disto, ao analisar os valores de cada amostra, é possível perceber que nos casos de
NIC 3 e CEI o número de células se concentra abaixo da média encontrada nos outros grupos.
A variação que ocorre nas amostras dos grupos NEG, NIC 1 e NIC 2, descreve uma divisão
(intragrupo) entre as amostras que apresentam baixa quantidade (baixa expressão) ou alta
quantidade (alta expressão). Na figura 6, está representado o resultado da marcação
imunoistoquímica para o receptor CD4 em amostra de linfonodo (utilizado como controle
positivo/negativo) e uma amostra de NIC2.
45
Gráfico 4 Número de células CD4+ frente ao diagnóstico histológico. (ANOVA p> 0,05).NEG, negativo;
NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor.
CD4
No células / 0,7704 mm2
250
200
150
100
50
0
NEG
NIC1
NIC2
NIC3
CEI
Figura 6 Marcação imunoistoquímica para o receptor CD4 em amostra de linfonodo (controle positivo
(C+) / negativo (C-) ) e em uma amostra de NIC2.
A média de LT CD8+ (Gráfico 5) foi maior no grupo NIC 1, sendo estatisticamente
diferente de NIC 3 (ANOVA p= 0,0018; Tukey q= 5,490) e de CEI (ANOVA p= 0,0018;
Tukey q= 5,421). Em NIC 2exceto por três casos que se aproximaram da média e/ou ápice de
NIC 1, a maior parte das amostras segue o perfil apresentado porNIC 3 e CEI.
46
Gráfico 5Número de células CD8+ frente ao diagnóstico histológico. Significância estatística representada por
*. NIC 1vs NIC 3 (ANOVA p= 0,0018; Tukey q= 5,490); NIC 1 vs CEI (ANOVA p= 0,0018; Tukey q=
5,421).NEG, negativo; NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor.
CD8
100
No células / 0,7704 mm2
*
80
60
40
20
*
*
NIC3
CEI
0
NEG
NIC1
NIC2
Na figura 7, está representado o resultado da marcação imunoistoquímica para o
receptor CD8 em amostra de linfonodo (utilizado como controle positivo/negativo) e uma
amostra de NIC2.
Figura 7 Marcação imunoistoquímica para o receptor CD8 em amostra de linfonodo (controle positivo
(C+) / negativo (C-) ) e em uma amostra de NIC2.
47
A presença de células CD56+ (Gráfico 6) foi similar entre as NICs, ocorrendo diferença
estatística entre NIC 1 e CEI (ANOVA p= 0,0116; Tukey q= 4,095) e entre NIC 2 e CEI
(ANOVA p= 0,0116; Tukey q= 4,365).
Gráfico 6Número de células CD56+(NK) frente ao diagnóstico histológico. Significância estatística
representada por *. NIC 1vsCEI (ANOVA p= 0,0116; Tukey q= 4,095);e por # NIC 2vs CEI (ANOVA p=
0,0116; Tukey q= 4,365). NEG, negativo; NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma
epidermoide invasor.
NK
No células / 0,7704 mm2
100
#
80
*
60
#
40
*
20
0
NEG
NIC1
NIC2
NIC3
CEI
Na figura 8, está representado o resultado da marcação imunoistoquímica para o
receptor CD56 (NK) em amostra de linfonodo (utilizado como controle positivo/negativo) e
uma amostra de NIC2.
48
Figura 8 Marcação imunoistoquímica para o receptor CD56(NK) em amostra de linfonodo (controle
positivo (C+) / negativo (C-) ) e em uma amostra de NIC2.
A quantidade de células imunomarcadas para IFN-γ foi maior nos casos NEG e de NIC
1, os casos de NIC 3 e CEI apresentaram os valores mais baixos. O grupo NIC 2 apresenta um
perfil intermediário entre estes dois padrões. Houve significância estatística entre o grupo
NEG e NIC 3(ANOVA p=0,0058; Tukey q= 4,320) e NEG vs CEI (ANOVA p= 0,0058;
Tukey q= 4,431). Diferenças também foram encontradas ao comparar NIC 1vs NIC 3
(ANOVA p= 0,0079; Tukey q= 4,255) e NIC 1 vs CEI (ANOVA p= 0,0079; Tukey q= 4,383)
(Gráfico 7). Na figura 9, está representado o resultado da marcação imunoistoquímica para o
receptor CD4 em amostra de linfonodo (utilizado como controle positivo/negativo) e uma
amostra de NIC3.
49
Gráfico 7Número de células IFN-γ+ frente ao diagnóstico histológico. Significância estatística representada
por * e #. NEG vs NIC 3 (ANOVA p=0,0058; Tukey q= 4,320), NEG vs CEI (ANOVA p= 0,0058; Tukey q=
4,431). NIC 1vs NIC 3 (ANOVA p= 0,0079; Tukey q= 4,255); NIC 1 vs CEI (ANOVA p= 0,0079; Tukey q=
4,383). NEG, negativo; NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor.
IFN-γ
100
No células / 0,7704 mm2
*
80
#
60
40
20
#
#
*
*
NIC3
CEI
0
NEG
NIC1
NIC2
Figura 9 Marcação imunoistoquímica para o receptor IFN-γ em amostra de linfonodo (controle positivo
(C+) / negativo (C-) ) e em uma amostra de NIC3.
A presença do receptor IFN-γ R1 foi igual para os grupos NEG, NIC 1 e NIC 2, sendo
positivo em 100% dos casos. Diferente de NIC 3 (Fisher, p= 0,0108), cuja presença ocorreu
em apenas 40% dos casos. Já nos casos de CEI, 70% das amostras possuíam o receptor. A
50
presença do receptor em NIC 3 e CEI não ocorre em toda a extensão da lesão, apresentando
alguns grupos de células negativas e regiões com intensidade de marcação distintas. O que
difere do perfil de marcação visualizado em NEG,NIC 1 e NIC 2, onde a positividade se
estende por toda a região do epitélio e com a mesma intensidade. (Tabela 1).
Tabela 1Expressão do receptor IFN-γ R1 entre os diferentes diagnósticos histopatológicos. Significância
estatística representada por *. Teste exato de Fisher: NEG / NIC 1 / NIC 2vsNIC 3 p= 0,0108.NEG, negativo;
NIC, neoplasia intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor.
IFN-γ R1
POSITIVO
NEGATIVO
N
%
N
%
NEG*
10
100
0
0
NIC 1*
10
100
0
0
NIC 2*
10
100
0
0
NIC 3
4
40
6
60
CEI
7
70
3
30
5.3 Comparação da capacidade de detecção para o receptor de
IFN-γ R1 entre os sistemas de visualização
O SPLB ADVANCE™ foi capaz de identificar 100% das amostras como positiva,
diferente do sistema LSAB que identificou apenas 12,5% dos casos (87,5% amostras falso
negativo) (Fisher p<0,0001). O sistema CSA detectou 87,5% dos casos positivos (12,5%
casos falso negativo), sendo estatisticamente diferente de LSAB (Fisher p<0,0001). Não
houve diferença estatística entre SPLB e CSA (Fisher p=0,2340) (Tabela 2).
Tabela 2 Percentagem de detecção das amostras positivas para o receptor IFN-γ R1 entre os diferentes
sistemas de visualização imunoistoquímica. Significância estatística representada por * e #. Teste exato de
Fisher:SPLBvs LSAB p< 0,0001; CSA vs LSAB p< 0,0001.
IFN-γ R1
POSITIVO
NEGATIVO
N**
%
N
%
24
100
0
0
CSA
21
87,5
3
12,5
LSAB
3
12,5
21
87,5
SPLB*
#
** NEG (n= 5); NIC 1(n= 5); NIC 2 (n= 5); NIC 3(n= 4) e CEI (n= 5).
51
No gráfico 8 destaca-se a distribuição da positividade encontrada em cada sistema de
visualização em relação ao diagnóstico histológico. As 3 amostras positivas pelo sistema
LSAB se distribuíram entre NEG (1 caso) e NIC 1 (2 casos). Já para CSA os casos dados
como negativose distribuíram entre NEG (1 caso), NIC 1 (1 caso) e NIC 3 (1 caso).
Gráfico 8 Distribuição da positividade para o receptor IFN-γ R1 entre os sistemas de visualização
imunoistoquímica frente aos diferentes diagnósticos histopatológicos. NEG, negativo; NIC, neoplasia
intraepitelial graus 1, 2 e 3; CEI, carcinoma epidermoide invasor.
Positividade para IFN-γ R1
5
SPLB
CSA
LSAB
No amostras
4
3
2
1
0
NEG
NIC 1
NIC 2
NIC 3
CEI
Diagnóstico histológico
Dos casos identificados como positivo pelo SPLB, 84% possuía a intensidade de
marcação forte para o IFN-γ R1 e 16% marcação fraca. Já no sistema CSA, a marcação forte
foi em apenas 8% dos casos, predominando uma marcação fraca em 92%. Sendo o SPLB
estatisticamente diferente de CSA (Fisher p<0,0001). Os casos em que o sistema LSAB foi
capaz de identificar como positivos, a intensidade da marcação foi fraca.
Tabela 3Intensidade da marcação para IFN-γ R1 entre o sistema CSA e SPLB. Significância estatística
representada por *. Teste exato de Fisher:POLIMERO vs CSA p< 0,0001.
Marcação para IFN-γ R1
FORTE
FRACA
N
%
N
%
SPLB *
20
84
4
16
CSA
2
8
22
92
LSAB
-
-
3
100
52
Na figura 10, está representada a coloração por HE (a) de uma amostra de CEI (região
do estroma) e a respectiva intensidade de marcação imunoistoquímica para IFN-γ R1 entre os
sistemas de visualização. O SPLB ADVANCE (b) com forte marcação citoplasmática, o CSA
(c) tendo fraca marcação e LSAB (d) a marcação está ausente (falso negativo).
Figura 10Ilustração de uma amostra de carcinoma epidermóide invasor (CEI) corada por HE e sua
respectiva marcação imunoistoquímica para o receptor IFN-γ R1. A) coloração de HE mostrando região do
estroma invadida por células de CEI. B) Marcação para receptor IFN-γ R1 utilizando o SPLB ADVANCE,
mostrando forte marcação citoplasmática. C) Intensidade de marcação fraca ao utilizar o sistema CSA. D)
Ausência de marcação ao se utilizar o sistema LSAB. Setas indicam marcação citoplasmática. Aumento de 400x.
53
6 DISCUSSÃO
54
Em trabalhos como o de Kobayashi et al. (2008), Øvestadet al.(2010) ou Munket al.
(2012), a presença de células imuno marcadas tem sido descrita de forma quantitativa, porém,
não há consenso entre o número de campos (2-10) ou área a ser avaliada (0,500mm2-1,0mm2).
Outra forma de descrição do processo inflamatório é por meio semi-quantitativo, por
escore, onde o número de células imuno marcadas é avaliado e classificado em ausente (0),
fraco (1), moderado (2) e intenso (3). Neste modelo, os autores também tem agrupado o
diagnóstico histopatológico NIC 2 e NIC 3, em um único grupo NIC2/NIC3 (ALVES et al.,
2010; GUIMARÃES, 2011; LUCENA, 2011).
As diferenças entre estes dois métodos tem resultado em avaliações contraditórias da
participação celular inflamatória no processo de carcinogênese cervical.
Em nosso trabalho optamos por analisar a presença das células inflamatórias de forma
quantitativa, em número de campos (10) e descrever a área total analisada (0,7704mm2).
Entre as lesões, NIC 1 obteve a maior concentração dos marcadores celulares
estudados. NIC 3 e CEI tiveram comportamento semelhante entre si, possuindo os menores
índices de células imuno marcadas. E NIC 2 se mostrou como um intermediário entre a lesão
de baixo grau e os diagnósticos mais graves.
No presente estudo, o número de células CD3+, CD8+ e CD56+ em NIC 1 foi
significantemente maior em relação a NIC 3 e CEI, sugerindo que a presença destas células
pode levar a uma proteção contra o agravamento da lesão. Esta inferência é similar ao descrito
por Monnier-Benoit et al. (2006), Nedergaardet al.(2007) e Woo et al.(2008). Nestes
trabalhos foi demonstrado que além do predomínio destas células em NIC 1, houve regressão
da lesão nas amostras com maior número de células.
Nos trabalhos realizados por Maluf et al. (2008), Alves et al. (2010) e Silva et
al.(2010) o maior número de células foi encontrado nas lesões de alto grau. E sendo assim,
consideraram este fator como um preditor de maior risco para a progressão e/ou recorrência
da lesão. Estes trabalhos seguiram a metodologia de escores e agrupamento dos diagnósticos
NIC 2/NIC 3. O agrupamento das lesões NIC 2 e NIC 3 pode levar
a resultados
interpretativos errôneos. Visto que NIC 2 difere de NIC 3 em aspectos que influenciam ou até
mesmo determinam o comportamento do sistema imune (BOSCH et al., 2008; ØVESTAD et
al., 2010; VAN HAMONT et al., 2008).
O marcador para CD4 não apresentou diferença entre as lesões em nosso trabalho. A
média de células em NIC 1 ficou muito próxima das médias de NEG e NIC 2. Algumas
amostras em NIC 1 tiveram valores muito superiores a média do grupo. No trabalho de
Monnier-Benoit et al. (2006), ocorreu progressão da lesão nas amostras que possuíam um
55
baixo número de células CD4+ e baixos valores para a razão CD4/CD8 em NIC 1. Partindo
deste princípio, é possível que em nossas amostras de NIC 1, que possuíam valores de CD4
equivalentes as amostras dos grupos NIC 3 e CEI, teriam mais chances de progredirem para
uma lesão de alto grau.
A presença de LT CD8+ foi significantemente maior em NIC 1 comparado a NIC 3 e
CEI. Já a marcação para as células CD56+ (NK) apresentou média semelhante entre as NICs,
e no caso de CEI, ocorreram os menores valores.
A participação de LT CD8+ e células NK, tem papel fundamental não só na regressão
ou progressão das NICs, mas também no prognóstico das pacientes com CEI. Além de sua
presença em quantidade, estas células precisam estar ativadas e seu perfil de ativação deve ser
adequado ao estágio da lesão. Nos casos de lesão de baixo grau, a ação de LT CD8+ e células
NK com atividade citotóxica foi considerada como fator preditivo para a regressão da NIC
1(WOO et al., 2008). Nedergaardet al. (2007) as correlacionou com diminuição da taxa de
recidiva de CEI e Piersmaet al. (2012) demostrou que o infiltrado intratumoral de LT CD8+
esta associado com ausência de metástase em linfonodo.
Quando as células CD4+, CD8+ e NK estão voltadas para uma ação pró-inflamatória e
citotóxica, também contribuem para a regressão espontânea de NIC 2 e NIC 3. Øvestadet al.
(2010) e Munket al. (2012) relataram uma taxa de regressão das lesões de 18% e 21%
respectivamente. Nestes dois trabalhos, os autores descreveram a presença destas células no
estroma e intra-epitélio como fator preditor de regressão. Já nos casos em que houve
persistência da lesão, foi encontrado o predomínio destas células com perfil regulatório. Além
do predomínio do perfil regulador nos casos de persistência da lesão, quantidades diminuídas
de IFN-γ foi correlacionado com pior prognóstico(VISSER et al., 2007).
A expressão de IFN-γ em nosso estudo teve valores próximos entre os grupos NEG e
NIC 1, ambos, diferentes estatisticamente de NIC 3 e CEI. Cujos valores foram muito
próximo de zero. Mais uma vez, o grupo NIC 2 se apresentou como intermediário entre os
grupos. Mas neste caso, apresentando sua própria variação intra grupo, com valores idênticos
a NIC 3 e CEI e com amostras próximas das de NEG e NIC 1. Visseret al. (2007), Kobayashi
et al. (2008) e Scott et al. (2009), correlacionaram os valores diminuídos de IFN-γ as lesões
NIC 2 e NIC 3 e também ao CEI. Outro achado destes estudos foi o aumento das citocinas
imuno reguladoras contribuindo para o desenvolvimento de lesões de alto grau.
Ao identificar a predominância do perfil pró-inflamatório como preditor de bom
prognóstico e necessário para o processo de regressão da lesão, existe a sugestão de que
tratamentos com IFNs possam ser uma alternativa para a promoção desta condição. Porém, os
56
dados na literatura sobre a eficácia deste tipo de abordagem é inconsistente, não permitindo a
definição de uma conduta para tratamento(BERNARD, 2004; JOHNSON; GANGEMI, 2003;
YANG et al., 2009).
O tipo de HPV poderia ser o responsável pela variação da eficácia do tratamento com
IFNs. Estudos In Vitro demonstram que o efeito dos IFNs variam em relação ao tipo de HPV
(CHANG et al., 2002; OLDAK et al., 2011). Porém, os trabalhos em que houve
acompanhamento das NICs, onde analisaram a regressão espontânea, não houve diferença nos
tipos de HPV entre as amostras que sofreram regressão ou progressão da lesão(MONNIERBENOIT et al., 2006; SCOTT et al., 2009; VISSER et al., 2007).Há relatos na literatura sobre
a ação do HPV interferindo e inibindo a expressão dos receptores e das vias de transdução de
sinal de IFN-α e β, porém não encontramos trabalhos que descrevessem tais efeitos sobre o
IFN-γ.
Ao analisar a presença do receptor IFN-γ R1 encontramos prevalência de 100% de
positividade para os grupos NEG, NIC 1 e NIC 2, de 40% para NIC 3 e de 70% para CEI. As
amostras de NIC 3 e CEI que foram positivas para o receptor, não apresentaram o mesmo
padrão de marcação dos outros grupos. Em NEG, NIC 1 e NIC 2, a marcação se estendeu ao
longo do epitélio e com maior intensidade na região das lesões. Nos casos de NIC 3 e CEI
houve marcação irregular, não se estendendo por toda a lesão, mostrando grupamentos de
células negativas entre as positivas. A intensidade da marcação também variou ao longo da
lesão.
A perda do receptor de IFN-γ foi descrita em casos de câncer de mama, câncer de
ovário e em leucemias, sendo correlacionado com falha no tratamento e como preditor de pior
prognóstico(DUNCAN et al., 2007; GARCÍA-TUÑÓN et al., 2007; NETEA et al., 2008).
Não encontramos trabalhos em que fosse realizado analise da presença dos receptores
de IFN-γ nas lesões cervicais. Somente trabalhos que avaliaram a presença dos receptores de
IFN-α e do MHC classe 1. Ambos descreveram uma redução destes receptores nos casos das
NICs e CEI (JORDANOVA et al., 2008; TIRONE et al., 2009).
A ausência do receptor IFN-γ R1 em amostras de NIC 3 e CEI e a distribuição
irregular nos casos positivos destas lesões, pode justificar a falha no tratamento com IFN-γ.
Além disso, torna válido considerar a análise dos receptores de IFN-γ e de seus sinais de
transdução, como possíveis marcadores de prognóstico.
A técnica de imunoistoquímica é um método já consagrado para o estudo de
receptores, tanto em pesquisa quanto para diagnóstico clínico. Os resultados obtidos no estudo
de tumores através da técnica de IHQ têm consequências sobre a terapêutica. Exemplo disso é
57
a definição do tipo celular em linfomas e a presença de receptores de estrógeno e progesterona
no câncer de mama (DABBS, 2010; NETEA et al., 2008; ROCHA et al., 2009).
Para garantir confiabilidade dos resultados em IHQ é preciso manter um rigoroso
controle de qualidade e conhecer as limitações dos sistemas utilizados. A avaliação e
comparação da capacidade dos sistemas de visualização imunoistoquímica vêm sendo
estudada há anos, principalmente quando um novo método é desenvolvido. Nos últimos anos
os SPLB e a possibilidade de marcações múltiplas têm sido o objeto de estudo de várias
publicações (CHAN; MATIAS; FARAH, 2011; NITTA et al., 2012; ROCHA et al., 2009;
SKALAND et al., 2010).
Em nosso trabalho, durante o processo de padronização, encontramos consideráveis
diferenças entre os sistemas de visualização IHQ. Sendo assim, decidimos avaliar se a
variação entre os kits poderia interferir no resultado final da marcação. Escolhemos o
marcador para IFN-γ R1 para avaliação entre os kits, por considera-lo como possível
marcador de prognóstico nas lesões do colo do útero.
Ao avaliar as amostras positivas, os sistemas ADVANCE e CSA apresentaram
detecção do receptor em quantidade muito superior ao LSAB. O número de casos reafirmados
como positivo pelo SPLB ADVANCE foi de 100%. O sistema CSA foi capaz de marcar 87%
das amostras, o que representou3 casos falso negativos. Já o uso do sistema LSABresultou em
21 (87,5%) casos de falso negativo. Pela distribuição dos casos positivos e/ou negativos
encontrados entre os sistemas frente ao diagnóstico histopatológico,não encontramos
nenhuma característica nas amostras que pudesse justificar o resultado falso negativos do kit
CSA ou positivos pelo LSAB. Ao considerar a intensidade da marcação, o sistema
ADVANCE se mantem superior ao CSA. Os casos onde ocorreu forte marcação para o
receptor chegaram a 84% pelo SPLB e em apenas 8% utilizando o sistema CSA.
A baixa positividade do sistema LSAB em relação aos sistemas SPLB e CSA já é
definida na literatura(ROCHA et al., 2009; SABATTINI; BISGAARD; ASCANI, 1998). Os
resultados dos trabalhos comparativos entre os Polímeros de segunda geração e os sistemas
CSA reafirmam a superioridade dos SPLB(CHAN; MATIAS; FARAH, 2011; NITTA et al.,
2012; SKALAND et al., 2010).
O índice de positividade de CSA em nosso trabalho não foi diferente estatisticamente
do sistema ADVANCE, porém a intensidade da marcação é extremamente importante para a
avaliação do resultado. Análises de receptores como nos casos de câncer de mama, como
demonstrado por Rocha et al. (2009) dependem não só da positividade, mas também da
intensidade para a definição de escores cujo resultado reflete na escolha do tratamento.
58
Dentre os sistemas atualmente disponíveis,os SPLB são os que oferecem melhores
resultados. Para a pesquisa de possíveis marcadores de prognóstico por meio da técnica de
IHQ este sistema representa uma importante ferramenta.
Em nossa revisão, não conseguimos encontrar trabalhos em que a avaliação do perfil
celular, da expressão de citocinas ou mesmo de seus respectivos receptores fosse quantificada
no mesmo estudo. Os trabalhos encontrados foram estudos transversais retrospectivos e/ou
estudos longitudinais, onde a descrição destes parâmetros foi feita de forma isolada.
A análise destes trabalhos nos leva a considerar que mais importante do que a presença
de células inflamatórias em números, é o papel desempenhado por elas. Que para o processo
de regressão e consequentemente resolução da lesão é necessário que exista uma ativação
celular pró-inflamatória, quantidades suficientes de IFN-γ para proporcionar os efeitos
antivirais e antitumorais necessários. E que, por fim, as células infectadas e transformadas
pelo HPV, possuam os mecanismos de percepção e transdução de sinal para IFN-γ intactos e
funcionais.
59
CONCLUSÃO
60
Não há diferença no número de células inflamatórias totais entre as diferentes regiões
do colo do útero em relação ao diagnóstico histopatológico de NIC 1, NIC 2 e NIC3 .
NIC 1 possui o maior número de LT CD3+, CD8+, células NK e da citocina IFN-γ.
Observa-se menor quantidade destes elementos em lesões mais graves.
Observa-se ausência da marcação para IFN-γ R1 em amostras de NIC 3 e CEI mas não
em NEG, NIC 1 e NIC 2. E os casos positivos em NIC 3 e CEI apresentam marcação irregular
em intensidade e distribuição, incluindo regiões de lesão negativas para o receptor. O que
poderia justificar a falha em tratamentos com IFN-γ.
O SPLB ADVANCE e o sistema CSA são mais sensíveis para identificação do IFN-γ
R1 em amostras cervicais, comparados com o sistema LSAB. Além disso, o SPLB
ADVANCE é mais sensível ao sistema CSA em relação à intensidade da marcação.
61
REFERÊNCIAS BIBLIOGRÁFICAS
62
ALVES, D. B. et al. Linfócitos CD4 , CD8 e células NK no estroma da cérvice uterina de
mulheres infectadas pelo papilomavírus humano. Revista da Sociedade Brasileira de
Medicina Tropical, v. 43, n. 4, p. 425–429, 2010.
BERNARD, B. et al. Human papillomaviruses type 16+ and 18+ cervical carcinoma cells are
sensitive to staurosporine-mediated apoptosis. Biology of the cell / under the auspices of the
European Cell Biology Organization, v. 95, n. 1, p. 17–26, 2003.
BERNARD, H.; BURK, R.; CHEN, Z. Classification of papillomaviruses (PVs) based on 189
PV types and proposal of taxonomic amendments. Virology, v. 401, n. 1, p. 70–79, 2010.
BERNARD, H.-U. Established and potential strategies against papillomavirus infections. The
Journal of antimicrobial chemotherapy, v. 53, n. 2, p. 137–9, fev. 2004.
BLOM, B.; SPITS, H. Development of human lymphoid cells. Annual review of
immunology, v. 24, p. 287–320, jan. 2006.
BOBINET, M. et al. MELOE-1 antigen contains multiple HLA class II T cell epitopes
recognized by Th1 CD4+ T cells from melanoma patients. PloS one, v. 7, n. 12, p. e51716,
jan. 2012.
BOSCH, F. X. et al. Epidemiology and natural history of human papillomavirus infections
and type-specific implications in cervical neoplasia. Vaccine, v. 26 Suppl 1, p. K1–16, 19
ago. 2008.
BOULET, G. et al. Human papillomavirus: E6 and E7 oncogenes. The international journal
of biochemistry & cell biology, v. 39, n. 11, p. 2006–11, jan. 2007.
CHAN, A.; MATIAS, M.; FARAH, C. A Novel and Practical Method Using HRP-polymer
Conjugate and Microwave Treatment for Visualization of 2 Antigens Raised From the Same
or Different Species in Paraffin-embedded Tissues. Applied Immunohistochemistry & …,
v. 19, n. 4, p. 376–383, 2011.
CHANG, Y. E. et al. Long-Term Effect of Interferon on Keratinocytes That Maintain Human
Papillomavirus Type 31. JOURNAL OF VIROLOGY, v. 76, n. 17, p. 8864–8874, 2002.
CHEN, H.-M. et al. Shikonin induces immunogenic cell death in tumor cells and enhances
dendritic cell-based cancer vaccine. Cancer immunology, immunotherapy : CII, v. 61, n.
11, p. 1989–2002, nov. 2012.
DABBS, D. J. Diagnostic immunohistochemistry: theranostic and genomic applications.
3rd ed ed. [s.l.] SAUNDER/ELSEVIER, 2010. p. 941
DE VILLIERS, E.-M. et al. Classification of papillomaviruses. Virology, v. 324, n. 1, p. 17–
27, 20 jun. 2004.
DE VISSER, K. E.; EICHTEN, A.; COUSSENS, L. M. Paradoxical roles of the immune
system during cancer development. Nature reviews. Cancer, v. 6, n. 1, p. 24–37, jan. 2006.
63
DE VOS VAN STEENWIJK, P. J. et al. An unexpectedly large polyclonal repertoire of HPVspecific T cells is poised for action in patients with cervical cancer. Cancer research, v. 70,
n. 7, p. 2707–17, 1 abr. 2010.
DUNCAN, T. J. et al. Loss of IFN gamma receptor is an independent prognostic factor in
ovarian cancer. Clinical cancer research : an official journal of the American Association
for Cancer Research, v. 13, n. 14, p. 4139–45, 15 jul. 2007.
FOURCADE, J. et al. CD8+ T cells specific for tumor antigens can be rendered dysfunctional
by the tumor microenvironment through upregulation of the inhibitory receptors BTLA and
PD-1. Cancer research, v. 72, n. 4, p. 887–896, 2013.
GARCÍA-TUÑÓN, I. et al. Influence of IFN-gamma and its receptors in human breast cancer.
BMC cancer, v. 7, p. 158, jan. 2007.
GARRIDO, G. et al. T cells are crucial for the anti-metastatic effect of anti-epidermal growth
factor receptor antibodies. Cancer immunology, immunotherapy : CII, v. 56, n. 11, p.
1701–10, nov. 2007.
GORDON MACPHERSON; AUSTYN, J. The Immune System. In: WILEY-VCH VERLAG
GMBH & CO (Ed.). Exploring Immunology: Concepts and Evidence. First Edit ed. [s.l:
s.n.].
GOSS, P. E.; CHAMBERS, A. F. Does tumour dormancy offer a therapeutic target? Nature
reviews. Cancer, v. 10, n. 12, p. 871–7, dez. 2010.
GUIMARÃES, M. V. M. B. Expressão de citocinas no estroma cervical de mulheres
infectadas e não infectadas pelo vírus da imunodeficiencia humana (HIV) com neoplasia
intraepitelial cervical (NIC). [s.l.] Faculdade de Medicina da Universidade Federal de Minas
Gerais, 2011.
HELLBERG, D.; TOT, T.; STENDAHL, U. Pitfalls in immunohistochemical validation of
tumor marker expression--exemplified in invasive cancer of the uterine cervix. Gynecologic
oncology, v. 112, n. 1, p. 235–40, jan. 2009.
HICKEY, D. et al. Innate and adaptive immunity at Mucosal Surfaces of the Female
Reproductive Tract: Stratification and Integration of Immune Protection against the
Transmission of Sexually Transmitted Infections. J Reprod Immunol, v. 88, n. 2, p. 185–
194, 2011.
HONG, S.; LAIMINS, L. A. The JAK-STAT Transcriptional Regulator, STAT-5, Activates
the ATM DNA Damage Pathway to Induce HPV 31 Genome Amplification upon Epithelial
Differentiation. PLoS pathogens, v. 9, n. 4, p. e1003295, abr. 2013.
INCA. Estimativa 2012 : incidência de câncer no Brasil. Rio de Janeiro, RJ: Instituto
Nacional de Câncer José Alencar Gomes da Silva, Coordenação Geral de Ações Estratégicas,
Coordenação de Prevenção e Vigilância., 2012. p. 118
64
INCA. Estimativa 2014: Incidência de Câncer no Brasil. Rio de Janeiro, RJ: Instituto
Nacional de Câncer José Alencar Gomes da Silva, Coordenação Geral de Ações Estratégicas,
Coordenação de Prevenção e Vigilância., 2014. p. 124
JOHNSON, J.; GANGEMI, J. Alpha interferon augments cidofovir’s antiviral and
antiproliferative activities. Antimicrobial agents and …, v. 47, n. 6, p. 2022–2026, 2003.
JORDANOVA, E. S. et al. Human leukocyte antigen class I, MHC class I chain-related
molecule A, and CD8+/regulatory T-cell ratio: which variable determines survival of cervical
cancer patients? Clinical cancer research : an official journal of the American Association
for Cancer Research, v. 14, n. 7, p. 2028–35, 1 abr. 2008.
JUVET, S. C. et al. Autocrine IFNγ controls the regulatory function of lymphoproliferative
double negative T cells. PloS one, v. 7, n. 10, p. e47732, jan. 2012.
KANODIA, S.; FAHEY, L. M.; KAST, W. M. Mechanisms used by human papillomaviruses
to escape the host immune response. Current cancer drug targets, v. 7, n. 1, p. 79–89, mar.
2007.
KASTENMÜLLER, W. et al. Peripheral Prepositioning and Local CXCL9 ChemokineMediated Guidance Orchestrate Rapid Memory CD8(+) T Cell Responses in the Lymph
Node. Immunity, 24 jan. 2013.
KEMP, T. J. et al. Elevated systemic levels of inflammatory cytokines in older women with
persistent cervical human papillomavirus infection. Cancer epidemiology, biomarkers &
prevention, v. 19, n. 8, p. 1954–9, ago. 2010.
KOBAYASHI, A et al. Evolving immunosuppressive microenvironment during human
cervical carcinogenesis. Mucosal immunology, v. 1, n. 5, p. 412–20, set. 2008.
KOBAYASHI, A. et al. Functional attributes of mucosal immunity in cervical intraepithelial
neoplasia and effects of HIV infection. Cancer research, v. 64, n. 18, p. 6766–74, 15 set.
2004.
LEE, S. et al. Activation of the interleukin-32 pro-inflammatory pathway in response to
human papillomavirus infection and over-expression of interleukin-32 controls the expression
of the human papillomavirus oncogene. Immunology, v. 132, n. 3, p. 410–20, mar. 2011.
LUCENA, A. A. D. S. Avaliação da contagem de linfócitos T, linfócitos B e células
natural killer no estroma cervical de pacientes soropositivas e soronegativas para o HIV
e com neoplasia intraepitelial cervical. [s.l.] Faculdade de Medicina da Universidade
Federal de Minas Gerais, 2011.
MALUF, P. J. ESTUDO DA RESPOSTA IMUNE E DO TIPO DE PAPILOMAVÍRUS
HUMANO NA EVOLUÇÃO DE PACIENTES CONIZADAS POR NEOPLASIA
INTRA-EPITELIAL CERVICAL GRAU III. [s.l.] Universidade Federal do Triângulo
Mineiro, Uberaba, MG, 2007.
65
MALUF, P. J. et al. T lymphocytes (CD3) may participate in the recurrence of cervical
intraepithelial neoplasia grade III. Archives of gynecology and obstetrics, v. 278, n. 6, p.
525–30, dez. 2008.
MARCOLINO, L. D. Perfil de citocinas no soro e na secreção cervical de mulheres com
lesão intraepitelial de baixo grau, lesão intraepitelial de alto grau e carcinoma
epidermóide invasor.[s.l.] UNESP. Faculdade de Medicina de Botucatu, 2011.
MESPLÈDE, T. et al. p53 degradation activity, expression, and subcellular localization of E6
proteins from 29 human papillomavirus genotypes. Journal of virology, v. 86, n. 1, p. 94–
107, jan. 2012.
MINISTÉRIO DA SAÚDE. Nomenclatura brasileira para laudos cervicais e condutas
preconizadas: recomendações para profi ssionais de saúde. 2. ed. Rio de Janeiro, RJ:
Secretaria de Atenção à Saúde. Instituto Nacional de Câncer. Coordenação de Prevenção e
Vigilância., 2006. p. 56
MONNIER-BENOIT, S. et al. Immunohistochemical analysis of CD4+ and CD8+ T-cell
subsets in high risk human papillomavirus-associated pre-malignant and malignant lesions of
the uterine cervix. Gynecologic oncology, v. 102, n. 1, p. 22–31, jul. 2006.
MOODY, C. A; LAIMINS, L. A. Human papillomavirus oncoproteins: pathways to
transformation. Nature reviews. Cancer, v. 10, n. 8, p. 550–60, ago. 2010.
MÜLLER, G. C.; MAZIERO, C. Alterações citológicas : uma revisão sobre a importância da
Citologia Oncótica. Unoesc & Ciência, v. 1, n. 2, p. 87–94, 2010.
MUNK, A. C. et al. Interaction of epithelial biomarkers, local immune response and condom
use in cervical intraepithelial neoplasia 2-3 regression. Gynecologic oncology, v. 127, n. 3, p.
489–94, dez. 2012.
MUÑOZ, N. et al. Epidemiologic classification of human papillomavirus types associated
with cervical cancer. The New England journal of medicine, v. 348, n. 6, p. 518–27, 6 fev.
2003.
NATIVIDAD, K. D. T. et al. Interleukin-27 Signaling Promotes Immunity against
Endogenously Arising Murine Tumors. PloS one, v. 8, n. 3, p. e57469, jan. 2013.
NEDERGAARD, B. S. et al. A comparative study of the cellular immune response in patients
with stage IB cervical squamous cell carcinoma. Low numbers of several immune cell
subtypes are strongly associated with relapse of disease within 5 years. Gynecologic
oncology, v. 108, n. 1, p. 106–11, jan. 2008.
NETEA, M. G. et al. Defective interferon-gamma production in patients with hairy cell
leukaemia. The Netherlands journal of medicine, v. 66, n. 8, p. 340–34, set. 2008.
NITTA, H. et al. A gene-protein assay for human epidermal growth factor receptor 2 (HER2):
brightfield tricolor visualization of HER2 protein, the HER2 gene, and chromosome 17
centromere (CEN17) in formalin-fixed, paraffin-embedded breast cancer tissue sections.
Diagnostic pathology, v. 7, p. 60, jan. 2012.
66
OLDAK, M. et al. Differential regulation of human papillomavirus type 8 by interferon
regulatory factors 3 and 7. Journal of virology, v. 85, n. 1, p. 178–88, jan. 2011.
OLIVEIRA, C. M. DE. Existe câncer cervical HPV negativo ? [s.l.] Faculdade de Medicina
da Universidade de São Paulo, 2011.
ØVESTAD, I. T. et al. Local immune response in the microenvironment of CIN2-3 with and
without spontaneous regression. Modern pathology : an official journal of the United
States and Canadian Academy of Pathology, Inc, v. 23, n. 9, p. 1231–40, set. 2010.
PIERSMA, S. J. et al. High number of intraepithelial CD8+ tumor-infiltrating lymphocytes is
associated with the absence of lymph node metastases in patients with large early-stage
cervical cancer. Cancer research, v. 67, n. 1, p. 354–61, 1 jan. 2007.
RAMOS-VARA, J. A. Technical aspects of immunohistochemistry. Veterinary pathology,
v. 42, n. 4, p. 405–26, jul. 2005.
ROCHA, R. M. et al. Biotin-free systems provide stronger immunohistochemical signal in
oestrogen receptor evaluation of breast cancer. Journal of clinical pathology, v. 62, n. 8, p.
699–704, ago. 2009.
RUDOLPH, M. G.; STANFIELD, R. L.; WILSON, I. A. How TCRs bind MHCs, peptides,
and coreceptors. Annual review of immunology, v. 24, p. 419–66, jan. 2006.
SABATTINI, E.; BISGAARD, K.; ASCANI, S. system: a new immunohistochemical method
for diagnostics and research. Critical comparison with the APAAP, ChemMate, CSA, LABC,
and SABC techniques. Journal of clinical …, v. 51, p. 506–511, 1998.
SARHAN, D. et al. Activated monocytes augment TRAIL-mediated cytotoxicity by human
NK cells through release of IFN-γ. European journal of immunology, v. 43, n. 1, p. 249–57,
jan. 2013.
SCOTT, M. E. et al. Diminished IFN-γ and IL-10 and elevated Foxp3 mRNA expression in
the cervix are associated with CIN 2 or 3. International journal of cancer, v. 124, n. 6, p.
1379–1383, 2009.
SELLORS, J.; SANKARANARAYANAN, R. Colposcopy and treatment of cervical
intraepithelial neoplasia: a beginner’s manual. [s.l: s.n.].
SELLORS, J. W.; SANKARANARAYANAN, R. Colposcopia e tratamento da neoplasia
intra-epitelial cervical: Manual para principiantes. [s.l: s.n.]. p. 120
SHI, S.; GUO, J.; COTE, R. Sensitivity and detection efficiency of a novel two-step detection
system (PowerVision) for immunohistochemistry. Applied Immunohistochemistry &
Molecular Morphology, v. Volume 7, n. 3, p. p 201, 1999.
SILVA, C. S. DA et al. Local lymphocytes and nitric oxide synthase in the uterine cervical
stroma of patients with grade III cervical intraepithelial neoplasia. Clinics (São Paulo,
Brazil), v. 65, n. 6, p. 575–81, jun. 2010.
67
SKALAND, I. et al. Evaluation of 5 different labeled polymer immunohistochemical
detection systems. Applied immunohistochemistry & molecular morphology : AIMM /
official publication of the Society for Applied Immunohistochemistry, v. 18, n. 1, p. 90–6,
jan. 2010.
SMYTH, K. et al. Repetitive peptide boosting progressively enhances functional memory
CTLs. Biochemical and Biophysical Research Communications, v. 424, n. 3, p. 635–640,
2012.
SONG, S.-H. et al. Interferon-gamma (IFN-gamma): a possible prognostic marker for
clearance of high-risk human papillomavirus (HPV). Gynecologic oncology, v. 108, n. 3, p.
543–8, mar. 2008.
STOPPE, C.; BERNHAGEN, J.; REX, S. Macrophage Migration Inhibitory Factor in Critical
Illness : Dr . Jekyll and Mr . Hyde ? Annual Update in Intensive Care and Emergency
Medicine, p. 153–164, 2013.
TIRONE, N. R. et al. Local expression of interferon-alpha and interferon receptors in cervical
intraepithelial neoplasia. Cancer immunology, immunotherapy : CII, v. 58, n. 12, p. 2003–
10, dez. 2009.
VAN HAMONT, D. et al. Biological behavior of CIN lesions is predictable by multiple
parameter logistic regression models. Carcinogenesis, v. 29, n. 4, p. 840–5, abr. 2008.
VISSER, J. et al. Frequencies and role of regulatory T cells in patients with (pre)malignant
cervical neoplasia. Clinical and experimental immunology, v. 150, n. 2, p. 199–209, nov.
2007.
WANG, R. et al. Natural killer cell-produced IFN-γ and TNF-α induce target cell cytolysis
through up-regulation of ICAM-1. Journal of Leukocyte Biology, v. 91, n. 2, p. 299–309,
fev. 2012.
WEYD, H. et al. Annexin A1 on the surface of early apoptotic cells suppresses CD8(+) T cell
immunity. PloS One, v. 8, n. 4, p. e62449, jan. 2013.
WILKE, C. M. et al. Dual biological effects of the cytokines interleukin-10 and interferon-γ.
Cancer Immunology, Immunotherapy : CII, v. 60, n. 11, p. 1529–41, nov. 2011.
WOO, Y. L. et al. Characterising the local immune responses in cervical intraepithelial
neoplasia: a cross-sectional and longitudinal analysis. BJOG : an international journal of
obstetrics and gynaecology, v. 115, n. 13, p. 1616–21; discussion 1621–2, dez. 2008.
YAN, G. et al. A highly sensitive label-free electrochemical aptasensor for interferon-gamma
detection based on graphene controlled assembly and nuclease cleavage-assisted target
recycling amplification. Biosensors & bioelectronics, v. 44, p. 57–63, 15 jun. 2013.
YANG, J. et al. Interferon for the treatment of genital warts: a systematic review. BMC
infectious diseases, v. 9, p. 156, jan. 2009.
68
YOGEV, N. et al. Dendritic cells ameliorate autoimmunity in the CNS by controlling the
homeostasis of PD-1 receptor(+) regulatory T cells. Immunity, v. 37, n. 2, p. 264–75, 24 ago.
2012.
ZHOU, F.; LEGGATT, G. R.; FRAZER, I. H. Human papillomavirus 16 E7 protein inhibits
interferon-γ-mediated enhancement of keratinocyte antigen processing and T-cell lysis. The
FEBS Journal, v. 278, n. 6, p. 955–63, abr. 2011.
ZIMMERMMANN, J. B. et al. Associação entre a contagem de linfócitos T CD4 + e a
gravidade da neoplasia intra-epitelial cervical diagnosticada pela histopatologia em mulheres
infectadas pelo HIV. Rev Bras Ginecol Obstet, v. 28, n. 6, p. 345–351, 2006.
ZUO, Y. et al. Minicircle-oriP-IFNγ: a novel targeted gene therapeutic system for EBV
positive human nasopharyngeal carcinoma. PloS One, v. 6, n. 5, p. e19407, jan. 2011.
ZUR HAUSEN, H. Papillomaviruses and cancer: from basic studies to clinical application.
Nature reviews. Cancer, v. 2, n. 5, p. 342–50, maio 2002.
ZUR HAUSEN, H. Papillomaviruses in the causation of human cancers - a brief historical
account. Virology, v. 384, n. 2, p. 260–5, 20 fev. 2009.