1
TOXICIDADE PULMONAR A DROGAS
Autores:
Leandro Ortega Brandão
Aluno do segundo ano médico
Integrante da Liga de Pneumologia
Faculdade de Medicina de Botucatu
Patrícia Sayuri Ishiy
Aluno do segundo ano médico
Integrante da Liga de Pneumologia
Faculdade de Medicina de Botucatu
Julio Defaveri
Professor Doutor da Disciplina de Patologia
Departamento de Patologia
Faculdade de Medicina de Botucatu
Suzana Erico Tanni
Médica Doutora da Disciplina de Pneumologia
Departamento de Clínica Médica
Faculdade de Medicina de Botucatu
Capítulo 30
2
1. Introdução
A toxicidade pulmonar a drogas constitui um grupo importante dentro das
patologias pulmonares, pois se observa aumento crescente da utilização de
fármacos potencialmente indutores de lesão pulmonar e consequentemente o
diagnóstico desta patologia também se encontra em ascensão (1).
Atualmente, há mais de 380 fármacos que são sabidamente conhecidos por
sua capacidade indutora de doenças pulmonares (2). Estes fármacos podem
acometer todos os compartimentos anatômicos pulmonares, tais como o
interstício, as vias aéreas bronco-alveolares, o sistema vascular pulmonar, a
pleura e o mediastino (1). Portanto, muitas drogas estão associadas ao
desenvolvimento de doenças pulmonares, principalmente a doença pulmonar
intersticial (DPI) e, em menor proporção, podem apresentar-se como
pneumonite por hipersensibilidade, sarcoidose e vasculite (3).
2. Epidemiologia
Não há dados na literatura que mostrem com exatidão a prevalência de
doenças pulmonares induzidas por fármacos. Uma das razões consiste na
avaliação ser realizada na maioria das vezes pelo radiograma de tórax em vez
da tomografia de tórax de alta resolução, por este ser procedimento de custo
muito maior. Desse modo, a identificação da doença pode ser subestimada (4).
Outro fato associado à falta de dados de prevalência é a ausência de
reconhecimento da doença por médicos que utilizam em sua rotina fármacos
indutores de lesão pulmonar. Além disso, não há registro nacional para esta
entidade patológica (4).
3. Fisiopatologia
O mecanismo de ação das drogas sobre o pulmão ainda não está muito
bem esclarecida. Como o pulmão faz a interface entre o meio externo e o
interno (sangue), ele funciona como sítio de captação, acúmulo e metabolismo
de numerosas substâncias químicas. Como o ar inspirado pode trazer
numerosas partículas tóxicas e o sangue é o fornecedor da maioria dos
medicamentos, independente da forma de administração, o pulmão torna-se
local frequente de reações adversas a drogas (5).
3
Os
grupos
relacionados
com
a
toxicidade
pulmonar
incluem
antimicrobianos, anti-inflamatórios, quimioterápicos, fármacos cardiovasculares
e drogas ilícitas. As reações pulmonares às drogas são resultados de seus
efeitos diretos ou indiretos nos pulmões (6, 7).
Os efeitos diretos podem ser divididos entre aqueles que apresentam
reação tóxica direta, em associação à dose ou ser decorrentes de reações
idiossincrásicas à droga (8). Como exemplos de fármacos de efeito direto,
podem-se citar amiodarona, nitrofurantoína, sulfassalazina, sais de ouro, Dpenicilamina, minociclina, estatinas e interferon (1). As lesões pela amiodarona
e bleomicina sugerem ser decorrente de efeito idiossincrático à droga, hipótese
sugerida pela grande quantidade de linfócitos presentes nas lesões, o que
indica provável mecanismo imunológico.
Entre os efeitos indiretos de drogas nos pulmões, enquadram-se fármacos
que agem em outros órgãos e podem indiretamente trazer complicações que
afetam os pulmões. Como exemplo, citam-se os fármacos que deprimem o
sistema nervoso central e que podem levar o paciente a ter aspiração de
conteúdo gástrico; ou drogas que possam aumentar risco de doenças
tromboembólicas, como os hormônios anticoncepcionais e, ainda, os fármacos
imunossupressores que podem facilitar infecções pulmonares oportunistas (8).
4. Quadro clínico
Pacientes portadores da doença pulmonar induzida por drogas podem
apresentar sintomas semelhantes, independentemente do tipo de fármaco
indutor da lesão. Além disso, os sintomas podem se confundir com outras
doenças como infecções, ou com sintomas da própria doença de base, como
as colagenoses e neoplasias (9).
O quadro clínico é inespecífico podendo apresentar dispneia, tosse e
astenia. Além disso, podem existir febre e emagrecimento. Os exames
funcionais mostram, na maioria das vezes, restrição na capacidade ventilatória
e redução na difusão de monóxido de carbono e, nas formas mais graves da
doença, pode ser encontrada hipoxemia arterial (9).
Frente ao quadro pulmonar inespecífico é essencial uma investigação sobre
todas as medicações utilizadas pelo paciente, sendo muito importante a
correlação cronológica entre o uso da droga e a manifestação clínica (1).
4
5. Diagnóstico
Para o diagnóstico da toxicidade pulmonar induzida por drogas é essencial
a exclusão de outras causas, como infecções, associação com doenças de
base, pneumonite actínica e edema pulmonar cardiogênico. Deve ser
considerada a combinação de aspectos clínicos, epidemiológicos, radiológicos,
funcionais e, quando necessários, citológicos e histopatológicos (1).
5.1 Função pulmonar
O teste de função pulmonar, na maioria dos casos, revela mudanças típicas
de doenças restritivas caracterizadas pela redução da capacidade vital forçada
(CVF) e queda proporcional do volume expirado forçado no primeiro segundo
(VEF1), o que mantém a relação VEF1/CVF normal. O diagnóstico de restrição
pode ser confirmado pela identificação da capacidade pulmonar total e do
volume residual reduzidos (10).
A capacidade de difusão do monóxido de carbono (DLCO) é o teste
recomendado para se avaliar o envolvimento do parênquima pulmonar
secundário à droga além da função pulmonar simples. É o teste que melhor
reflete a extensão das doenças intersticiais e detecta comprometimento
pulmonar mesmo com radiografias normais. Entretanto, sabe-se que as
alterações no teste de função pulmonar não são exclusivas para as doenças
pulmonares induzidas por drogas, portanto este não deve ser utilizado
individualmente, mas sim correlacionado com outros dados clínicos e
radiológicos (11).
5.2 Radiológico
Em relação às alterações radiológicas, é essencial que se determinem os
padrões presentes e o arranjo das lesões no parênquima pulmonar. Os
achados radiológicos são inespecíficos, contudo podem ser sugestivos de
diagnóstico (1).
5.2.1 Radiografia de tórax
No radiograma de tórax pode ser observado infiltrado intersticial e/ou
alveolar. Este acometimento pode ser unilateral ou bilateral, simétrico ou
5
assimétrico e apresentar redução do volume pulmonar.
Este exame é
considerado um dos principais meios para detecção dos sinais iniciais da
toxicidade pulmonar. Entretanto, o médico deve estar consciente da ampla
variedade de interpretações devido às alterações pleurais, do parênquima e do
interstício pulmonar (1, 12).
5.2.2 Tomografia de tórax
A tomografia de tórax de alta resolução (TCAR) pode revelar a doença em
estágio mais avançado do que no radiograma de tórax, pois apresenta melhor
capacidade resolutiva na diferenciação de estruturas pulmonares. Neste exame
podemos identificar alterações mais frequentemente na periferia pulmonar e
estas incluem áreas em vidro fosco, opacidades intralobulares, espessamento
dos septos interlobulares, consolidações, nódulos e massas. Padrões mais
crônicos, como reticulado e faveolamento são mais raros. Também podem ser
identificados alterações focais ou padrões em mosaico (1, 12).
Por outro lado, quando a tomografia de tórax mostra mudança de densidade
pulmonar, esta não é capaz de diferir entre a toxicidade pulmonar ou acúmulo
normal do fármaco no tecido pulmonar secundário ao seu efeito terapêutico (1,
12).
5.3 Histopatológico
Poucas drogas produzem achado histológico único e exclusivo, o que
dificulta o diagnóstico. Para o diagnóstico final é necessária avaliação do
quadro
epidemiológico,
clínico-funcional
e
radiológico
associada
à
apresentação histológica do pulmão, além de se excluir outras possíveis
causas da lesão. As alterações histopatológicas podem ocorrer por ação tóxica
celular direta pela droga, como alterações na síntese e degradação do
colágeno e aumento na produção de radicais livres, ou se originar em
decorrência de resposta reação imunológica. Podem apresentar-se como
síndrome do desconforto agudo respiratório (SDRA), desencadeada pelo dano
alveolar difuso (DAD), edema pulmonar, pneumonia intersticial não-específica
(PINE), pneumonia eosinofílica, bronquiolite obliterante,
organização, vasculites e doença pleural (6, 9).
pneumonia em
6
A SDRA é a manifestação clínica do DAD, sendo a forma mais comum e
mais grave da toxicidade pulmonar induzida por drogas, devendo ser
diferenciado do edema pulmonar não cardiogênico. DAD ocorre quando a
toxicidade resulta na necrose das células endoteliais alveolares e dos
pneumócitos tipo I e II, e que se caracteriza por fase exsudativa aguda
constituída por edema, células epiteliais necróticas e fluído rico em proteínas
no interior dos alvéolos; o fibrinogênio se polimeriza em fibrina e forma,
juntamente com lipídeos e restos celulares necróticos e inflamatórios, a
“membrana hialina”, que reveste parcial ou totalmente a parede alveolar (9).
As alterações de comprometimento intersticial, como a PINE, podem ser
divididas nos padrões celular ou fibrosante. O primeiro padrão consiste em
inflamação intersticial crônica leve a moderada, com linfócitos e poucos
plasmócitos distribuídos uniforme ou irregularmente. Já o padrão fibrosante
consiste em fibrose intersticial difusa ou irregular, com ou sem focos
fibroblásticos, não se observando o aspecto da fibrose pulmonar “em favo de
mel” (13).
Na apresentação como pneumonia eosinofílica podem ser observados
intensos agregados de eosinófilos e linfócitos no interior dos espaços
alveolares e no interstício. Já a pneumonia em organização é caracterizada por
densidades focais de fibroblastos imaturos (corpos de Masson) nas vias
aéreas, com acúmulo de macrófagos carregados de lipídeos nos espaços
aéreos distais. Esta alteração envolve predominantemente os bronquíolos
respiratórios e ductos alveolares (9).
Por fim, podemos encontrar também quadro de hemorragia pulmonar com
acúmulos de glóbulos vermelhos nos alvéolos pulmonares (13).
6. Tratamento
A suspensão do uso da medicação é uma medida eficaz e geralmente
suficiente para conter as alterações pulmonares. No entanto, o uso de
corticosteróides pode ser necessário para conter o processo inflamatório na
maioria dos casos, exceto quando já estiver estabelecido um quadro de fibrose
(1). A dose de corticóide depende da gravidade do quadro clínico, entretanto,
quando há insuficiência respiratória, há indicação de pulsoterapia com
metilprednisolona (1g por 3 dias); nos demais, a dose recomendada da
7
prednisona é de 1 a 2 mg/kg/dia por 60 a 90 dias. A redução deve ser
progressiva e depende da evolução clínica do paciente.
Em alguns fármacos, como a amiodarona, pode haver progressão da lesão
após a suspensão do fármaco, devido sua meia-vida prolongada ou por outros
fatores
ainda
desconhecidos.
Nestes
casos,
a
administração
de
corticosteróides pode ser necessária por tempo maior, de 6 a 12 meses. Em
outros casos, nos quais o uso do medicamento indutor não pode ser suspenso,
pode-se optar pela utilização concomitante do corticosteróide com a dose de 10
a 20 mg/dia por período prolongado (1).
Broncodilatadores inalatórios podem ser utilizados por pacientes que
apresentam obstrução das vias aéreas para controle de sintomas e só devem
ser mantidos se houver resposta clínica. O uso de oxigenoterapia domiciliar
prolongada deve ocorrer quando houver comprovadamente hipoxemia arterial
grave (pressão arterial de oxigênio < 55 mmHg e/ou oximetria de pulso < 88%
em ar ambiente). Recomenda-se também o uso das vacinas para influenza e
pneumococo.
7. Caso Clínico
Homem, 62 anos, negro, enfermeiro aposentado.
Paciente
portador
de
Doença
de
Chagas
com
manifestação
de
miocardiopatia dilatada e arritmogênica em tratamento clínico com uso
prolongado de amiodarona e também implantação de marcapasso com
cardioversor. Após um ano e meio com uso do fármaco, começou a apresentar
sintoma de dispneia com piora progressiva em quatro meses. Negava outros
sintomas respiratórios associados. Além disso, apresentava história tabágica
de 75 anos/maço (abstinência nicotínica há 15 anos), etilismo ativo,
hipotireoidismo em tratamento e obesidade com índice de massa corpórea de
37,2 kg/m2.
No exame físico apresentava dispneia em repouso, sem cianose,
expansibilidade torácica reduzida com crepitações finas principalmente nas
bases pulmonares.
O exame de espirometria pós-broncodilatador apresentou as seguintes
características:
8
Real (L)
% Predito
CVF
2,16
53
VEF1
1,92
61
VEF1/CVF
0,89
114
O radiograma de tórax anteroposterior (Figura 1) mostrava redução
volumétrica
dos pulmões com
áreas de
comprometimento intersticial
principalmente do lado direito, velamento do seio costofrênico do lado direito,
aumento da área cardíaca e presença de marcapasso do hemitórax esquerdo.
A tomografia de tórax mostrava espessamento irregular de septos inter e
intralobulares com sinais de distorção arquitetural associado à opacificação do
tipo vidro fosco acometendo preferencialmente o lado direito do pulmão (Figura
2).
Foi realizada biópsia pulmonar à céu aberto, representando o lobo
superior/médio/inferior direito.
O
diagnóstico
anatomopatológico
foi de
pneumonia intersticial não específica (PINE), fibrosante, em intensa atividade
(inflamação + corpos fibroblásticos de Masson (Fig. 3), compatível com efeitos
pela amiodarona, caracterizados pela presença de macrófagos e pneumócitos
tipo II espumosos nas luzes alveolares, por acúmulo intracitoplasmático de
fosfolípides (fosfolipidose adquirida (Fig 4).
O tratamento constou na substituição da amiodarona por outro fármaco
antiarrítmico, sendo necessária administração de corticóide sistêmico com
melhora clínica dos sintomas.
Este caso demonstra como um agente não citotóxico pode determinar
acometimento pulmonar agudo ou crônico com manifestações radiológicas,
clínicas e histopatológicas diversas. Dentre os agentes não citotóxicos mais
frequentemente relacionados à toxicidade pulmonar, destaca-se a amiodarona,
um antiarrítmico amplamente utilizado em arritmias ventriculares. Ressalta-se
que nos últimos anos a amiodarona obteve destaque com o seu uso em
9
portadores de disfunção ventricular por qualquer etiologia, em especial a
chagásica.
A despeito dos benefícios, essa droga produz efeitos colaterais relevantes,
como a pneumopatia intersticial crônica com fibrose, pneumonia em
organização e síndrome de desconforto respiratório agudo. Além desses,
podem ocorrer hipotireoidismo e hipertireoidismo, coloração azulada da pele,
neuropatia periférica, supressão da medula óssea, fotossensibilidade, hepatite,
bloqueios cardíacos entre outros (1, 14).
Sabe-se que toxicidade pulmonar por amiodarona (TPA) ocorre em 5% a
7% dos pacientes usuários desta medicação, com maior correlação com a dose
cumulativa total do que com o nível sérico da droga (15). Os mecanismos de
ação que levam a TPA ainda não são completamente conhecidos. Acredita-se
que pode existir toxicidade direta às células pulmonares e reação imunológica
indireta pela intensa linfócitose observada nas lesões (Figura 3) (15, 16).
Embora não patognomônico, a ação tóxica direta é sugerida pelo aparecimento
de macrófagos e pneumócitos tipo II com citoplasma de aspecto espumoso, por
acúmulo de fosfolípides, devido a diminuição de sua degradação pela droga
(fosfolipidose adquirida)(Figura 4).
Perguntas
1) Qual o fator precedente do paciente que pode influenciar no
desenvolvimento da doença pulmonar intersticial?
(a) hipotireoidismo
(b) obesidade
(c) doença de chagas com uso de antiarrítmico
(d) etilismo
Resposta: (c)
Comentário: Pelo fato do paciente ser portador de doença de Chagas, uma
doença que afeta progressivamente o coração, cursando com arritmias
frequentes, foi recomendado o uso da amiodarona, na tentativa de se
controlar os episódios de arritmias cardíacas.
10
2) A espirometria e os exames radiológicos são compatíveis com qual
diagnóstico abaixo?
a) Doença pulmonar obstrutiva crônica
b) Doença pulmonar intersticial
c) Asma
d) Tuberculose
Resposta: (b)
Comentário: A espirometria mostra redução proporcional da CVF e do
VEF1, o que manteve a relação VEF1/CVF normal, característico de doença
restritiva e compatível com a redução volumétrica dos pulmões e o
comprometimento intersticial identificado no radiograma de tórax e na
tomografia de tórax.
REFERÊNCIAS
1.
Baldi BG, Costa AN, Kairalla RA. Doenças pulmonares induzidas por
drogas. In: Alberto Cukier, et al. Atualização e reciclagem em pneumologia. 8
ed. Rio de Janeiro: Elselvier, 2009.p.287-294.
2.
Arshad Ali, M Frances J Schmidt. Drug-induced pulmonary toxicity.
Feb,1 [cited; Available from:http://emedicine.medscape.com/article/1343451overview].
3.
Perez-Alvarez R, Peres-de-Lis M, Diaz-Lagares C, Pego-Reigosa JM,
Retamozo S, Bove A, et al. Lung disease induced or exacerbated by TNFtargeted therapies: Analysis of 122 Cases. Semin Arthritis Rheum. 2011. [Epub
ahead of print].
4.
Camus PF, Foucher P, Bonniaud KA, Ask K . Drug-induced infiltrative
lung disease. Eur Respir J Suppl. 2001;18(32):93s-100s.
5.
Wijnen PA, Bekers O, Drent M. Relationship between drug-induced
interstitial lung diseases and cytochrome P450 polymorphisms. Curr Opin Pulm
Med. 2010;16(5):496-502.
11
6.
Rossi SE, Erasmus JJ, McAdams HP, Sporn TA, Goodman PC.
Pulmonary
drug
toxicity:
radiologic
and
pathologic
manifestations.
Radiographics. 2000;20(5):1245-59.
7.
Rosenow EC 3rd, Myers JL, Swensen SJ, Pisani RJ. Drug-induced
pulmonary disease. Chest. 1992;102(1):239-50.
8.
Crystal RG, Fulmer I, Roberts W, Moss M. Idiopathic pulmonary fibrosis:
clinical, radiographic, physiologic, scintigraphic, cytologic and biochemical
aspects. Ann Intern Med. 1976;85(6):768-88.
9.
Erasmus JJ, McAdams HP, Rossi SE. Drug-induced lung injury. Semin
Roentgenol. 2002;37(1):72-81.
10.
Sociedade Brasileira de Pneumologia e Tisiologia. II Consenso brasileiro
sobre espirometria. J Bras Pneumol. 2002;28(3):S2-S115.
11.
Crapo RO. Pulmonary-function testing. N Engl J Med 1994;331(1):25-30.
12.
Pourafkari L, Ghaffari MR, Yaghoubi A, Ghaffari S. Amiodarone-induced
lung Toxicity. J Cardiovasc Thorac Res. 2010;2(2):1-4.
13.
Abbas AK, Aster JC, Fausto N, Kumar V. O Pulmão. In: Aliya N Husain.
Robbins e Cotran. Bases patológicas das doenças. 8 ed. Rio de Janeiro:
Elselvier, 2010.p.685-745..
14.
Papiris SA, Triantafillidou C, Kolilekas L, Markoulaki D, Manali E.
Amiodarone:
review
of
pulmonary
effects
and
toxicity.
Drug
Saf.
2010;33(7):539-58.
15.
Silva CP, Bacal F, Pires PV, Drager LF, Souza GEC, Fajardo GMG, et al.
The importance of amiodarone pulmonary toxicity in the differential diagnosis
of a patient with dyspnea awaiting a heart transplant. Arq Bras Cardiol.
2006;87(3):e4-7.
16.
Martin WJ, Rosenow EC. Amiodarone pulmonary toxicity. Recognition
and pathogenesis. Chest. 1988;93:1242-8.
12
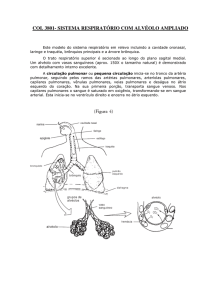
Figura 1: Radiograma de tórax anteroposterior que ilustra redução volumétrica
dos pulmões com comprometimento intersticial principalmente do lado
direito, velamento do seio costofrênico do lado direito, aumento da área
cardíaca e presença de marcapasso do hemitórax esquerdo
13
Figura 2: Tomografia de tórax evidencia espessamento irregular de septos inter
e intralobulares com sinais de distorção arquitetural associado à
opacificação do tipo vidro fosco acometendo preferencialmente o lado
direito do pulmão.
14
Figura 3: Amiodarona-PINE - Foto maior: Fibrose irregular com
remodelamento bronquíolo-alveolar. Infiltrado linfocitário intersticial
(estrela) e focos miofibroblásticos em matrix mixóide (corpos de Massonseta na foto menor), indicando atividade da agressão pulmonar
(Hematoxilina-eosina. Aumento original 400x)
15
Figura 4: Toxicidade pela Amiodarona - Foto maior: aumento de
macrófagos alveolares e pneumócitos tipo II com aspecto espumoso
(demarcado na foto maior e em maior aumento indicado pela seta na
foto menor). Observa-se fibrose do parênquima pulmonar em azul
(Tricrômico de Masson. Aumento original 400x