FCAV/UNESP
DISCIPLINA:
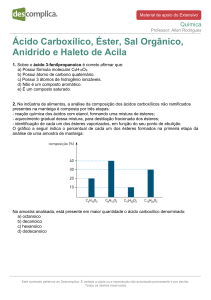
Química Orgânica
ASSUNTO:
Ácidos Carboxílicos e Ésteres
Profa. Dra. Luciana Maria Saran
1
CLASSE FUNCIONAL ÁCIDO CARBOXÍLICO
Os compostos desta classe têm em
comum a presença do grupo funcional
– COOH.
Fonte: PERUZZO, 2006.
2
Ácidos Carboxílicos e Derivados
Fonte: BARBOSA, 2004.
3
CLASSE FUNCIONAL ÁCIDO CARBOXÍLICO
Exemplo: ácido etanóico ou ácido
acético.
Fonte: PERUZZO, 2006.
4
ÁCIDOS CARBOXÍLICOS DE CADEIA LONGA
Ácidos Graxos
Ácido Esteárico, C18H36O2
5
ÁCIDOS CARBOXÍLICOS DE CADEIA LONGA
Ácidos Graxos
Ácido Oléico, C18H34O2
6
ÁCIDOS CARBOXÍLICOS DE CADEIA LONGA
Ácidos Graxos
Ácido Linoléico, C18H32O2
7
CLASSE FUNCIONAL ÁCIDO CARBOXÍLICO
Nomenclatura dos ácidos carboxílicos
não ramificados:
- A nomenclatura dessa classe funcional
é feita com a utilização do sufixo óico.
Fonte: PERUZZO, 2006.
8
CLASSE FUNCIONAL ÁCIDO CARBOXÍLICO
Nomenclatura dos ácidos carboxílicos
ramificados:
Fonte: PERUZZO, 2006.
9
ÁCIDOS CARBOXÍLICOS
NOMENCLATURA TRIVIAL
Fonte: PERUZZO, 2006.
10
Grupos Univalentes
Fonte: BARBOSA, 2004.
11
Ácidos Carboxílicos e Derivados
Fonte: BARBOSA, 2004.
12
Ácidos Carboxílicos e Derivados
Fonte: BARBOSA, 2004.
13
Propriedades Físicas
Os ácidos carboxílicos são capazes de formar
ligações de hidrogênio entre si e com solventes
polares como a água.
Fonte: BARBOSA, 2004.
14
Propriedades Físicas
Por serem capazes de formar ligações de hidrogênio e, ainda, por serem mais polares do que os
álcoois, os ácidos carboxílicos são mais solúveis
em água do que estes últimos e apresentam
temperaturas de ebulição mais elevadas que os
álcoois de massa molecular comparável.
15
Propriedades Físicas
As temperaturas de ebulição dos ácidos carboxílicos
alifáticos elevam-se com o aumento do no de átomos
de C e as respectivas solubilidades diminuem.
Fonte: BARBOSA, 2004.
16
Acidez de Ácidos Carboxílicos
Ionizam-se parcialmente em água. Reagem rapidamente
com soluções aquosas de hidróxido de sódio e bicarbonato de sódio, formando sais de ácidos carboxílicos.
Fonte: BARBOSA, 2004.
17
Acidez de Ácidos Carboxílicos
Os ácidos carboxílicos são ácidos fracos.
Fonte: BARBOSA, 2004.
18
IONIZAÇÃO DE ÁCIDOS FRACOS
De maneira geral um ácido fraco, como por exemplo o
ácido hipotético HA, ioniza-se conforme representado
abaixo:
HA(aq)
H+(aq) + A-(aq)
Para o equilíbrio acima vale a seguinte expressão da
constante de equilíbrio, Ka:
[H ]x[ A ]
Ka
[HA ]
Ka é a constante de ionização do ácido. O seu valor é
dependente da temperatura.
19
Exemplo:
Numa solução aquosa de ácido acético, CH3COOH, um
ácido fraco, temos:
CH3COOH(aq)
H+(aq) + CH3COO-(aq)
Para a ionização do CH3COOH é válida a seguinte
expressão para o cálculo de Ka:
[H ]x[CH3COO ]
Ka
[CH3COOH ]
Ka(CH3COOH) = 1,75x10-5, a 25oC
20
IONIZAÇÃO DE ÁCIDOS FRACOS
Quanto menor o valor de Ka, mais fraco é o ácido.
pKa = - log Ka
Ka = 10-pKa
No caso de ácidos polipróticos, ou seja, para aqueles
ácidos que apresentam mais de um hidrogênio
ionizável, a ionização ocorre em etapas e para cada
etapa há uma constante de equilíbrio.
21
Força do Ácido Aumenta
pKa aumenta
22
IONIZAÇÃO DOS ÁCIDOS CARBOXÍLICOS
Exemplo: ionização do ácido etanóico
23
Os ácidos carboxílicos simples, RCO2H, em
que R é um grupo alquila, não diferem muito
quanto a força.
Exemplo: ácido acético, pKa = 4,74 e ácido
propanóico, pKa = 4,89.
A acidez dos ácidos carboxílicos é aumentada
quando substituintes eletronegativos (Cl, Br,
NO2, etc.) substituem os hidrogênios do grupo
alquila.
24
Valores de pKa de uma série de ácidos acéticos
em que o hidrogênio é substituído sequencialmente
por cloro, um elemento mais eletronegativo:
Ácido
pKa
CH3CO2H, ácido acético
4,74
ClCH2CO2H, ácido cloroacético
2,85
Cl2CHCO2H, ácido dicloroacético
1,49
Cl3CCO2H, ácido tricloroacético
0,7
Acidez
Crescente
25
CLASSE FUNCIONAL ÉSTER
Grupo funcional característico desta
classe de compostos:
Fonte: PERUZZO, 2006.
26
CLASSE
FUNCIONAL
ÉSTER
Exemplo:
etanoato
de etila
ou acetato
de etila.
Fonte: PERUZZO, 2006.
27
CLASSE FUNCIONAL ÉSTER
Os ésteres são comumente empregados como
flavorizantes em balas e doces.
Fonte: PERUZZO, 2006.
28
O QUE SÃO FLAVORIZANTES?
As substâncias naturais ou artificiais responsáveis
por conferir ou acentuar o sabor e o aroma dos
alimentos e bebidas recebem o nome de
flavorizantes.
A maioria dos flavorizantes sintéticos pertence ao
grupo dos ésteres orgânicos, que normalmente têm
baixa massa molecular, além de serem solúveis em
água e muito voláteis.
29
Nome do éster
Fórmula
Aroma/sabor
Butanoato de etila
C3H7 - COO - C2H5
Abacaxi
Formato de isobutila
H - COO - C4H9
Framboesa
Formato de etila
H - COO - C2H5
Pêssego
Butanoato de pentila
C3H7 - COO - C5H11
Abricó
Acetato de pentila
CH3 - COO - C5H11
Pêra
Etanoato de octila
CH3 - COO - C8H17
Laranja
Etanoato de benzila
CH3 - COO - CH2 - C6H5
Gardênia
Etanoato de pentila
CH3 - COO - C5H11
Banana
Heptanoato de etila
C6H13 - COO - C2H5
Vinho
Etanoato de etila
CH3 - COO - C2H5
Maçã
Nonilato de etila
C8H17 - COO - C2H5
Rosa
Antranilato de metila
H2N - C4H6 - COO - CH3
Jasmim
Caprilato de etila
C5H11 - COO - C2H5
Pinha
Acetato de etila
CH3 - COO - C2H5
Menta
Butanoato de butila
C3H7 - COO - C4H9
Damasco
Etanoato de isobutila
CH3 - COO -C4H9
Morango
30
CLASSE FUNCIONAL ÉSTER
Triestearina, C57H110O6
31
CLASSE FUNCIONAL ÉSTER
Nomenclatura:
Fonte: PERUZZO, 2006.
32
CLASSE FUNCIONAL ÉSTER
Nomenclatura:
Fonte: PERUZZO, 2006.
33
ÉSTERES
Preparação:
ÉSTERES
Hidrólise Ácida
A reação de ésteres com água, catalisada por um ácido
forte (por ex., HCl) resulta na formação de uma molécula
de ácido carboxílico e outra de álcool.
Fonte: BARBOSA, 2004.
ÉSTERES
Hidrólise Básica (saponificação)
Essa reação é chamada de saponificação, porque,
quando realizada com ésteres de ácidos graxos (ácidos
carboxílicos lineares de cadeia longa), leva à formação
de sabão (sais de ácidos graxos).
Fonte: BARBOSA, 2004.
Sabões e Detergentes
Reação de Saponificação
O aquecimento de gordura animal ou óleo vegetal
(ambos ésteres do glicerol com ácidos graxos) com
base resulta na reação de hidrólise denominada
saponificação.
triestearina ou triestearil glicerol
Fonte: BARBOSA, 2004.
37
Sabões
São sais de ácidos graxos. Ex.: estearato de sódio.
Têm uma cadeia longa pouco polar ou lipofílica. Já o
grupo carboxilato é muito polar e,portanto, hidrofílico.
São solúveis tanto em gordura quanto em água.
Fonte: BARBOSA, 2004.
38
Sabões
Quando o sabão é colocado em contato com a água,
forma-se uma dispersão coloidal constituída por agregados denominados micelas.
Fonte: BARBOSA, 2004.
39
Micela: é uma estrutura globular formada por um
agregado de moléculas anfipáticas, ou seja,
moléculas que possuem características polares e
apolares simultaneamente, dispersas em um líquido
constituindo uma das fases de um colóide.
Esquema de uma micela. Cada
molécula formadora da micela é
representada por uma cabeça
polar e uma cauda apolar
Coloides (ou sistemas coloidais ou ainda
dispersões coloidais) são sistemas nos quais um ou
mais componentes apresentam dimensão dentro do
intervalo de 0,001 a 1µm.
40
A superfície interna daSabões
micela é pouco polar e dissolve
gorduras e outros compostos pouco polares. Já a superfície externa é muito polar, o que possibilita a solubilização do sabão em meio aquoso.
Fonte: BARBOSA, 2004.
41
Emulsão: mistura entre dois líquidos imiscíveis em que
um deles (a fase dispersa) encontra-se na forma de finos
glóbulos no seio do outro líquido (a fase contínua),
formando uma mistura estável. As emulsões mais
conhecidas consistem de água e óleo.
As emulsões são instáveis termodinamicamente e,
portanto não se formam espontaneamente, sendo
necessário fornecer energia para formá-las através de
agitação ou de homogeneizadores. Com o tempo, as
emulsões tendem a retornar para o estado estável de óleo
separado da água.
Os
agentes
emulsificantes
(surfactantes
ou
tensoativos) são substâncias adicionadas às emulsões
para aumentar a sua estabilidade.
42
A. Dois líquidos imiscíveis
separados em duas fases (I e
II).
B. Emulsão da
dispersa na fase I.
fase
II
C. A emulsão instável
progressivamente retorna ao
seu estado inicial de fases
separadas.
D. O surfactante (sabão ou
detergente) se posiciona na
interface entre as fases I e II,
estabilizando a emulsão.
43
Detergentes Sintéticos
Também possuem cadeia longa de carbonos (lipofílica)
e uma extremidade polar (hidrofílica).
Enquanto os sabões de ácidos graxos são insolúveis
em águas duras, os detergentes sintéticos podem ser
usados mesmo em águas duras.
Fonte: BARBOSA, 2004.
44
ÉSTERES
Reação de Transesterificação
Os ésteres reagem com metóxido de sódio (MeONa)
em metanol, produzindo um éster metílico. Esta reação
é conhecida como transesterificação.
Fonte: BARBOSA, 2004.
ÉSTERES
Reação de Transesterificação
Aplicação Importante: produção de biodiesel.
Biodiesel: éster de ácido graxo, obtido comumente
a partir da reação química de óleos vegetais ou gordura
animal, com um álcool na presença de um catalisador.
Reação de Transesterificação
(Produção de Biodiesel)
Reação de Transesterificação
(Produção de Biodiesel)
Referências
BARBOSA, L. C. de. Introdução à Química Orgânica.
São Paulo:Prentice Hall, 2004. 311 p.
PERUZZO, F. M.; CANTO, E. L. do. Química na Abordagem
do Cotidiano. 4. ed. São Paulo:Moderna, 2006. v. 3,
Química Orgânica.
UCKO, A. D. Química para as Ciências da Saúde: uma
introdução à química geral, orgânica e biológica. São
Paulo:Manole, 1992. 646 p.
49