1
Trabalho 1 de Fundamentos de Química Farmacêutica
Origem e Desenvolvimento dos Fármacos
1) Os efeitos que os fármacos causam resultam de um conjunto complexo de
processos, em que intervêm fatores diversos. Em suma, na ação dos fármacos
observam-se três fatores. Cite e defina estas fases da ação biológica.
2) Quais são os objetivos do processo de modificação molecular?
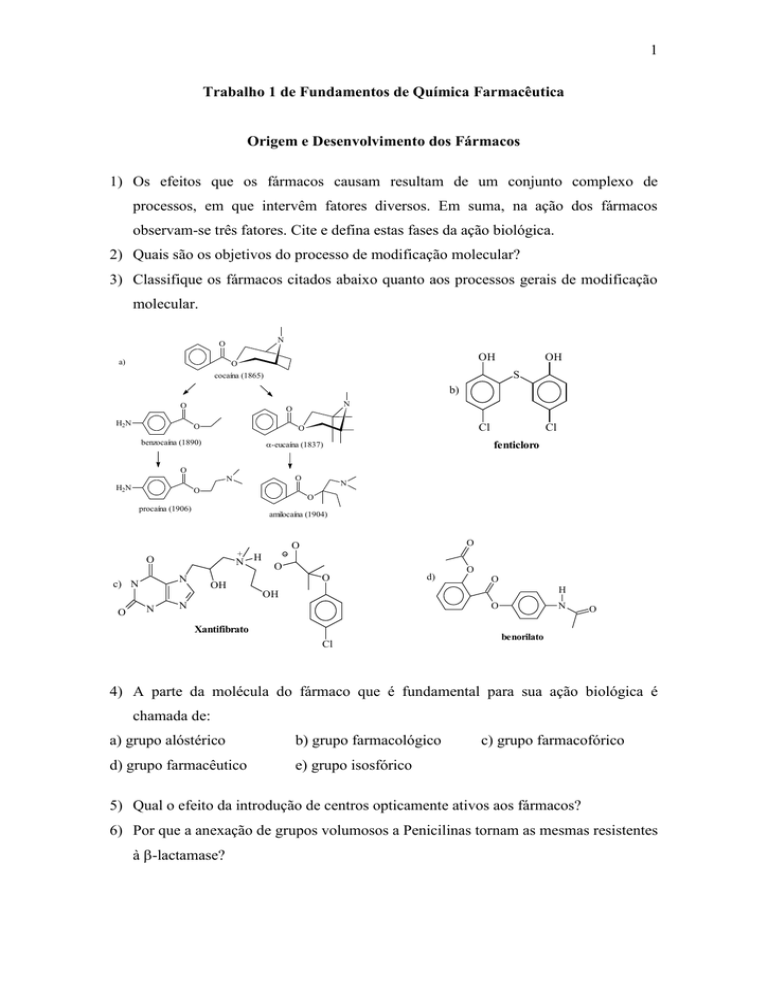
3) Classifique os fármacos citados abaixo quanto aos processos gerais de modificação
molecular.
N
O
a)
OH
O
OH
S
cocaína (1865)
b)
O
H2N
N
O
O
Cl
O
a-eucaína (1837)
benzocaína (1890)
Cl
fenticloro
O
O
N
H2N
O
N
O
procaína (1906)
amilocaína (1904)
O
O
+
N H
O
N
c) N
O
O
OH
d)
O
O
H
OH
O
N
N
O
Xantifibrato
Cl
N
O
benorilato
4) A parte da molécula do fármaco que é fundamental para sua ação biológica é
chamada de:
a) grupo alóstérico
b) grupo farmacológico
d) grupo farmacêutico
e) grupo isosfórico
c) grupo farmacofórico
5) Qual o efeito da introdução de centros opticamente ativos aos fármacos?
6) Por que a anexação de grupos volumosos a Penicilinas tornam as mesmas resistentes
à -lactamase?
2
7) A introdução de anti-histamínicos H2 (anti-H2), na década de 70, do século XX, foi
um marco na terapêutica de úlceras gástricas e fundamentou-se no modo de
interação da histamina com o receptor H2, por meio de pesquisa multidisciplinar e
multinacional. Alguns anti-H2, como a cimetidina, o primeiro fármaco dessa classe
terapêutica, conservam o núcleo imidazólico da histamina. Outros sofreram
diferentes modificações, incluindo as do núcleo, conforme mostra a figura.
NH2
N
N
histamina
N
S
H
H
H
H
N
N
N
N
S
N
N
cimetidina
S
N
H
H
H
H
N
N
N
N
S
S
S
N
H2N
N
H2NO2S
N
famotidina
H2N
O
H
S
N
N
O
ranitidina
N
tiodina
H2N
N
N
N
H2N
N
O
S
H
H
O
N
N
N
niazitidina
O
O
O
N
O
N
O
roxatidina
N
Analisando-se as alterações efetuadas nos núcleos, o processo de modificação molecular
utilizado é:
a) rearranjo de núcleo
b) bioisosterismo
c) ciclização da cadeia lateral
d) homologia
e) vinilogia
8) Uma substância química é preparada visando uma possível atividade biológica. Este
método de desenvolvimento de fármaco é conhecido como:
a) Triagem empírica
b) Triagem empírica dirigida
d) Bioisosterismo
e) Modificação molecular
c) latenciação
3
9. O cloranfenicol possui gosto amargo, enquanto que o seu éster é insípido e, in vivo, é
hidrolisado, liberando o fármaco ativo.
NO2
NO2
in vivo
O
CH OH
CH OH
CH NHCCHCl2
CH NHCCHCl2
CH3(CH2)14CO CH2
O
HO CH2
O
cloranfenicol
palmitato de cloranfenicol
O processo de obtenção do palmitato de cloranfenicol recebe o nome de:
A) Isosterismo
B) Latenciação
C) Hibridação
D) Replicação Molecular
10. A ampicilina é uma penicilina relativamente estável em meio ácido, mas é pobremente
absorvida por via oral (30 a 40%). Foram preparados ésteres aciloximetílicos (ex,
bacampenicilina) lábeis a hidrólise. Ela é hidrolisada por estearases do plasma levando a um
hemiacetal lábil no pH fisiológico, que se decompõe em ampicilina e acetaldeído.
NH2
NH2
H
N
O
S
N
bacampenicilina
O
S
estearase
O
O
H2O
O
O
C
H
N
N
O
C
Instável
O
O
O
OH
H2O
NH2
O
CH3
C
H
acetaldeído
+
H
N
O
S
N
O
ampicilina
C
O
OH
Com relação à ampicilina a bacampenicilina:
A) É um análogo inativo que é biotransformado em fármaco ativo por reação de hidrólise
catalisada por uma enzima que é uma esterase.
B) É um pró-fármaco obtido através de latenciação da ampicilina por uma reação de hidrólise
enzimática.
C) É um isóstero, cuja biotransformação ocorre por reação de óxido-redução.
D) É um pró-fármaco cuja biotransformação se inicia por reação de hidrólise catalisada por uma
enzima que é uma esterase.
4
11. A maioria doa fármacos foram obtidos a partir da modificação molecular, que compreende
vários processos. Observe os exemplos abaixo.
O
O
N
N
H2N
H2N
e
O
H
O
O
H N C
I
N
H N C
CH3
CH3
II
e
O
OH
C
CH2N
O
O
O
O
H N C
O
O
CH3
O
,
OH
O
e
H
O
III
N
O
OH
Os processos utilizados em I, II e II são, respectivamente,
A) latenciação, hibridação molecular e duplicação molecular.
B) bioisosterismo, latenciação e hibridação.
C) simplificação molecular, bioisosterismo e latenciação.
D) adição molecular, latenciação e bioisosterismo.
E) hibridação molecular, bioisosterismo e adição molecular.
12. As estruturas dos compostos II obtidos a partir da modificação molecular de I encontram-se
abaixo.
H2N
N
N
N
N
R
N
O
X
I. X = OH R = H ácido fólico
II. X = NH2 R = CH3 metotrexato
H2N
N
O
HO
OH
O
O
Y
X
H N
I. Y = -COOH ácidop-aminobenzóico
O
O
II. Y =
S
N
N
O H
N
I. X = O uracil
II X = S fluoruracil
H
N
sulfadiazina
Os compostos II apresentam, em comum, o mecanismo de ação de antagonismo
A) fisiológico, por meio da aplicação do bioisosterismo às aminas biógenas.
5
B) farmacológico, por meio da aplicação da latenciação às aminas biógenas.
C) metabólito, por meio da aplicação da latenciação aos respectivos metabólitos essenciais.
D) farmacológico, por meio da aplicação do bioisosterismo aos respectivos metabólitos
essenciais.
E) metabólito, por meio da aplicação do bioisosterismo aos respectivos metabólitos essenciais.
Aspectos Teóricos da Ação dos Fármacos
1. Analise as características abaixo e diga se correspondem a fármacos: A)
Estruturalmente Específicos ou B) Estruturalmente Inespecíficos.
(
) Têm que possuir estrutura química comum para terem ações biológicas
semelhantes.
(
) Pequenas alterações na sua estrutura química não resultam em alterações
acentuadas na ação biológica.
(
) Ação biológica depende da estrutura química.
(
) Atuam em doses relativamente elevadas.
(
) Embora apresentem estruturas químicas muito variadas, sem nenhuma relação
entre si, podem provocar reação biológica semelhante.
(
) Pequenas variações na estrutura química resultam em grandes alterações na
atividade biológica.
(
) Ação biológica depende das propriedades físico-químicas.
(
) São eficientes em concentrações baixas.
2. Analise os casos abaixo e diga qual a força relevante para o reconhecimento
molecular.
a)
6
b)
R
R
R´
+
NH3
R´
O
O
R´´
O
R
R´
c)
d)
H
R
H
R1
H -
H
R
R1
-
H -
R
R1 - H
interação de van der Waals
e)
7
3. Assinale se as afirmativas abaixo são verdadeiras (V) ou falsas (F).
(
) Nos grupos biofuncionais as partes essenciais requerem alta especificidade
estrutural, pois são e as que, como partes ativas, interagirão com os aceptores ou
receptores, acarretando a ação farmacológica.
(
) Receptor é uma porção limitada de macromoléculas em geral de natureza protéica.
(
) Nos grupos biofuncionais as partes acessórias intervêm na complexação fármaco-
receptor, de sorte que não é permissível grande variabilidade em suas estruturas
químicas.
(
) Complexação é uma sequência lógica de reações químicas ou conformacionais
que causam ou inibem reações biológicas.
(
) Quanto maior for o grau de complementaridade, menores serão a especificidade e
atividade do fármaco.
(
) A diferença acentuada na atividade farmacológica de muitos estereoisômeros
fornece a melhor prova de existência de receptor.
4) Porque o trans-dietilestilbestrol (12) apresenta atividade estrogênica 14 vezes maior
que o isômero cis correspondente (14).
OH
CH3
H
CH3
o
10,8 A
OH
o
12,1 A
H
HO
HO
estradiol (13)
H3C
trans-dietilestilbestrol (12)
CH3
CH3
HO
OH
o
7,7 A
cis-dietilestilbestrol (14)
5. O estudo da estereoquímica de fármacos é importante porque existe a
estereoespecificidade nas interações entre os fármacos, que representam isomeria ótica
com os seus receptores. Portanto, a identificação do antípoda com maior atividade
significa que é o isômero que interage com mais afinidade com o seu receptor
específico. Sobre o salbutamol é correto afirmar:
8
HO
OH
HO
NH
salbutamol
A) Possui quatro isômeros ópticos: 1R2S, 1R2R, 1S2R e 1S2S.
B) Possui um isômero óptico com a configuração R e outro com a configuração S.
C) Possui dois isômeros ópticos R.
D) Possui dois isômeros ópticos S.
E) Possui quatro isômeros ópticos: 1R, 2S, 1S e 2R.
6. O captopril, anti-hipertensivo inibidor da enzima conversora de angiotensina (ECA),
é exemplo de planejamento de fármaco dirigido ao sítio ativo. A figura abaixo mostra os
compostos sintetizados e as respectivas atividades, expressas em IC50 , até se obter o
captopril.
N
CO 2H
HO
O
O
N-succinilprolina
IC50 = 330 M
O
O
H
H CH3
O
IC50 = 22 M
O
IC50 = 0,20 M
CO 2H
N
HO
O H3C
N
HS
CO2H
N
HO
IC50 = 1480 M
CO2H
N
CO2H
HS
O
H3C
H
IC50 = 0,0230 M
A análise da figura permite concluir que a atividade inibidora da ECA é favorecida:
A) pela ausência de grupo metila em alfa à carbonila, com maior interação com sítio
hidrofóbico, e pela presença de grupo sulfidrila, que melhor coordena com o zinco da
enzima.
B) pela presença tanto de grupo metila em alfa à carbonila, com interação inespecífica
com sítio hidrofóbico, quanto de grupo sulfidrila, que melhor coordena com o zinco da
enzima.
C) pela presença tanto de grupo metila em alfa à carbonila, com interação inespecífica
com sítio hidrofóbico, quanto de grupo carboxila terminal, que melhor coordena com o
zinco da enzima.
9
D) pela presença tanto de grupo metila em alfa à carbonila, que interage
estereoespecificamente com o sítio hidrofóbico, quanto de grupo sulfidrila, que melhor
coordena com o zinco da enzima.
E) pela presença de grupo carboxila terminal, que melhor interage com o zinco da
enzima, e pela ausência de grupo metila em alfa à carbonila, que aumenta a ligação ao
sítio hidrofóbico.