Universidade Federal de Campina Grande
Centro de Ciências e Tecnologia Agroalimentar
Profª Roberlúcia A. Candeia
Disciplina: Química Orgânica
1
Isomeria
É o fenômeno onde dois ou mais compostos possuem a
mesma formula molecular (o mesmo conjunto de átomos)
e
diferentes
fórmulas
estruturais
(diferentes
conectividades entre os átomos).
Analogamente,
Quantas palavras diferentes é possível escrever
combinando as letras A, O, R e M?
AMOR, ROMA, MORA, ORAM, RAMO, OMAR, ETC...
2
Na Química:
Fórmula molecular C2H6O:
Pto ebulição
Pto fusão
78ºC
-117ºC
-24ºC
-139ºC
Fórmula molecular C3H6O:
Pto ebulição
Pto fusão
56ºC
- 95ºC
34ºC
-112ºC
Compostos orgânicos de mesma fórmula
molecular que apresentam propriedades
diferentes, são denominados de Isômeros.
3
Classificação da Isomeria
Isomeria Constitucional (ou Planar): a diferença entre os compostos
é visível no plano, ou seja, é explicada por fórmulas estruturais
planas.
Estereoisômeros (ou Espacial, ou Estereoquímica): a diferença
entre os compostos só é visível no arranjo espacial dos átomos, ou
seja, é explicada por fórmulas estruturais espaciais.
Constitucional
Cadeia (ou de núcleo)
Posição
Função (ou funcional)
Compensação (ou Metameria)
Tautomeria
Isomeria
Estereoisômeros
Geométrica ( ou cis-trans)
Óptica
4
I.1. Isomeria de Cadeia (ou de núcleo):
A diferença entre os isômeros está no tipo de cadeia carbônica, ou
seja, é aquela onde os isômeros tem cadeias (ou núcleos) diferentes.
a) Cadeia aberta x fechada
CH3- CH = CH2
C3H6
CH2
Propeno
Ciclopropano
CH2- CH2
b) Cadeia normal x ramificada
C4H10
CH3
CH3- CH - CH3
Metilpropano
CH3- CH2- CH2 - CH3
Butano
5
c) Cadeia Homogênea x Heterogênea
H
C2H7N
CH3- N - CH3
CH3- CH2- NH2
Dimetilamina
Etilamina
6
2. Isomeria de Posição:
A diferença entre os isômeros está na posição de um radical,
de um grupo funcional ou de uma insaturação.
a) Diferente posição de um radical
1
2
3
4
5
CH3- CH- CH2-CH2-CH3
C6H14
2-metil-pentano
CH3
1
2
3
4
5
CH3- CH2- CH-CH2-CH3
3-metil-pentano
CH3
7
b) Diferente posição de um grupo funcional
C3H8O
3
2
1
CH3- CH2- CH2- OH
1
2
3
CH3- CH- CH3
Propan-1-ol
Propan-2-ol
OH
c) Diferente posição de uma insaturação
C4H8
1
2 3 4
CH2=CH-CH2-CH3
But-1-eno
1
2 3 4
CH3-CH=CH-CH3
But-2-eno
8
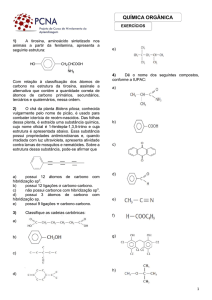
3. Isomeria de Função (ou funcional):
A diferença entre os isômeros está no grupo funcional, ou
seja, apresentam funções químicas diferentes.
Os casos mais comuns são entre:
a) Álcoois e Éteres
C2H6O
CH3- CH2 – OH
Etanol
CH3- O - CH3
Metóxi-metano
b) Aldeídos e Cetonas
C3H6O
CH3- CH2 - CHO
Propanal
CH3 - CO - CH3
Propanona
9
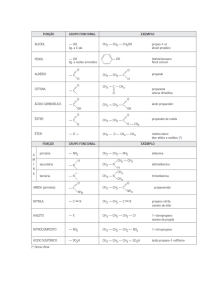
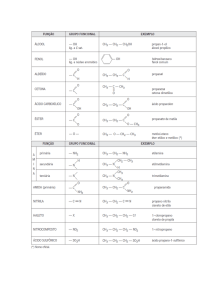
c) Ácido Carboxílicos e Ésteres
CH3- CH2 -COOH
Ác. Propanóico
C3H6O2
CH3 -COO- CH3
Etanoato de metila
d) Álcoois Aromáticos, Éteres Aromáticos e Fenóis
CH2OH
OCH3
CH3
OH
Álcool Benzílico
(Álcool aromático)
Metóxi-benzeno
(Éter aromático)
O- Cresol
(Fenol)
10
4. Isomeria de Compensação (ou Metameria):
A diferença entre os isômeros está na posição de um
heteroátomo, ou seja, quando os isômeros diferem pela posição de um
heteroátomo na cadeia carbônica.
CH3- CH2 -O- CH2 - CH3
C4H10O
Etóxi-etano
CH3 -O- CH2 - CH2 - CH3
Metóxi-propano
Vejam que, além da mudança de posição do heteroátomo, os dois
isômeros pertencem ao mesmo grupo funcional (Éter), sendo então,
denominado de metâmeros. “meta ” = mudança.
11
5. Isomeria de dinâmica (ou Tautomeria):
É o caso particular da isomeria funcional em que os dois
isômeros ficam em equilíbrio dinâmico.
1ºCaso: Tautomeria Aldo-Enólica, que é o equilíbrio entre um aldeído e
um enol
Enol
CH2
H
C
OH
Aldeído
H
CH3 - C
O
12
2ºCaso: Tautomeria Ceto-enólica que é o equilíbrio entre uma cetona e
um enol
O
OH
CH2
C
Enol
CH3
CH3
C
CH3
Cetona
13
II. Estereoisomeria :
1) Isomeria Geométrica (ou Cis-Trans):
Pode ocorrer em dois casos principais, que são:
a) Isomeria cis-trans em compostos com dupla ligação:
Ex:
Cis-1,2-dibromo-eteno
Isômero Cis: Possui ligantes
iguais em um mesmo plano
Trans-1,2-dibromo-eteno
Isômero
Trans:
Possui
ligantes iguais em planos
14
opostos.
15
Ambos possuem propriedades físicas (densidade, pto
de fusão e ebulição, etc.) e propriedades químicas
diferentes.
Na ligação dupla um carbono não pode girar livremente em
relação ao outro, a existência das duas estruturas é
justificada. E este fenômeno denominado rotação inibida (ou
impedida), também ocorre em cadeias cíclicas.
16
b) Isomeria cis-trans em compostos cíclicos:
Cis-1,2-dibromo-propano
Trans-1,2-dibromo-propano
No espaço
Cis-1,2-dibromo-propano
Trans-1,2-dibromo-propano
17
Isomeria E-Z
Proposto pelo cientistas Ingold, Bósnio e Prelog, a nomenclatura mais
aplicada a alcenos cujos átomos de carbono da dupla possuem em
conjunto mais que dois ligantes diferentes.
ou
Com A ≠ B ≠ C ≠ D
E o sistema E-Z, em que, a letra “E” vêm da palavra alemã entgegen,
significando opostos. E a letra “ Z”, vêm da palavra alemã zusammen, que
significa juntos.
18
E-Z em Compostos Acíclicos:
“ Terá maior prioridade o ligante cujo átomo imediatamente
ligado ao carbono da dupla tiver maior número atômico.
3-metil-pent-2-eno
Ordem de prioridade:
P/ CX: o Etil é o ligante de maior
prioridade, pois o desempate está no
nº atômico do ultimo carbono desse
ligante com o átomo de hidrogênio do
ligante metil.
P/ CY: o Nº Atômico do ligante Metil é
maior o ligante Hidrogênio.
Z-3-metil-pent-2-eno
Mesmo Plano
(Juntos)
E-3-metil-pent-2-eno
Planos Opostos
(separados)
E-Z em Compostos Cíclicos:
ou
Com A ≠ B ≠ C ≠ D
Ex: 1-cloro-1-etil-2-metilciclobutano
Ordem de prioridade:
P/ CX: o Cl=17, C=12 e H=1. O Cloro é o
ligante de maior prioridade, pois o nº
atômico é maior que o ligante carbono;
X
Y
P/ CY: o metil é o ligante de maior
prioridade, pois o nº Atômico do
carbono é maior que o do Hidrogênio.
Z-1-Cloro-1etil-2-metilciclobutano
Mesmo Plano
(Juntos)
E-1-Cloro-1etil-2-metilciclobutano
Planos Opostos
(separados)
II. Quiralidade e Estereoquímica
Quiralidade: É todo objeto que não é sobreponível a sua
imagem especular.
simétricos
Assimétricos
Objeto Quiral: Sua imagem especular não é sobreponível.
Objeto Aquiral: Sua imagem especular é sobreponível.
Estereoquímica: Estuda as estruturas moleculares em três
dimensões.
Estereoisômeros podem ser divididos em:
• Enantiômeros (enantion, grego
oposto) – São
estereoisômeros cujas moléculas são imagem especulares
não sobreponíveis entre si.
• Diastereoisômeros – São estereoisômeros cujas moléculas
não são imagem especulares entre si.
Centro quiral (ou Estereogênicos, ou Assimétrico).
a) Compostos com um carbono assimétrico:
O carbono central é assimétrico
(costuma-se indicar os carbono
assimétrico com asterisco (*)).
Por que a eles estão ligados 4
radicais diferentes.
Centro de quiralidade: são centros cujos carbono
assimétrico possuem geometria tetraédrica (hibridização
do carbono sp³).
O carbono central é assimétrico (costuma-se indicar os carbono
assimétrico com asterisco (*)). Por que a eles estão ligados 4 radicais
diferentes.
ácido 2-hidróxi-propanóico dextrógiro
ou ácido (+) lático
Pto ebulição
52,8ºC
Densidade (g/mL)
1,2485
Rotação específica [α]
+2,6
ácido 2-hidróxi-propanóico levógiro
ou ácido (-) lático
52,8º
1,2485
-2,6
Molécula quiral são opticamente ativas. E estas possuem duas
estruturas possíveis no espaço, denominada de dextrógira e
levógira.
26
Moléculas Aquirais possuem plano de simetria.
Exemplo,
27
28
Criança vítima da Talidomida
29
Aplicações:
Fermentação do leite e do
vinho
Açúcares e Adoçantes:
sacarose: glicose e frutose
Sacarina – após ingerida apresenta sabor
amargo;
Ciclamato de sódio – Produz câncer em ratos
e por isso, foi abolida por muitos países,
apesar de não ter comprovação em seres
humanos;
Aspartame – No organismo sofre hidrolise
produzindo ácido aspártico, fenilalanina e
metanol. A fenilalanina causa danos ao
sistema nervoso.
30
Processos Biológicos - Enzimas
Em moléculas assimétricas somente um dos isômeros ópticos são ativo.
Exemplo,
LSD: Isômero dextrogiro
(causa alucinações), enquanto
que o levogiro não produz
nenhum efeito.
Talidomida: Isômero dextrogiro é um
sedativo, enquanto que o levogiro
causa deformações (ataca o feto e
as crianças nascem sem membros ou
com deformações nestes).
31
Atividade Óptica: consiste na isomeria, cuja única diferença
está no comportamento diante de uma luz polarizada.
Descoberto pelo físico João-Baptista Biot – 1815;
1848→ Luis Pasteur → princípio da estereoquímica
Luz não polarizada:
32
Onda eletromagnética polarizada
Quando um feixe de luz comum passa através de um
polarizador;
O polarizador interage com o campo elétrico da luz;
Após a interação a luz emerge do polarizador
oscilando apenas em um plano:
POLARÍMETRO
• Instrumento com finalidade de medir o efeito de compostos
opticamente ativos sobre a luz plano-polarizada;
• A lente geralmente é constituída de CaCO3 em determinada
forma cristalina, chamado de polaróide → PRISMA DE
NICOL;
33
Representação esquemática de um
polarímetro:
34
As substâncias que giram o plano de polarização são
chamadas de substâncias opticamente ativas, ou seja, tem
atividade óptica. É o caso de b.
As substâncias que vibram num mesmo plano, são chamadas
de opticamente inativa. É o caso da a .
35
+α
-α
Quando a substância é opticamente
ativa, e seu desvio for girado para a
direita, denomina-se de dextrógira (d)
(+).
Quando a substância é opticamente
ativa, e seu desvio for girado para a
esquerda, denomina-se de Levógira ()
(-).
Para uma molécula ser opticamente
ativa, é necessário que ela seja
assimétrica!!
36
A rotação específica [a], pode ser dada pela relação:
[ ]
20º C
D
C.d
Em que,
[α] = rotação específica
α = rotação observada: desvio no plano da luz polarizada (em graus)
d = comprimento do tubo que contém a solução, expresso em
decímetros (dm). 1dm =10cm.
C = concentração da substância (em g/mL)
D = luz utilizada, que é a Sódio
20ºC = temperatura da rotação específica
37
38
MEDIÇÃO:
FATORES QUE INFLUENCIAM
• Concentração da solução;
• Comprimento de onda utilizado na fonte de luz;
• Comprimento do tubo de amostra;
• Temperatura;
• Natureza do solvente.
39
b) Compostos com vários carbonos assimétricos diferentes:
Ácido α-hidróxi-β-metil-succínico
O carbono 2 e 3, são
diferentes entre si. Uma
vez que, os grupos do
carbono 2 não são iguais ao
do carbono 3.
Portanto, este composto
resulta em 4 isômeros
opticamente ativo e distinto
entre si que são:
40
• Os isômeros A e B, como C e D são pares de enantiômeros (possuem
um (d ) e um () em ambos);
•Têm-se 2 misturas racêmicas: A+B e C+D;
• E os isômeros que não são enantiômeros entre si, são chamados de
diastereoisomêros (não são isomeros ópticos), são constituídos entre os
pares A e C; A e D; B e C e C e D.
41
42
Misturas Racêmicas (ou racemato):
• Consiste de uma mistura equimolar dos dois
enantiômeros. Isto é, apresenta a mesma quantidade de
mols (50% de dextrógiro e 50% levógiro);
• Essa mistura não desvia o plano da luz polarizada
(oticamente inativo, por compensação externa);
• Têm propriedades físicas diferentes dos enantiômeros.
Exemplo, (±) butan-2-ol
43
Resumindo,
Quando se tem N carbonos assimétricos diferentes,
calcula-se o numero de isômeros ópticos ativos pela regra
de Van’tHoff, que é:
n
E misturas racêmicas:
Ex:
1 Carbono assimétrico
2 Carbonos assimétrico
2
2
n 1
2 isômeros ativos ( 21=2)
1 isômero inativo (mistura racêmica) 20 = 1
2 isômeros ativos ( 22=4)
2 isômero inativo (mistura racêmica) 21 = 2
44
c) Compostos com carbonos assimétricos iguais:
O carbono 2 e 3, são iguais
entre si. Uma vez que,
ambos estão ligados aos
mesmos grupos. E existem
os três isômeros: levogiro e
dextrogiro, e agora, o meso.
Ácido Tartárico (ácido di-hidróxi-succínico)
Plano de simetria
Meso isômero: significa
“meio”. A molécula não
desvia o plano da luz
polarizada
(é
opticamente inativo por
compensação
interna).
Portanto
é
um
diasteroisômero.
45
Possuem dois ou mais carbonos assimétricos e um plano de
simetria
46
47
Isomeria Óptica sem carbono assimétrico
Há dois casos importantes de moléculas que são
assimétricas mesmo não possuindo carbono assimétrico,
que são:
a) Compostos Alênicos: consiste em compostos de
alcadienos acumulados, ou seja, são aqueles que possuem
duas ligações duplas seguidas.
Esta molécula não é superponível
Não tem um plano de simetria,
mas apresenta dois isomeros o
dextrogiro e o levogiro.
2,3-pentadieno
48
b) Compostos Ciclícos
Quando um compostos de cadeia carbônica cíclica
apresenta isomeria geométrica, a molécula do isômero
trans é assimétrica, isto é, não apresenta plano de
simetria
e
portanto
possui
atividade
óptica,
apresentando dois isômeros, o dextrogiro e o levogiro e
uma mistura racêmica.
Exemplo, 1,2-dicloro-ciclo-propano
49
Nomenclatura de Enantiômeros: Sistema R, S ou
Sistema Cahn-Ingold-Prelog
1. Classifique os grupos ligados ao carbono assimétrico
1
4
2
3
2. Se o grupo (ou átomo) de menor prioridade está ligado
com uma cunha tracejada,
50
3. Se necessário, gire a molécula para que o grupo (ou
átomo) de menor prioridade esteja ligado com uma cunha
tracejada
4. Pode-se desenhar a seta do grupo 1 para o grupo 2,
passando pelo grupo de menor prioridade (4), mas nunca
passando pelo grupo de menor prioridade (3).
(R)-1-Bromo-pentan-3-ol
51
52
Outras Designações da Estereoquímica – (D e L por
exemplo).
53
Atenção: A partir da projeção de Fischer, considerar a
hidroxila ligado ao carbono quiral mais afastado da função
carbonila.
Quando a hidroxila estiver a direita, o enantiômero é D
Quando a hidroxila estiver a esquerda, o enantiômero é L
54
AMINOÁCIDOS
Se o grupo NH2 estiver a esquerda: aminoácido L
Se o grupo NH2 estiver a direita: aminoácido D
55