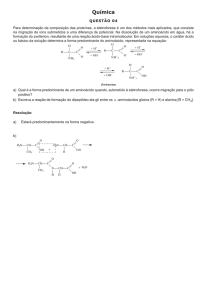
Sistema Tampão
Efeito de pH na Atividade Enzimática
Sistema Tampão
- Ionização da Água
- Definição de ácidos fortes e ácidos fracos
- Equação de Henderson-Hasselbalch
- Definição de sistema tampão
- Curvas de Titulação
• Conformação de
Macromoléculas
Importância do
Equilíbrio
Ácido-Base
• Mecanismos de Ação e
Toxicidade de Fármacos
• Patologias
Distúrbios Ácido-Base
Acidose
Alcalose
Metabólica
Respiratória
Acidose Respiratória:
Hipoventilação dos alvéolos
Acúmulo de CO2
CO2 + H2O H2CO3 H+ + HCO3Aguda
Crônica
Obstrução das vias respiratórias
Pacientes com Obstrução Alveolar
Desordens neuromusculares
(Enfisema Pulmonar)
Doenças do SNC
Inalação de [CO2]
Alcalose Respiratória:
Hiperventilação dos alvéolos
Ansiedade
SNC
Envenenamento
Febre
Ventilação Artificial
altitude = Pressão Atmosférica = P CO alveolar
2
Acidose Metabólica
• ingestão de ácidos orgânicos não-voláteis
• eliminação excessiva de bases (diarréia severa)
• produção de ácidos metabólicos em excesso
Alcalose Metabólica
• ingestão de excesso de bases (mais comum:
bicarbonato de sódio)
• eliminação excessiva de ácidos (vômito prolongado;
lavagem estomacal)
pH
"pondus hydrogenii“ ou potencial de hidrogênio
“o poder do hidrogênio em causar a acidez de uma
solução”.
NÃO É PH ou Ph!!!!
A função “p” é usada para indicar a concentração de
outros íons, como em pCa, que dá a concentração de
íons cálcio na solução.
pH –
+
log[H ]
A água sofre ionização:
H2O
H+ + OH-
E a ionização? É de 50%? 100%? 1%?
H2O H+ + OH-
pH = -log[H+]
pOH = -log[OH-]
Água Pura: pH = 7,0
ácido
base
neutro
Uma pequena parte da água está ionizada:
Apenas uma em cada 107 moléculas de água pura
está ionizada
H2O
H+ + OH-
[H+][OH-]
Keq =
(1)
(2)
[H2O]
A 25 oC, a concentração de água é cerca de 55,5 M.
[H+][OH-]
Keq =
(2)
[H2O]
Podemos substituir a concentração de água na equação 2:
[H+][OH-]
Keq =
(3)
55,5 M
A eq. 3 pode ser re-escrita como:
(55,5 M) (Keq) = [H+][OH-]
O produto da constante de equilíbrio e da concentração de água é
chamado de produto iônico da água ou Kw:
(55,5 M).(Keq) = Kw
Keq foi determinada pela condutividade elétrica da água.
Nesse tipo de medida, apenas os íons em solução (no caso, a água dissociada) são
capazes de conduzir corrente elétrica.
Keq = 1,8 x 10-16 M a 25oC (para a água pura)
Kw = (55,5 M).(Keq) = 55,5 M . 1,8 x 10-16 M = 99,9 x 10-16 M
[H+][OH-]
Keq =
(3)
55,5 M
Substituindo, na eq. 3:
99,9 x 10-16 M2 = [H+][OH-]
~100 x 10-16 M2 = 1 x 10-14 M2
99,9 x 10-16 M2 = [H+][OH-]
ou:
1,0 x 10-14 M2 = [H+][OH-] = Kw
(4)
O produto [H+]·[OH-] será sempre igual a 1.10-14 M2 (25 °C)!
O produto [H+]·[OH-] será sempre igual a 1.10-14 M2 (25 °C)!
Na água pura, em pH 7, as concentrações de H+ e de OHsão exatamente iguais, então...
Kw = [H+] ·[OH-] = [H+]2 = 10-14 M2
então, [H+] = 10-7 M
ou Kw = [H+] ·[OH-] = [OH-]2 = 10-14 M2
e [OH-] = 10-7 M
Como pH = -log [H+] , na água pura:
pH = - log(10-7)
ou... pH = 7
De forma análoga, pOH = -log [OH-] , na água pura:
pOH = - log(10-7)
ou... pH = 7
Se adicionarmos H+ ou OH- à agua, o pH varia!
Então... como podemos controlar o pH de uma solução?
- o sistema biológico utiliza compostos com
capacidade tamponante (sistema tampão).
- os compostos que atuam como tampões biológicos
têm a capacidade de absorver os íons H+ ou OH-,
mantendo constante o pH do meio.
O que é um ácido forte?
E o que é um ácido fraco?
Ácido Forte:
Totalmente ionizado, quando em solução aquosa.
HCl + H2O → H3O+ + Cl-
Ácido Fraco:
Parcialmente ionizado, quando em solução aquosa.
Ionização de ácido fraco:
HA + H2O
ácido + base
H3O+ + A-
(7)
ácido conjugado + base conjugada
da base
do ácido
Podemos definir uma constante de ionização (K):
K=
[H3O+] [A-]
[HA][H2O]
(8)
K=
K.[H2O] =
[H3 O+ ] [A-]
[HA]
[H3O+] [A-]
[HA][H2O]
ou
[H+] = Ka .
(8)
Ka =
[H +]
[A-]
[HA]
[HA]
[A-]
(10)
(9)
[H+]
= Ka .
[HA]
(10)
[A-]
Multiplicando a equação por (-log):
pH = -log Ka - log
[HA]
(11)
[A-]
Em uma analogia à definição de pH, podemos definir
que -log Ka é o pKa:
pH = pKa - log
[HA]
[A-]
(12)
Equação de Henderson-Hasselbalch
pH = pKa - log
[HA]
(12)
[A-]
ou:
-]
[A
pH = pKa + log
[HA]
(12a)
-]
[A
pH = pKa + log
[HA]
(12a)
Quando [A-] = [HA]:
pH = pKa
“Traduzindo”: No pH que corresponde ao pKa de um
ácido fraco, temos exatamente a mesma quantidade
de ácido (forma protonada, HA) e de base conjugada
(forma desprotonada, A-).
Como atua um Tampão?
Ionização de ácido fraco:
HA + H2O
ácido + base
H3O+ + A-
ácido conjugado + base conjugada
da base
do ácido
(7)
HAc ↔
No pH = pKa:
Ac-
+
H+
20
20
x
+1 H+:
21
19
x
+1 H+:
22
18
x
+10 H+:
31
9
x
+9 H+:
40
0
x
10
9
8
Ponto Inicial (pH = pKa)
Adição de H+
7
Exemplo para
um ácido fraco
com pKa = 5
pH
6
5
4
3
2
1
0
-
[OH ]
Obs: o gráfico completo será
mostrado depois da adição de OH-
HAc ↔
No pH = pKa:
Ac-
+
H+
20
20
x
-1 H+:
19
21
x
-1 H+:
18
22
x
-10 H+:
9
31
x
-9 H+:
0
40
x
10
9
8
Ponto Inicial (pH = pKa)
Adição de OH-
Exemplo para
um ácido fraco
com pKa = 5
7
pH
6
5
4
3
2
1
0
-
[OH ]
Obs: o gráfico completo será
mostrado depois da adição de OH-
Curva de titulação considerando um equilíbrio linear
10
9
8
Ponto Inicial (pH = pKa)
Adição de H+
Adição de OH-
7
pH
6
5
4
3
2
1
0
-
[OH ]
A linha preta representa a curva de titulação mais
próxima à real, já que o equilíbrio não é linear:
10
9
8
7
pH
6
5
4
3
2
1
0
-30
-20
-10
0
10
20
30
-
[OH ]
Ou seja, um bom tampão pode ser formado
por um ácido fraco desde que o pH de
utilização seja próximo ao pKa do mesmo!
Efeito do pH na Atividade Enzimática:
Calorimetric Reaction Rate (µcal/s)
Fosfatase alcalina
2
1
Asparaginase
0
2
4
6
8
pH
10
12
Enzyme Optimum
Lipase (pancreas)
Lipase (stomach)
Lipase (castor oil)
Pepsin
Trypsin
Urease
Invertase
Maltase
Amylase (pancreas)
Amylase (malt)
Catalase
pH
8.0
4.0 - 5.0
4.7
1.5 - 1.6
7.8 - 8.7
7.0
4.5
6.1 - 6.8
6.7 - 7.0
4.6 - 5.2
7.0