Introdução à
Eletroquímica
1. Gentil V. Corrosão. 3 edição.
2. Cotton F. A. e Wilkinson G. Basic Inorganic Chemistry, John
Wiley & Son, USA, 1976.
INTRODUÇÃO
Eletroquímica: estuda as relações entre efeitos
elétricos e químicos.
Um grande parte deste campo estuda as mudanças
químicas causadas pela passagem de corrente e a
produção de energia elétrica a partir de reações
químicas.
Fenômenos (corrosão, etc.)
Eletroquímica
Dispositivos (baterias, etc. )
Tecnologias (produção de metais)
Os Princípios Básicos se aplicam a todos
INTRODUÇÃO
Os
conhecimentos
de
eletroquímica
básicos
envolvem principalmente os seguintes aspectos:
Reações de Oxidação-Redução
Potencial de eletrodos
Pilhas
Vamos estudar cada um deles detalhadamente.
CONCEITOS BÁSICOS
Oxidação-redução
1. Conceito Antigo
Oxidação
é
o
ganho
de
oxigênio
por
uma
substância e redução é a retirada de oxigênio de
uma substância.
Exemplos:
2 Fe + O2 + Calor 2 FeO
4 Al + O2 + Calor 2 Al2O3
C + O2 + Calor CO2
2 CO + O2 + Calor 2 CO2
Fe2O3+ 3 C + Calor 2 Fe + 3 CO
CONCEITOS BÁSICOS
Oxidação-redução
2. Em Termos de Elétrons
Oxidação é a perda de elétrons por uma espécie
química e redução é o ganho de elétrons por uma
espécie química.
Exemplos:
Fe Fe+2 + 2 eCl2 + 2 e- 2 Cl-
CONCEITOS BÁSICOS
Oxidação-redução
3. Em Termos de Número de Oxidação
Oxidação é o número algébrico do número de
oxidação.
Redução é a diminuição algébrica do número de
oxidação
Oxidação
Número
de
oxidação
...
-3
-2
-1
0
Redução
1
2
3
...
CONCEITOS BÁSICOS
Oxidação-redução
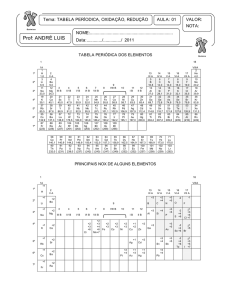
3.1 Regra para determinar o Número de Oxidação
I) O número de oxidação de um elemento em uma
substância simples é zero
N2, Cl2, O2, Fe, Na, Al ... têm número de oxidação zero
quando no estado livre ou elementar
CONCEITOS BÁSICOS
Oxidação-redução
3.1 Regra para determinar o Número de Oxidação
II) O número de oxidação de um elemento está
entre N e N-8 onde N representa o grupo em que o
elemento está colocado na classificação periódica
dos elementos. Os valores mais prováveis são ou o
mais baixo ou o mais elevado.
CONCEITOS BÁSICOS
Oxidação-redução
3.1 Regra para determinar o Número de Oxidação
III) O número de oxidação do hidrogênio é, em
geral, +1, exceto nos hidretos iônicos onde é -1
(NaH, CaH, etc.)
IV) O número de oxidação do oxigênio é, em geral,
-2, exceto: nos peróxidos (Na2O2, H2O2, etc.); no
fluoreto de oxigênio onde é +2 (OF2); e nos
superóxidos ou hiperóxidos, onde é -½
CONCEITOS BÁSICOS
Oxidação-redução
3.1 Regra para determinar o Número de Oxidação
V) O número de oxidação do flúor é sempre -1.
VI) Os halogênios cloro, bromo e iodo tem número
de oxidação -1 em todos seus compostos binários
exceto: nos oxigenados (Cl2O, I2O5, etc.), nos
compostos inter-halogênios (ICl, ICl3, etc.)e nos.
compostos
ternários
onde
seus
oxidação podem variar de +1 a +7
números
de
CONCEITOS BÁSICOS
Oxidação-redução
3.1 Regra para determinar o Número de Oxidação
VII) Em seus compostos, os metais, sempre tem
números de oxidação positivos.
Para os metais alcalinos (Na, K, Rb, Cs, Li) é +1.
Para os alcalinos terrosos (Ca, Ba, Sr) e para o Be
e Mg é +2.
Para o Al é +3.
CONCEITOS BÁSICOS
Oxidação-redução
3.1 Regra para determinar o Número de Oxidação
VIII) Quando dois não metais se combinam, o
mais
eletronegativo
tem
número
de
oxidação
negativo e o mais eletropositivo tem número de
oxidação positivo (exemplos: CH4, PCl5 , SO2, etc.).
Composto
CH4
PCl5
SO2
No de oxidação dos elementos
C
H
-4
+1
P
Cl
+5
-1
S
O
+4
-2
CONCEITOS BÁSICOS
Oxidação-redução
3.1 Regra para determinar o Número de Oxidação
VIII) Em um composto ou em um íon, entende-se
por número de oxidação total de um elemento o
seu número de oxidação multiplicado pelo número
de átomos com que o elemento participa na
fórmula do composto ou íon.
IX) Em um composto, a soma algébrica dos
números de oxidação totais de seus elementos
constituintes é zero.
CONCEITOS BÁSICOS
Oxidação-redução
3.1 Regra para determinar o Número de Oxidação
X) Em um íon, a soma algébrica dos números de
oxidação totais de seus elementos constituintes é
igual á carga do íon.
CONCEITOS BÁSICOS
Oxidação-redução
3.1 Regra para determinar o Número de Oxidação
XI)
Quando
o
composto
apresentar
diversos
átomos de um mesmo elemento, deve-se levar em
consideração,
para
determinar
o
número
de
oxidação, a estrutura do composto (podendo-se
utilizar um número de oxidação médio).
Exemplo:
No Fe3O4 tem-se que o número de oxidação médio é 8/3 pois
sua estrutura é Fe2O3.FeO. No Fe2O3 o número de oxidação
total é 2 x (+3) = +6. No FeO é +2. Assim o total é +8. Como
há 3 átomos temos: 8/3
CONCEITOS BÁSICOS
Oxidação-redução
4. Comparação dos conceitos 1, 2 e 3
Observemos a reação de combustão do magnésio,
representada pela equação química:
2 Mg + O2 2 MgO
Os
elementos
que
participam
desta
equação
passam aos íons correspondentes, de acordo com
as equações:
Mg Mg+2 +2e½ O2 + 2e- O2-
Os números de oxidação variaram: Mg de 0 para
+2 e o O de 0 para -2
CONCEITOS BÁSICOS
Oxidação-redução
4. Comparação dos conceitos 1, 2 e 3
O magnésio que se oxidou é o agente redutor.
O oxigênio que se reduziu é o agente oxidante.
Em ambos os casos se aplicam os três conceitos (1
2 e 3)
Pode acontecer que na reação não aconteça nem
troca de elétrons nem a participação do oxigênio:
H2(g) + Cl2(g) 2HCl(g)
Neste caso só se aplica o conceito 3 (o mais geral)
CONCEITOS BÁSICOS
Oxidação-redução
4. Comparação dos conceitos 1, 2 e 3
Os
metais,
no
estado
elementar,
têm,
mais
frequentemente, de um a três elétrons no último
nível energético e ao reagir têm tendência a
perder estes elétrons, oxidando-se e portanto
agem como redutores. Por exemplo:
Na Na1+ + 1 eZn Zn2+ + 2 eAl Al3+ + 3 e-
M Mn+ + n e-
CONCEITOS BÁSICOS
Oxidação-redução
5. Reações Redox
São reações onde há variação do número de
oxidação.
Os
fenômenos
de
oxirredução
simultâneos!
Exemplo do ácido clorídrico e ferro:
Fe + 2 HCl FeCl2 + H2
2 H+ + 2 e- H2
Fe Fe2+ + 2 e-
Equação iônica
Fe + 2 H+ Fe2+ + H2
são
CONCEITOS BÁSICOS
Oxidação-redução
5. Reações Redox
Quais são os elementos redutores e oxidantes nas
seguintes reações:
a) 2 Fe + O2 2 FeO
d) Fe + 2 HCl FeCl2 + H2
b) 4 Al + O2 2 Al2O3
e) Fe + 6 HNO3 Fe(NO3)3 + 3NO2 + 3H2O
c) 2 Mg+ O2 2 MgO
f) 2 Al + 3 S Al2S3
Equação
Agente
redutor
Elemento
redutor
Agente
oxidante
Elemento
oxidante
a)
Fe
Fe
O2
O
b)
Al
Al
O2
O
c)
Mg
Mg
O2
O
d)
Fe
Fe
HCl
H+
e)
Fe
Fe
HNO3
N (+5)
f)
Al
Al
S
S
CONCEITOS BÁSICOS
Oxidação-redução
5. Reações Redox
Mecanismos das Reações Redox
Geralmente são por transferência de elétrons
Mg + H2SO4 MgSO4 + H2
Nesta equação
parciais:
tem-se
as
equações
2 H+ + 2 e- H2
Mg Mg2+ + 2 e-
Mg + 2 H+ Mg2+ + H2
Experiências com Mg e Cu
iônicas
CONCEITOS BÁSICOS
Oxidação-redução
5. Reações Redox
Equações iônicas de Redução e de Oxidação
Nos processos associados à transferência de elétrons, as
duas equações iônicas devem ser combinadas para que não
sobrem elétrons.
Tabela
CONCEITOS BÁSICOS
Oxidação-redução
5. Reações Redox
Equações iônicas de Redução e de Oxidação
a)
Um metal em H2SO4 ou HCl (diluídas)
O metal sofre ataque
corrosivo segundo:
Se o metal for Zn,
Fe ou Al teremos
2 H+ + 2 e- H2
Zn + 2 H+ M2+ + H2
M Mn+ + n e-
Fe + 2 H+ M2+ + H2
M + n H+ Mn+ + n/2 H2
Al + 3 H+ Al3+ + 3/2 H2
No caso do ácido sulfúrico se formam os sulfatos dos
metais: ZnSO4, FeSO4, Al2(SO4)3
No caso do ácido clorídrico se formam os cloretos dos
metais: ZnCl2, FeCl2, AlCl3
b) Um metal imerso em solução de ácido oxigenado com um
íon oxidante como o HNO3
Neste caso não teremos H2, ocorrendo a oxidação do metal
e a redução da parte iónica, NO3-do ácido.
Zn Zn2+ + 2 e-
Assim no caso do Zn
-
NO3 + 2 H+ + 1 e- NO2 +H2O
-
Zn + 2 NO3 + 4H+ Zn2+ + 2 NO2 + 2 H2O
Ou na forma molecular
Zn + 4 HNO3 Zn(NO3)2 + 2 NO2 + 2 H2O
No caso do Cu, não é atacado pelo acido sulfúrico diluído,
mas no caso concentrado há uma reação de oxirredução
agindo a parte aniônica, o SO42-, como oxidante.
Cu + 2 H2SO4 CuSO4 + SO2 + 2 H2O
Onde teremos:
a redução da parte aniônica SO42- SO42- + 4 H+ + 2 e- SO2 +2 H2O
a oxidação do Cu
Cu Cu2+ + 2 e2-
Cu + SO4
+ 4H+ Cu2+ + SO2 + 2 H2O
c) Um metal M sob a ação do oxigênio provoca, em geral, a
formação dos óxidos de acordo com as reações obtidas da
Tabela
½ O2 + 2 e- O2M Mn+ + n e2M + n/2 O2 M2On
E no caso do Zn, Fe e Al os valores de
respectivamente 2, 2 e 3, tendo-se os
correspondentes ZnO, FeO e Al2O3
n são
óxidos
d) Um metal M sob a ação da água e oxigênio provoca, em
geral, a formação de hidróxidos. De acordo com as reações
obtidas da Tabela, tem-se
Fe Fe2+ + 2 e-
2 H2O + O2 + 4 e- 4 OH
2 Fe + 2 H2O + O2 2 Fe(OH)2