-REGENERAÇÃO, CICATRIZAÇÃO E FIBROSE-
MINEERO
INTRODUÇÃO LEGAL
No estado normal de homeostasia existe um equilibrio entre a proliferação e a apoptose.Quando um agente
lesivo danifica o tecido, o hospedeiro responde com eventos para 1-eliminar o agente, 2-conter o dano e 3preparar as células sobreviventes para a replicação.
O REPARO consiste na habilidade do corpo em substituir células lesadas/mortas e reconstituir o tecido após a
inflamação; pode ser dividido em regeneração e cicatrização.
A regeneração refere-se ao crescimento de células para substituir estruturas e restituir o tecido perdido,
como ocorre na nefrectomia unilateral e na hepatectomia parcial que são,na verdade, crescimentos
compensatórios ao invés de regeneração. Os tecidos com alta capacidade proliferativa, como o sistema
hematopoiético e os epitélios de revestimento tem alta capacidade regenerativa, desde que as suas células
tronco não sejam destruídas.
A cicatrização é uma resposta tecidual a um ferimento ou a um processo inflamatório; apesar de poder
restaurar as estruturas originais, a cicatrização envolve a deposição aberrante de colágeno e consequente
formação de cicatriz. A aterosclerose, por exemplo, é uma tentativa de cicatrização da lesão existente na
parede arterial, caracterizada pela regeneração e deposição de tecido fibroso(formação cicatricial). Assim
como a aterosclerose, o infarto miocárdico também é seguido de um processo cicatricial caracterizado pela
substituição do tecido muscular original por fibras colágenas. A condição inflamatória das formações
mesoteliais(pleura, peritônio e pericardio), também cicatrizam por deposição de tecido fibroso espesso,
criando aderências entre os folhetos viceral e parietal que podem desencadear uma pericardite constritiva; a
inflamação crônica persistente das mucosas(estômago infectado por H. pilori), a cirrose hepática e doença
pulmonar induzida por carvão e sílica também cursam com substituição gradual do infiltrado inflamatório por
fibrose extensiva. Contrariamente aos casos anteriores, os ferimentos SUPERFICIAIS, como um ferimento que
apenas danifica o epitélio, pode cicatrizar por regeneração epitelial.
O estado de preservação da matriz extra-celular interfere nos processos de regeneração e cicatrização, uma
vez que a arquitetura íntegra da matriz mantém a polaridade celular necessária à remontagem das camadas
teciduais, além de fornecer a estrutura de migração celular e os agentes(fibroblastos, macrófagos, etc)
críticos à reparação tecidual. A regeneração necessita que a arquitetura do tecido da matriz extracelular se
mantenha íntegra.A aplicação maciça de CCl4 em uma única dose mata mais que 50% dos hepatócitos, um tipo
de lesão seguida de completa regeneração do parênquima, uma vez que a arquitetura das fibras reticulares que
constituem os lóbulos hepáticos NÃO são danificadas.A formação de cicatriz ocorre nos casos em que a
estrutura da matriz extra-celular é danificada. A lesão decorrente de aplicações multiplas e graduais de
químicos em pequenas doses rompem a matriz extra-celular, processo seguido pelo reparo por fibrose.
MECANISMOS REGULADORES DAS POPULAÇÕES CELULARES
Nos tecidos adultos o tamanho da população celular é determinado pelos níveis de proliferação, diferenciação,
apoptose e neo-formação por células tronco; níveis alterados em qualquer um desses processos pode
desencadear aumento ou diminuição do número celular.
>A proliferação celular é controlada por sinalizadores(solúveis ou contato-dependente) de ativação ou inibição;
esses sinais induzem o crescimento por meio do encurtamento do ciclo celular, recrutamento e conversão de
células quiescentes em células proliferativas.
Os tecidos são caracterizados de acordo com seu estado de proliferação. Os tecidos de divisão contínua(ou
lábeis), representados pelo epitélio de revestimento e pelo tecido hematopoiético (medula óssea) proliferam
por toda a vida para substituir as células destruídas, sendo que existe um equilíbrio homeostático entre
proliferação e apoptose; nesses tecidos, as células maduras são terminalmente diferenciadas, de vida curta e
incapazes de replicação, mas elas são normalmente substituídas por novas células basais oriundas das célulastronco(apresentam uma capacidade ilimitada de proliferação). Os tecidos quiescentes(estáveis-estado Go),
representados pelo fígado e rins, células parenquimatosas(fibroblastos, m. liso, endotélio, condrócitos,
osteócitos) têm baixo nível de replicação, mas podem eventualmente entrar em divisão rápida(passam para
G1),em resposta aos estímulos, a fim de reconstituir o tecido de origem. Os tecidos não
divisores(permanentes), representados pelos cardiomiócitos, m. esquelético e neurônios, contem células
terminais diferenciadas(estão num estágio final de diferenciação e NÃO são capazes de replicação por divisão
mitótica na vida pós-natal.Se os neurônios são destruídos, eles são substituídos pelas células gliais(elementos
sustentadores do SNC); embora essas células maduras não se dividam, elas tem sim uma pequena capacidade
regenerativa;a m. esquelética (por meio das células satélites ligadas à bainha endomisial, por superposição das
bainhas terminais da musculatura).
As células tronco são caracterizadas por capacidade prolongada de renovação e por sua replicação
assimétrica(dentro de um grupo de células tronco, algumas se auto-replicam e outras se diferenciam); elas se
aglomeram em locais denominados nichos, que variam de tecido para tecido(ex. istmo das glândulas estomacais
e bases das criptas do cólon, bulbo do folículo piloso, limbo da córnea). Elas podem ser
pluripotentes(presentes nos embriões -chamadas de células tronco embrionárias-e em outros tecidos),
quando tem a capacidade de se diferenciar em todos os tecidos celulares, provavelmente devido a presença de
fatores de transcrição únicos(ex. proteína homeobox Nanog ou Wnt-B catenina que mantêm a pluripotência). As
células tronco embrionárias são aplicadas no estudo de vias de sinalização, na produção de camundongos
Knockout(células tronco embrionárias contendo gene de interesse inativado são injetadas nos blastocistos e
implantados no útero), repopular órgãos danificados utilizando as celulas do mesmo paciente para evitar
rejeição por meio da clonagem terapêutica(o núcleo 2n de uma célula adulta é transferido para um oócito cujo
núcleo foi retirado. Em seguida o oócito é ativado, originando um zigoto que se divide para formar um
blastocisto com DNA do doador; a partir desse blastocisto são obtidas as células tronco embrionárias).Elas
também podem ser células tronco adultas, presentes como 1-reservatórios na medula óssea e 2-em vários
tecidos(células tronco teciduais), detentoras de capacidade de diferenciação restrita, sendo de linhagens
específicas.1-A medula óssea contem células tronco hematopoiéticas(geram todas as células sanguíneas,
neurônios, hepatócitos, miócitos, bem como a própria medula óssea) e células estromais(geram células como
os condrócitos, osteoblastos, adipócitos, mioblastos e precursores de células endoteliais) capazes de
diferenciação em várias linhagens; elas podem ser obtidas do sangue circulante após estimulação com
citocinas(GM-CSF). As células tronco hematopoiéticas tem a capacidade de não apenas substituir células de
tecidos lesados, mas também produzir citocinas e fatores de crescimento a fim de atuar nas células teciduais.
Além disso, essas células tronco tem a capacidade de fundir com as células do hospedeiro e transferir material
genético a elas, ocasionando a geração de novas células. A medula óssea, cérebro, músculo, pele também
podem albergar uma população heterogênea de células-tronco presumivelmente derivadas das células tronco
hematopoiéticas, denominadas células adultas progenitoras multipotentes(MAPC-1), que se diferenciam em tipos
celulares mesodérmicos, endodérmicos e neuroectodérmicos.2-As células tronco teciduais, apesar de linhagem
específicas, podem se comprometer com outras linhagens se forem transplantadas em tecidos diferentes. O
fígado possui células tronco denominadas células ovais que estão localizadas ao longo dos canais de Hering e
são progenitores bipotenciais(diferenciam-se em hepatócitos e células biliares); essas células funcionam como
compartimento reserva, sendo ativadas apenas em caso de bloqueio proliferativo de hepatócitos(não são
ativadas nos casos de regeneração após hepatectomia parcial e lesões necrosantes, sendo que os próprios
hepatócitos são responsáveis pelo processo), como ocorre na insuficiência hepática fulminante, hepatite
crônica, cirrose avançada e na carcinogênese.O cérebro possui áreas específicas de neurogênese contendo
células tronco neurais marcadas por meio de nestina(biomarcador) no hipocampo e bulbo olfatório.
Contrariamente aos hepatócitos, os miócitos do m. esquelético NÃO se replicam mesmo após lesão, de maneira
que a repopulação tecidual é feita por células tronco satélites, que também tem propriedades adipogênica e
osteogênica.O epitélio se auto-renova por meio do aumento do número de células tronco ativadas, aumento do
numero de replicações no compartimento de amplificação(composto por células intermediarias proliferativas)
e encurtamento no tempo do ciclo celular.
Transdiferenciação: É o processo pelo qual uma célula já diferenciada sofre uma transgressão e torna-se um
outro tipo de célula, células do fígado se transdiferenciando em células β secretoras de insulina.
Plasticidade evolutiva(multiplicidade das opções de diferenciação de uma célula tronco)
Para que as células estromais da medula óssea comprometam-se com uma linhagem específica, faz-se
necessário a participação de fatores de crescimento e componentes da matriz que ativem proteínas
regulatórias chave; os miotubos(fomadores de tecido muscular requerem mioD e miogenina), adipócitos(PPARy), da linhagem osteogênica(CBFA1), cartilagem(Sox9), endotélio(VEGF e FGF-2). O EGF (FC epidérmico) e o TGFa(FC transformador alfa) presentes nas plaquetas, macrófagos, e fluidos(suor, saliva, urina, leite, plasma) são
mitogênicos para queratinócitos, hepatócitos, e fibroblastos, e estimulam a formação de tecido de granulação;
ambos se ligam a receptores EGF(EGFR1 e EGFR2) munidos de atividade tirosina cinase, que estão envolvidos no
câncer de mama. O HGF(FC hepatócitos) expresso em células mesenquimatosas é responsável pelo aumento da
motilidade e migração celular(principalmente no período embrionário), sendo também mitogênico para
hepatócitos, epitélios e endotélio; se liga ao receptor c-MET. O VEGF(FC do endotélio vascular), é uma família
composta pelos VEGF A, B, C, D e FC placentário e causa aumento da permeabilidade vascular,
vasculogênese(formação de vasos sanguíneos no inicio do desenvolvimento via VEGFR2),
angiogênese(crescimento de novos vasos sanguíneos em adultos via VEGFR2) em caso de tumor, inflamação
crônica ou cicatrização, linfangiogênese(via VEGFR3), manutenção da função cardíaca(via VEGFR-1), mitose de
endotélio.O PDGF(FC derivado de plaquetas) é uma família constituída de 5 isoformas(AA, AB, BB, C e D)
expressas em plaquetas, macrófagos, endotélio, queratinócitos, m. liso e tem a função de promover a
quimiotaxia e ativação de polimorfonucleares, macrófagos, fibroblastos e m.liso, estimular a produção de
metaloproteinases, fibronectina e ac. hialurônico, estimular angiogênese, contração e remodelação da ferida,
inibir a agregação plaquetária, regular a expressão da integrina. O FGF (FC de fibroblastos) expresso em
macrófagos, mastócitos, linfócitos T, endotélio, fibroblastos tem a função de promover quimiotaxia e migração
de fibroblastos, macrófagos, endotélio e epitélio, mitose de fibroblastos e queratinócitos, angiogenese,
contração da ferida e deposição de matriz, desenvolvimento do m. esquelético(induzem a proliferação de
mioblastos) e maturação pulmonar, hematopoiese( desenvolvimento de linhagens sanguíneas e do estroma da
medula óssea); FGF liberado se associa ao heparan sulfato(promove o armazenamento de fatores inativos). O
TGF-B(FC transformador beta) é expresso em plaquetas, linfócitos T, macrófagos, endotélio, queratinócitos, m.
liso, fibroblastos e realiza a quimiotaxia de polimorfonucleares, m. liso, macrófagos, linfócitos e
fibroblastos(intensifica a síntese de colageno, fibronectina, proteoglicanos), estimula a síntese do TIMP, a
migração de queratinócitos, a angiogênese e fibroplasia, inibe a produção de metaloproteinases(diminuindo a
quebra de colágeno e a proliferação de queratinócitos, regula a expressão de integrinas e citocinas, têm efeito
antiinflamatório, induz a produção de mais TGF-B. O TGF-B liga-se a 2 receptores de superfície com atividade
serina/treonina e deflagra a forforilação dos fatores de transcrição Smads que ativam ou inibem a transcrição
gênica; ele bloqueia o ciclo celular pelo aumento da expressão de inibidores Cip/Kip e INK4/ARF.
MECANISMOS DE REGENERAÇÃO
A maioria dos processos referidos como regeneração são, na verdade, processos de crescimento
compensatório que envolvem a hipertrofia e hiperplasia, responsáveis por restaurar a capacidade funcional de
um órgão sem reconstituir sua estrutura original; essa regeneração inadequada tem sido atribuída à resposta
fibroproliferativa e à formação de cicatriz após ferimento. A restauração da massa hepática, após
hepatectomia parcial, por exemplo, envolve inicialmente a fase de preparação, na qual diversas citocinas(TNF,
IL-6) são secretadas a fim de estimular a reativação do ciclo celular em hepatócitos quiescentes estacionados
em Go e ativar metaloproteinases a fim de ocasionar a liberação dos fatores de crescimento da matriz; nessa
fase mais de 70 genes (c-FOS e c-JUN que se polimerizam para formar o fator de transcrição AP-1; c-MYC que
ativa vários fatores de transcrição como NFkB, STAT3, C/EBP) são ativados na chamada resposta gênica
imediata inicial. Em seguida se inicia a fase de proliferação, na qual diversos fatores de crescimento(TGF-a
HGF), juntamente com auxiliares(norepinefrina, insulina, hormônio da tireóide, GH) estimulam a progressão do
ciclo celular de G1 para S e a passagem de S para G2; a replicação dos hepatócitos é seguida pela replicação
das células não-parenquimatosas(células de Kupffer, endotélio, células estreladas); as celulas tronco NÃO
participam do crescimento compensatório após hepatectomia parcial, a não ser para a regeneração do
endotélio. Nesse processo a restauração hepática é obtida sem o novo crescimento dos lobos que foram
retirados. Ao invés disso, ocorre crescimento compensatório dos lobos remanescentes até que a massa
funcional, e NÃO a forma do órgão, seja restituída.Em seguida ocorre a fase de inibição de crescimento,
mediada pelo TGF-B e activina que aumentam a expressão de inibidores do ciclo celular, e diminuem a síntese de
fatores de crescimento e a demanda metabólica.
MATRIZ EXTRACELULAR E SEUS COMPONENTES
A matriz extracelular é secretada localmente e agrupa-se nos espaços em torna das células, formando uma
porção significativa do volume de qualquer tecido. As proteínas da matriz seqüestram água(fornece a turgência
dos tecidos moles e minerais que dão rigidez ao tecido esquelético), atuam como reservatório de fatores de
crescimento(controlando a proliferação e a diferenciação celular), fornece um substrato para adesão,
migração e proliferação celular(modulando a morfofisiologia celular); a síntese e degradação da matriz
acompanham a morfogênese, a cicatrização de ferimentos, a deposição crônica de tecido fibrótico, a invasão
tumoral e as metástases. A matriz é constituída por 3 grupos de macromoléculas, a saber, 1-proteínas
estruturais fibrosas(colágeno e elastina), 2-glicoproteínas adesivas, 3-proteoglicanas e ác. Hialurônico. Essas
macromoléculas, localizadas nas junções intercelulares e superfícies celulares, podem se agrupar para formar
a matriz intersticial (colágeno fibrilar e não fibrilar, elastina, fibronectina, proteoglicanas, ác. Hialurônico) ou a
membrana basal( secretada por epitélio e pelo mesênquima é composta por colágeno não fibrilar amorfoprincipalmente tipo IV, laminina, heparan sulfato, proteoglicana e outras glicoproteínas). O colágeno( proteína
mais abundante no reino animal, 27 tipos codificados por 41 genes dispersos em 14 cromossomos) é constituído
por uma hélice tripla de 3 cadeias alfa com uma sequência de repetição gly-x-y; os tipos I( tecidos moles e
duros), II( cartilagem e disco intervertebral, vítreo), III( tecidos moles e órgãos ocos), V( tecidos moles e vasos
sanguíneos) e XI são os colágenos intersticiais/fibrilares mais abundantes. O tipo IV é não fibrilar( forma
lâminas em vez de fibrilas) e, juntamente com a laminina, é o principal componente da membrana basal. O
colágeno fibrilar é sintetizado do pré-colágeno que se converte em procolágeno, que é secretado da célula e
clivado para formar a unidade das fibrilas. Em seguida, os resíduos de prolina e lisina são hidroxilados e os
resíduos de lisina e hidroxilisina são oxidados pela lisil oxidase o que permite o alinhamento e a ligação
cruzada(proporciona força tensora característica) de 3 cadeias de procolágeno para formar a tripla-hélice
estável.A elastina, presente nos vasos sanguíneos, pele, útero, pulmão proporciona o recuo elástico
característico desses tecidos; constituem-se de um núcleo central de elastina cercado por microfibrilas de
fibrilina(glicoproteina que serve como sustentação à deposição de elastina e ao agrupamento de fibras
elásticas; sua disfunção leva à síndrome de Marfan). As proteínas adesivas( CAM-moléculas de adesão
celular), pode ser dividida em 4 famílias, a saber, CAMs da família das imunoglobulinas, caderinas, integrinas e
selectinas; essas proteínas adesivas estão localizadas na membrana celular( onde atuam como receptores,
ligando-se a moléculas semelhantes ou diferentes em outras células a fim de fornecer interação homotípicaentre o mesmo tipo celular- ou heterotípica-entre tipos celulares diferentes) ou no citoplasma. As caderinas
estão envolvidas nas interações homotípicas dependentes de Ca as CAMs da família das imunoglobulinas
participam de interações homotípicas e heterotípicas. As integrinas ligam-se às proteínas de
matriz(fibronectina, laminina, trombospondina e osteopontina), a fim de mediar a adesividade entre as células e
a MEC, e às proteínas adesivas em outras células a fim de mediar a adesividade célula-célula; elas também são
estimuladas em caso de hipóxia a fim de regular a atividade do VEGFR2 e interagir com a metaloproteinase 2. A
fibronectina, composta por 2 cadeias de glicoproteínas ligadas por ligações dissulfeto, é uma proteína que se
liga ao colágeno, fibrina, proteoglicanas e receptores de superfície; o tipo fibronectina tecidual forma
agregados fibrilares nos locais de cicatrização, enquanto que o tipo plasmático forma pontes de fibrina que
constituem o coágulo sanguíneo e permite a deposição de nova matriz.A laminina é a glicoproteína mais
abundante na membrana basal e tem domínios para ligação aos receptores na membrana basal e na matriz. As
caderinas(proteína de aderência dependente do Ca) participam da interação entre células do mesmo tipo, ao
conectar as membranas plasmáticas de células adjacentes para formar junções celulares( junção
intermediária[zônula aderênte], desmossomos; a integrina e caderina se ligam ao citoesqueleto por meio das
cateninas(além de mediar a interação com o citoesqueleto, pode funcionar como um regulador dos fatores de
transcrição nuclear, sendo que sua mutação está relacionada ao câncer hepático e gastro-intestinal), o que
ocasiona a montagem do complexo de adesão focal intracelular(talina, vinculina e paxilina) e possibilita a
transmissão de forças mecânicas e a transdução de sinais(regulação da proliferação, apoptose e
diferenciação).Além dessas proteínas adesivas, também existem outras moléculas de adesão como a
SPARC(proteína acida secretada e rica em cisteína, ou osteonectina, contribui para a remodelagem em
resposta à lesão e inibe angiogênese), trombospondinas( inibe a angiogenese), osteopontina(regula a
calcificação e a migração de leucócitos ao funcionar como um ligante de receptor CD44). As
proteoglicanas(eixo protéico central ligada a polissacarídeos denominados glicosaminoglicanas; ex. dermatan
sulfato, heparan sulfato, sulfato de condroitina) tem a função de modular o crescimento e diferenciação
celular(ao se ligarem a fatores de crescimento) e regular a estrutura e permeabilidade tecidual. O acido
hialurônico( na cartilagem das articulações, em células proliferativas) é um polissacarídeo glicosaminoglicano
que se liga a grande quantidade de água para formar um gel hidratado viscoso, o que fornece elasticidade e
lubrificação, além de conferir ao tecido a habilidade de resistir às forças de compressão.O ác. Hialurônico
também pode se ligar ao CD44 de leucócitos a fim de retê-los nos sítios de inflamação.
REPARAÇÃO POR CICATRIZAÇÃO E FIBROSE
A cicatrização é uma resposta fibroproliferativa que envolve a indução de um processo inflamatório em
resposta à lesão inicial com remoção do tecido danificado, inicia a deposição , proliferação e migração de
células parenquimatosas e conjuntivas, angiogênese e formação de tecido de granulação, síntese de proteínas
de matriz e deposição de colágeno, remodelação tecidual, contração da ferida, aquisição de resistência da
ferida. Nem todos esses eventos ocorrem num mesmo ambiente, sendo que a reparação é influenciada pelo
ambiente e extensão do dano tecidual, pela intensidade e duração do estímulo danoso, pelas condições que
inibem a reparação(corpos estranhos, baixa oferta sanguínea, esteróides, doenças como o diabetes). Alguns
tecidos podem ser completamente reconstituídos como o osso após fratura ou epitélio
A inflamação iniciada pela lesão tem o objetivo de conter o dano, remover o tecido lesado e iniciar a deposição
de componentes da matriz. A cicatrização consiste na substituição do tecido parenquimatoso por tecido fibroso
sendo que, se o dano persistir, a inflamação torna-se crônica e esse dano ocorre simultaneamente ao reparo
por intermédio da deposição de tecido fibroso(fibrose).A reparação começa no INICIO da inflamação; se a
resolução não ocorrer, os fibroblastos e o endotélio(angiogênese)proliferam para formar um tipo especializado
de tecido de aparência rósea, lisa, granular, denominado tecido de granulação( indicador de cicatrização). A
angiogênese é precedida pela vasculogênese, processo no qual uma rede vascular primitiva é estabelecida a
partir dos angioblastos. 1-angiogênese de celulas precursoras : O hemangioblasto no período embrionário
origina as células tronco hematopoiéticas e os angioblastos que se prolifera, migra para os órgãos periféricos
e diferenciam-se em células endoteliais que formam as artérias, veias e os linfáticos, originam os periscitos e
m. liso da parede vascular.A angiogênese também pode ocorrer pelo recrutamento de células progenitoras
endoteliais(semelhantes aos angioblastos) armazenadas na medula óssea e integrantes dos processos de
reendotelização, neovascularização de órgãos isquêmicos, feridas cutâneas e tumores; tanto os angioblastos
como as células progenitoras endoteliais apresentam marcadores de superfície endoteliais( caderina vascular,
E-selectina, receptor Tie2). 2- angiogênese de células preexistentes: a liberação de NO e VEGF ocasiona a
vasodilatação e aumento da permeabilidade, que é seguido por degradação proteolítica da membrana basal
pelas metaloproteinases e ruptura da adesão célula-célula pelo ativador do plasminogênio.Logo após ocorre
migração das células endoteliais em direção ao estímulo angiogênico seguido de sua proliferação e
maturação(inibição do crescimento e remodelação em tubos capilares), e formação de uma rede de
sustentação vascular estável(composta pelos periscitos, m. liso e proteínas de matriz). Essa rede de
sustentação é estimulada pelas angiopoetinas(Ang1-interage com o receptor Tie2 no endotélio a fim de recrutar
células periendoteliais, mediar a maturação dos tubos endoteliais, e manter a quiescência endotelial; Ang2
interage com o Tie2 a fim de afrouxar e tornar as células endoteliais mais responsivas aos fatores de
crescimento e mais responsivas aos inibidores de angiogênese na ausência desses fatores de crescimento),
PDGF(recruta m. liso) e TGF-B(estabiliza os vasos recém-formados).O VEGF(expresso em diversos tecidos
adultos e principalmente em podócitos glomerulares e miócitos cardíacos) é o fator de crescimento mais
importante para a angiogênese, sendo induzido por hipóxia, TGF-B, PDGF e TGF-a; o VEGF se liga aos receptores
VEGFR1, 2(no endotélio) e 3(endotélio linfático) para promover angiogênese, aumento de permeabilidade
vascular, migração e proliferação endotelial, hiperplasia da vasculatura linfática, síntese endotelial de ativador
do plasminogênio, inibidor do ativador do plasminogênio 1, fator tecidual e colagenase intersticial. Durante a
angiogênese, as proteínas de matriz desempenham um papel central na motilidade e migração direcionada de
células endoteiais; esses processos são controlados por integrinas(formação e manutenção de vasos recémformados), proteínas matricelulares-trombospondina 1, SPARC e tenascina C( desestabilizam as interações
célula-matriz a fim de promover a angiogênese), proteinases( ativadores do plasminogênio tecidual e
metaloproteinases que remodelam o tecido durante a invasão endotelial, clivam proteínas extracelulares para
liberar fatores de crescimento estimuladores da angiogênese, como VEGF e FGF-2, e inibidores da proliferação
endotelial e da angiogênese, como a endostatina)
A proliferação e migração de fibroblastos
A angiogênese e o aumento da permeabilidade vascular no local da lesão ocasionam o aumento da exsudação e
a deposição de proteínas plasmáticas(fibrinogênio e fibronectina) na matriz, fornecendo um estroma provisório
para o crescimento de fibroblastos e células endoteliais; a migração e proliferação desses fibroblastos é
estimulada por TGF-B, PDGF, EGF, FGF, IL-1 e TNF.Além de também produzirem TGF-B, PDGF, e FGF, os macrófagos
no sítio da lesão constituem o tecido de granulação ao eliminar detritos extracelulares, fibrina e outros corpos
estranhos. Os sítios de lesão também podem acumular mastócitos, eosinófilos e linfócitos que podem contribuir
para a migração de fibroblastos.
Deposição de matriz e formação da cicatriz
À medida que o reparo continua o número de células em proliferação diminui e os fibroblastos depositam
quantidades cada vez maiores de matriz. Os colágenos fibrilares, importantes para a resistência na
cicatrização, formam a porção principal do tecido conjuntivo de reparação; o acúmulo de colágeno é decorrente
da síntese-estimulada pelos fatores de crescimento(PDGF, FGF, TGF-B) e citocinas(IL-1, IL-13) secretadas por
leucócitos e fibroblastos- e da degradação diminuída. No final, o tecido de granulação é convertido numa
cicatriz composta de fibroblastos fusiformes, colágeno denso, fragmentos de tecido elástico e outros
componentes da matriz extracelular; a cicatriz gradualmente amadurece acompanhada de regressão vascular,
que transforma o tecido ricamente vascularizado em tecido avascular e empalidecido.
Remodelação tecidual
Essa substituição do tecido de granulação por cicatriz envolve a mudança dos componentes da matriz, que é
gradualmente remodelada por meio do equilíbrio entre síntese e degradação (realizada por metaloproteinases
dependentes de Zn- colagenases, gelatinases, estromelisinas- e por serinoproteases como catepsina G,
elastase, quininas, plasminas); as metaloproteinases são produzidas como peptídeos inativos por fibroblastos,
macrófagos, neutrófilos, células sinoviais, e pelo epitélio em resposta a fatores de crescimento(PDGF e FGF),
citocinas(IL-1 e TNF), fagocitose, estresse físico. Elas são inibidas por TGF-B e esteróides. As colagenases, por
exemplo, são sintetizadas como procolagenase(precursor) que é ativado por químicos(radicais livres),
proteinases(plasmina produzida a partir de plasminogênio ativado por ativadores do plasminogênio); as
colagenases são inibidas pelo TIMPs(inibidores teciduais específicos das metaloproteinases) produzidos nas
células mesenquimatosas, prevenindo a ação descontrolada dessas metaloproteinases. As enzimas
ADAM(família de domínio de disintegrina e metaloproteinase) são enzimas ancoradas à membrana plasmática
que clivam os precursores de diversas proteínas(como TNF e TGF-a clivados pela ADAM-17) em compostos
ativos; os membros da ADAM estão envolvidos na patogênese da asma brônquica, da microangiopatia
trombótica e da hipoplasia pumonar.
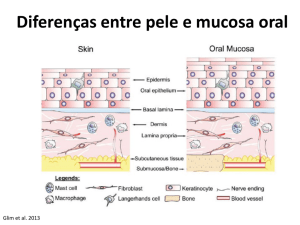
CICATRIZAÇÃO DA FERIDA CUTÂNEA
Os anexos epidérmicos não se regeneram, de maneira que mantêm uma cicatriz de tecido conjuntivo em lugar
da rede de colágeno observada na derme íntegra. Em feridas muito superficiais, o epitélio é reconstituído com
pouca formação cicatricial. Contrariamente em adultos, as feridas fetais cicatrizam sem a formação de cicatriz
fibrosada, devido à expressão diferencial das isoformas de TGF-B menos fibrogênicas que o TGF-B1.
A cicatrização da ferida cutânea é caracterizada por fases que se sobrepõe: inflamação(precoce e tardia),
formação do tecido de granulação e reepitelização, contração da ferida, deposição de matriz e remodelagem;
de acordo com a natureza da ferida, a cicatrização pode ser de primeira ou de segunda intenção. A
cicatrização de primeira intenção(feridas com margens opostas) é a cicatrização de uma incisão cirúrgica
não infectada, e aproximada por suturas; a incisão causa morte limitada de células epitelias e conjuntivas, bem
como o rompimento da continuidade da membrana basal. 1-O espaço estreito da ferida é preenchido com
sangue coagulado fibrinoso que desidrata para formar a crosta que cobre a ferida. Os neutrófilos aparecem
nas margens da incisão e se aglomeram em torno do coágulo. 2-As células epiteliais da camada basal,
próximas a derme, depositam componentes da membrana basal e se fundem para fechar a ferida. 3- Os
neutrófilos são substituídos por macrófagos que depositam o tecido de granulação(colágeno orientado
verticalmente) no espaço de incisão, e o epitélio se espessa.4-Ocorre neovascularização, proliferação de
fibroblastos e aumento da quantidade das fibrilas colágenas para unir a incisão, a epiderme recupera sua
espessura normal e sofre queratinização.5-O infiltrado de leucócitos, o edema e a vascularidade aumentados
desaparecem totalmente, sendo que o tecido torna-se pálido(devido acúmulo de colágeno na cicatriz
acompanhado de regressão vascular).6- A cicatriz é composta de um tecido conjuntivo celular desprovido de
infiltrado inflamatório, coberto pela epiderme intacta; os anexos dérmicos destruídos são perdidos
permanentemente, e a forçatensil/resistência(garantida pelo aumento da síntese e diminuição da degradação
de colágeno e pelas modificações estruturais das fibras-ligação cruzada e aumento do tamanho da fibra) da
ferida aumenta gradualmente por alguns meses até atingir 80% da resistência da área não lesada. Na
cicatrização por segunda intenção(feridas com margens separadas) ocorre perda substancial de células e
tecidos, acompanhada de grande deformação superficial, o que dificulta a reparação.A regeneração
parenquimatosa é insuficiente para restaurar completamente a arquitetura original, de maneira que ocorre
extenso crescimento de tecido de granulação, a partir da margem, para completar o reparo. O grande defeito
gera extenso coágulo de fibrina, detritos necróticos e exsudato que devem ser removidos por reação
inflamatória mais intensa. Além disso também ocorre grande contração da ferida, promovida por
miofibroblastos localizados nas margens; há extensa formação de cicatriz e diminuição da epiderme.
Dentre os fatores sistêmicos que influenciam a cicatrização, pode-se citar o estado nutricional(ex. deficiência
de vit C, zindo e cobre), a condição metabólica(ex. diabetes melito causando microangiopatia), condição
circulatória(oferta sanguínea inadequada causada por arterosclerose e anormalidades venosas que retardam a
drenagem; hipóxia, hipovolemia), hormônios(ex. glicocorticóides de efeito antiinflamatório e inibidores da
síntese de colágeno), idade, estado anêmico, uso de drogas( medicações citotóxicas, antibióticoterapia
intensiva), disfunções genéticas(ex. osteogênese imperfeita, síndrome de Ehlers Danlos, síndrome de
Marfan),doença maligna, obesidade, infecção sistêmica, temperatura, disfunções hemodinâmicas, uremia.
Dentre os fatores locais que afetam a cicatrização, pode-se citar os fatores mecânicos( movimento inicial das
feridas comprime os vasos sanguíneos e separa as margens da ferida, atrasando a cicatrização), corpos
estranhos(suturas desnecessárias, fragmentos de aço, vidro, osso impedem a cicatrização), o tamanho, a
localização(ex. área muito/pouco vascularizada)e o tipo de ferida(lesão por incisão pequena cicatriza mais
rápido que lesão causada por trauma fechado ou incisão grande), estado de inervação, infecção local,
hematoma, presença de necrose, presença de curativos
As complicações na cicatrização podem surgir devido 1-formação inadequada de cicatriz : Corre por
formação inadequada de tecido de granulação ou produção de uma cicatriz inadequada que desencadeiam
deiscência(ruptura comum após cirurgia abdominal devido aumento da pressão ocasionado por vômito, tosse
ou íleo) e ulceração da ferida(devido vascularização inadequada e ausência de inervação sensitiva na área
lesada-ex. extremidades inferiores de indivíduos acometidos por neuropatia diabética).
2-formação excessiva dos componentes da reparação: Ocorre por crescimento aberrante em alguma fase
do processo de reparo, produzindo cicatriz hipertrófica e quelóide(caso o tecido cicatricial cresça além dos
limites da ferida original e não regrida).A formação de quelóide pode ser favorecida por uma predisposição
individual, sendo um processo mais comum em afrodescendentes. Além disso, pode ocorrer a formação
excessiva de tecido de granulação que se sobressai acima do nível da pele e bloqueia a reepitelização, processo
denominado granulação exuberante ou carne esponjosa.Essa granulação exuberante deve ser removida por
cauterização ou excisão cirúrgica para permitir a continuidade da restauração do epitélio. A cicatriz por incisão
ou lesão traumática também pode ser seguida por proliferação exuberante de fibroblastos e outros elementos
conjuntivos que podem reincidir após excisão; essa cicatriz aberrante é denominada desmóide ou fibromatose
agressiva e está normalmente está localizada na interface entre as proliferações benignas e tumores malignos
3- formação de contraturas: consiste no exagero de contração da ferida, resultando em deformidades na
ferida e nos tecidos adjacentes.Ocorre principalmente nas palmas das mãos, solas dos pés e face anterior do
tórax após queimaduras sérias que podem comprometer o movimento das articulações.
FIBROSE
A fibrose pode estar associada a doenças inflamatórias crônicas como 1-artrite reumatóide(degradação
acentuada de colágeno causa a destruição articular) , 2-doença pulmonar fibrótica( nas doenças pulmonares
intersticiais crônicas denominadas pneumoconioses, causadas pela inalação de carvão, asbesto, e sílica; os
macrófagos fagocitam essas partículas minerais, o que desencadeia a secreção de fatores de crescimento e
citocinas que levam à fibrose) e 3-cirrose hepática(ocorre ativação e produção de colágeno pelas células
estreladas hepáticas, ocasionando a deposição desse colágeno e consequente alteração morfofuncional).
A permanência de um estímulo persistente(inflamação crônica) ou o desenvolvimento de reações imunes/autoimunes ativa os linfócitos e células do sistema mononuclear fagocitário, que passam a sustentar a síntese e
secreção de fatores de crescimento(proliferação de fibroblastos, endotélio, e células fibrogênicas), citocinas
fibrogênicas(TNF, IL-1, IL4, IL-13- aumentam a síntese de colágeno), enzimas proteolíticas e outras moléculas
biologicamente ativas, e a contribuir para a redução da ativação de metaloproteinases(ocasiona a diminuição
da degradação de colágeno); esses fenômenos conjuntos levam à fibrose.
A fibrose também pode ocorrer nos pulmões, no trato gastrointestinal, nos rins, e em outros órgãos após o uso
de radiação ionizante no tratamento do câncer. Na pancreatite aguda, os episódios repetidos de inflamação
pancreática aguda levam à destruição das células acinares que são gradualmente substituídas por tecido
fibroso.