04/10/2011
FORÇAS DE INTERAÇÃO MOLECULAR
ENTRE LIGANTES E PROTEÍNAS
O que é um medicamento?
1
04/10/2011
O que é um medicamento?
Medicamento
(produto final)
Excipientes
+
Principio ativo
(“fármaco”, “droga”)
Como atua uma droga?
2
04/10/2011
Como atua uma droga?
Como atua uma droga?
Enzimas
Receptores
Canais de íons
Transportadores
...
3
04/10/2011
Como atua uma droga?
Inhibidores
Enzimas
Antagonistas
Receptores
Agonista
Canais de íons
Agonista parcial
Transportadores
...
...
Como atua uma droga?
Inhibidores
Enzimas
Antagonistas
Receptores
Agonista
Canais de íons
Agonista parcial
Transportadores
...
...
Afinidade?
4
04/10/2011
Como atua uma droga?
Inhibidores
Enzimas
Antagonistas
Receptores
Agonista
Canais de íons
Agonista parcial
Transportadores
...
...
Afinidade?
AG = AH – T AS
G = Energia livre
H = Entalpia
T = Temperatura
S = Entropia
Como atua uma droga?
Inhibidores
Enzimas
Antagonistas
Receptores
Agonista
Canais de íons
Agonista parcial
Transportadores
...
...
Afinidade?
AG = AH – T AS
G = Energia livre
H = Entalpia
T = Temperatura
S = Entropia
Interações
ligante-receptor
5
04/10/2011
Como atua uma droga?
Inhibidores
Enzimas
Antagonistas
Receptores
Agonista
Canais de íons
Agonista parcial
Transportadores
...
...
Afinidade?
Interações covalentes
Interações não covalentes
(eletrostáticas, forças de Van der
Waals)
Impedimento estérico
AG = AH – T AS
G = Energia livre
H = Entalpia
T = Temperatura
S = Entropia
Interações
ligante-receptor
Como atua uma droga?
Inhibidores
Enzimas
Antagonistas
Receptores
Agonista
Canais de íons
Agonista parcial
Transportadores
...
...
Afinidade?
AG = AH – T AS
G = Energia livre
H = Entalpia
T = Temperatura
S = Entropia
Grão de
desordem
6
04/10/2011
Como atua uma droga?
Inhibidores
Enzimas
Antagonistas
Receptores
Agonista
Canais de íons
Agonista parcial
Transportadores
...
...
Afinidade?
AG = AH – T AS
G = Energia livre
H = Entalpia
T = Temperatura
S = Entropia
Grão de
desordem
Restrição
conformacional
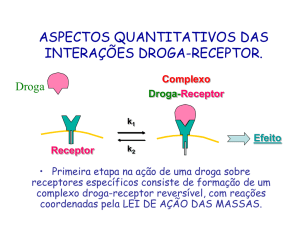
Ligação droga - receptor
7
04/10/2011
Ligação droga - receptor
P. Ehrlich (1854-1915): “Corpora non agunt nisi fixata“
(as substancias não são ativas se não ligadas entre elas)
E. Fisher (1852-1919): Principio “Chave-Fechadura”
D. Koshland (1920-2007): “Modelo de encaixe induzido”
Ligação droga - receptor
AG = AH – T AS
Interações
ligante-receptor
Grão de
desordem
8
04/10/2011
Forças eletrostáticas
Resultantes da interação entre íons e/ou dipolos de cargas opostas
A forca depende da constante dielétrica do meio e da distancia entre as cargas
Força de atração fraca
Força de atração forte
DESOLVATA
ÇÃO
Perda
entalpica
Ganho
entropico
Forças eletrostáticas
Dois tipos de forças eletrostáticas intermoleculares:
Íon - dipolo: força resultante da interação de um íon e uma espécie neutra polarizável,
com carga oposta àquela do íon
Dipolo - dipolo: interação entre dois grupamentos com polarizações de cargas opostas
Forç
a
Modelo
Base da atração
Energia
(kJ/mol)
Exemplo
?
Polarização: Causada por a diferencia de eletronegatividade entre um heteroátomo e
um átomo de carbono
9
04/10/2011
Forças eletrostáticas
As forças eletrostáticas podem ser também classificadas em função da simetria dos
parceiros de interação:
Monopolo
Dipolo
Quadrupolo
...
Ligação de hidrogénio
Interação de um átomo eletronegativo que tem um átomo de hidrogênio
covalentemente unido, com outro átomo eletronegativo com um par de elétrons
livre.
Átomo ligado á hidrogênio = doador de enlace de hidrogeno
Átomo com par de elétrons livre = aceptor de enlace de hidrogênio
10
04/10/2011
Ligação de hidrogénio
A maior componente do enlace é a interação eletrostática do dipolo doador hidrogênio com a carga negativa parcial do aceptor.
Características especiais por o pequeno tamanho e a alta carga positiva do átomo de
hidrogênio, assim como a alta eletronegatividade do aceptor.
Forç
a
Modelo
Base da atração
Energia
(kJ/mol)
Exemplo
São interações dirigidas (alta dependência angular)
Ligação de hidrogénio
Importância biológica:
Responsáveis pela estabilidade de conformações bioativas de macromoléculas como
α-hélices de proteínas e interações purinas-pirimidinas dos ácidos nucléicos
αhélice
DNA
Papel importante na especificidade ligante – proteína: por causa da direcionabilidade
deles, e por o fato de que precisam uma complementaridade bem definida no
complexo
11
04/10/2011
Pontes salinos
É uma combinação de um enlace de hidrogênio e uma interação eletrostática
=
Possui uma energia similar aos enlaces de hidrogênio
Presente normalmente entre aminoácidos com um grupo ionizável na cadeia lateral:
arginina e lisina (positivos) e glutamato e aspartato (negativos)
Interação cátion - π
Surgem da interação entre a nove de elétrons π de um sistema aromático com um
cátion próximo.
É uma força eletrostática entre um monopolo (cátion) e um quadrupolo (sistema
aromático)
Quadrupolo do benzeno
Exemplo de interação cátion π
A força é do mesmo ordem de magnitude que os pontes salinos e os enlaces de
hidrogênio
A força aumenta com substituintes doadores de elétrons no sistema aromático, e
com cátions menores e mais positivamente carregados
12
04/10/2011
Complexação metálica
São forcas eletrostáticas formadas entre um monopolo (cátion metálico) e um multipolo
(coordenação metálica) ou multipolo (quelação).
EDTA - metal
Etilendiamina - metal
Jogam um papel importante em casos individuais de interações ligante - proteína, como
no caso das metaloenzimas
Interação π-stacking
Surgem da interação entre as noves de elétrons π de dois sistemas aromáticos.
Anel aromático ligado a grupo eletrodeficiente (R2) = dipolo positivo.
Anel aromático ligado a grupo doador de elétrons (R1) = dipolo negativo.
São forcas fracas, de magnitude similar a outras forças dipolo - dipolo
Os anéis ficam alinhados em paralelo para maximizar a força
Importância na interação ligante – proteína (resíduos aromáticos)
13
04/10/2011
Forças indutivas
Surgem por a distorção da nove eletrônica sobre um átomo quando fica perto de um
íon ou um dipolo.
Esta distorção é induzida por o campo elétrico positivo ou negativo do íon ou dipolo.
São forças atrativas e de corto alcance.
Força
Modelo
Base da atração
Energia
(kJ/mol)
Exemplo
Forças de dispersão
São forças indutivas que surgem por flutuação de cargas, e não por distribuição
permanente de cargas.
Flutuação de cargas: o movimento dos elétrons faz com que se forme um dipolo
instantâneo. Este dipolo, mesmo se flutuante, pode produzir um dipolo num átomo
vizinho.
Geralmente chamadas Forcas de dispersão de London
Estas forças são atrativas e de menor alcance que as forças indutivas.
A magnitude aumenta com o tamanho dos átomos.
Força
Modelo
Base da atração
Energia
(kJ/mol)
Exemplo
14
04/10/2011
Forças de dispersão
Existem entre duas moléculas apolares, geralmente por polarização das ligações
carbono – hidrogeno ou carbono -carbono.
Carbono - hidrogeno
Carbono - carbono
Normalmente se caracterizam por interações múltiplas que, somadas, acarretam
contribuições energéticas significativas
São de extrema importância para o processo de reconhecimento molecular do fármaco
pelo sítio receptor
Efeito hidrofóbico
Definido como a preferência de moléculas apolares por ambientes não aquosos, ou a
incapacidade delas de formarem ligações hidrogênio com moléculas de água.
A aproximação das superfícies apolares durante a interação ligante-receptor, libera e
desorganiza as moléculas de água, aumentando a entropia do sistema e favorecendo a
formação do complexo
Por causa do grande número de sub-unidades hidrofóbicas presentes em proteínas e
fármacos, esta interação é importante para o reconhecimento da molecular
15
04/10/2011
Interações covalentes
Surgem da formação de uma ligação sigma entre dois átomos que contribuem cada qual
com um elétron.
Ocorrem com fármacos que apresentam grupamentos com acentuado caráter
eletrofílico ou nucleofílico.
Ligação geralmente irreversível.
Forç
a
Modelo
Base da atração
Energia Exemplo
(kJ/mol)
Pouco comum nas ligações ligante – proteína. Exs: aspirina.
Forças de Van der Waals
?
16
04/10/2011
Forças de Van der Waals
As forças de Van der Walls englobam as forças atrativas ou repulsivas
entre moléculas distintas dos enlaces covalentes e das interações
eletrostáticas que envolvem íons.
- Forças entre dipolos permanentes
- Forças entre um dipolo permanente e um dipolo induzido
- Forças entre dois dipolos induzidos
Idéias comuns mas erradas:
Forças de Van der Walls = todas as forças intermoleculares
Forças de Van der Walls = forças de dispersão de London
Cálculo de forças de interação
17
04/10/2011
Cálculo de forças de interação
Conceitos gerais
Termodinamicamente descritas por a afinidade de ligação o energia livre de ligação
(Gibbs):
Δ G = ΔH – TΔ S
G = Energia livre de Gibbs
H = Entalpia
S = Entropia
No sistema em equilíbrio:
A+B
AB
Δ G0 = -RTlnKeq
Uso de aproximações (energía potencial, suma de términos
independentes)
Difícil de calcular
Cálculo de forças de interação
Conceitos gerais
Energia potencial de ligações não covalentes:
rij é a distância entre os átomos i e j
εij e σij são os parâmetros de Lennard-Jones
qi e qj são as cargas parciais dos átomos i e j
Potencial
Lennard-Jones
Interações
eletrostática
s
D é a constante dielétrica relativa do meio
Força Força
repulsiva de atrativas
Pauli entre
dipolos
18
04/10/2011
Cálculo de forças de interação
Solvatação do sistema
A força de ligação é o resultado da suma das distintas forças de interação ligante –
proteína menos as energias de desolvatação de ambos:
Efeitos á considerar:
Perda de entalpia por desolvatação
Ganho de entalpia por formação do complexo
Ganho de entalpia por formação de enlaces de hidrogênio nas moléculas de água
liberadas
Ganho de entropia por desorganização das moléculas de água liberadas
Cálculo de forças de interação
Contribuições da flexibilidade conformacional
Perda de entropia por congelação de grados de liberdade no ligante
Flexibilidade do taxol em solução
Múltiplas conformações
Taxol ligado com o receptor β-tubulina
Uma única conformação
Penalização entrópica por congelar um enlace simples = 1.6-3.6 kJ/mol.
Penalização entrópica por perda de grados de liberdade orientacionais e translacionais
= 10 kJ/mol
19
04/10/2011
Cálculo de forças de interação
Contribuições dos enlaces de hidrogênio
Baseado em dados de proteínas mutantes, a contribuição dos enlaces de hidrogênio
para a energia de ligação é aproximadamente 5 =/- 2,5 kJ/mol
Os dados achados para diferentes proteínas sugerem algum grado de aditividade nas
interações de enlace de hidrogênio
A contribuição dos enlaces de hidrogênio na afinidade depende fortemente dos
efeitos de solvatação/desolvatação locais, e pode ser mesmo negativa para a ligação
Ex. Os pontes salinos são mais fortes, mas também estão associados a uma maior
penalidade por desolvatação. Por isso, um ponte salino exposto contribui na
energia de afinidade tanto como um enlace de hidrogênio normal, mas a
contribuição dele no interior pode ser bem maior.
Cálculo de forças de interação
Efeito hidrofóbico:
Geralmente aproximada considerando que a contribuição de energia é proporcional à
superfície hidrofóbica "enterrada" do ligante
N é o número de átomos do ligante
SASi é a “superfície acessível ao solvente” “enterrada na proteína”.
20
04/10/2011
Conclusões
Características das interações ligante – proteína extraídas de dados experimentais:
Alta complementaridade esterica ligante/proteína
A complementaridade pode ser induzida por mudanças conformacionais nos
parceiros
Alta complementaridade de propriedades de superfície
A complementaridade pode ser induzida por liberação ou absorção de
prótons na proteína ou ligante (mudanças no pKa)
Conformação energeticamente favorável do ligante
Encaixe imperfeito das superfícies lipófilas diminui a afinidade
Grupos polares não emparelhados enterrados na superfície ligante-proteína são
fortemente negativos para a ligação
21