30/10/15
Isomeria
Fenômeno pelo qual substâncias
diferentes apresentam mesma fórmula
molecular.
iso = igual
meros = parte
Prof. Xuxu
(Mayanderson)
Química
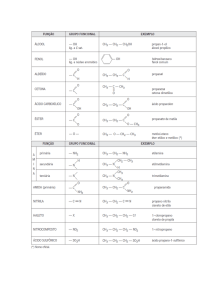
Isomeria de cadeia
Classificação
Cadeia
Posição
Função
Metameria
Tautomeria
Plana
Isomeria
Isomeria de cadeia é aquela onde os isômeros
têm cadeias ou núcleos diferentes.
CH3- CH = CH2
C 3H 6
Geométrica
Propeno
CH2
Espacial
Ciclopropano
Ótica
CH2- CH2
Química
Química
Isomeria de cadeia
Isomeria de posição
Isomeria plana de posição ocorre quando os
isômeros tem a mesma cadeia carbônica, mas
diferem pela posição de radicais ou de ligações
duplas ou triplas.
1
2
3
4
CH3
CH3- CH - CH3
C4H10
CH2=CH-CH2-CH3
Metil - propano
C 4H 8
CH3- CH2- CH2 - CH3
Buteno-1
1
2
3
4
CH3-CH=CH-CH3
Buteno-2
Butano
Química
Química
1
30/10/15
Isomeria de posição
3
2
Isomeria de Função
Isomeria funcional ocorre quando os
isômeros pertencem a funções químicas
diferentes.
Os casos mais comuns de isomeria
plana de função ocorrem entre:
1
CH3- CH2- CH2- OH
Propanol-1
C 3H 8O
1
2
3
CH3- CH- CH3
OH
• Álcool, Éter, Enol e Fenol;
• Aldeído e Cetona;
• Ácido Carboxílico e Éster.
Propanol-2
Química
Química
Isomeria de Função
Isomeria de Função
Álcoois e Éteres;
Aldeídos e Cetonas;
CH3- CH2 – OH
C 2H 6O
CH3- CH2 - CHO
Etanol
C 3H 6O
CH3- O - CH3
Propanal
CH3 - CO - CH3
Metóxi-metano
Propanona
Química
Isomeria de Função
Química
Metameria (compensação)
Isomeria de compensação ocorre quando os
isômeros diferem pela posição de um heteroátomo
na cadeia carbônica.
Ác.Carboxílicos e Ésteres;
CH3- CH2 -O- CH2 - CH3
CH3- CH2 -COOH
C3H6O2
Ác. Propanóico
C4H10O
CH3 -COO- CH3
Etóxi-etano
CH3 -O- CH2 - CH2 - CH3
Etanoato de metila
Metóxi-propano
Química
Química
2
30/10/15
Tautomeria
Tautomeria
Tautomeria é o caso particular de isomeria
funcional onde os dois isômeros
ficam em
equilíbrio dinâmico.
Enol
CH2
H
C
OH
Aldeído
CH3 - C
Tautomeria é o caso particular de isomeria
funcional onde os dois isômeros
ficam em
equilíbrio dinâmico.
H
O
OH
CH2
O
C
CH3
C
CH3
Enol
CH3
Cetona
Tautomeria Ceto-enólica
Tautomeria aldo-enólica
Química
Química
Isômeros:
substâncias de estruturas
diferentes,
mas de mesma fórmula
molecular
ESTEREOISÔMEROS
Substâncias em que os
átomos estão ligados na
mesma ordem mas a
orientação espacial é
diferente
ENANTIÔMEROS
As moléculas são imagens
especulares umas das
outras. Não se
sobrepõem.
DIASTEREOISÔMEROS
As moléculas não são
imagens especulares umas
das outras. Não se
sobrepõem.
ISÔMEROS
CONSTITUCIONAIS (PLANA)
Isômeros que diferem
na ordem com que os
átomos estão ligados
Isomeria Espacial
Os isômeros espaciais possuem a mesma
fórmula molecular e também a mesma
fórmula estrutural plana, diferenciando
apenas nas fórmulas estruturais espaciais.
Os isômeros espaciais podem ser divididos
em geométricos e ópticos.
Fórmulas
Moleculares Iguais
Fórmulas
Estruturais Planas Iguais
fórmulas
Espaciais Diferentes
3
30/10/15
Isomeria geométrica
(cis-trans ou Z-E)
Os isômeros são compostos que possuem
a distribuição espacial diferente. Este
tipo de isomeria espacial, ocorre, caso
existam ligações duplas/cadeia fechada
e com ligantes diferentes ligados a um
mesmo carbono.
Os isômeros podem ser classificados
como cis(Z) ou trans(E).
Não ocorre isomeria espacial
geométrica devido a possibilidade de
rotação entre os carbonos.
Compostos etilênicos
C=C
- A ligação pi entre os carbonos impede a
rotação entre eles.
- A ligação dupla divide o espaço em dois
planos, um acima da ligação pi e outra
abaixo.
4
30/10/15
Tipos de Isomeria Geométrica
Compostos Ciclânicos
cis(Z): zusammen (juntos)
do mesmo lado, juntos, no mesmo
lado do plano de simetria.
trans(E) entgegen (opostos)
Os átomos de C dos ciclos não giram
completamente ao redor de suas ligações.
Isomeria Geométrica (Cis –Trans)
Condições de existência:
1) Cadeias abertas com ligação dupla;
2) Radicais ≠ no mesmo carbono e = entre carbonos;
H
H
C=C
CH3
CH3
H
CH3
C=C
H
CH3
em lados opostos do plano de
simetria.
Isomeria Geométrica (Cis –Trans)
Condições de existência:
1) Cadeias abertas com ligação dupla entre carbonos ou
cadeias cíclicas;
2) Radicais ≠ no mesmo carbono e = entre carbonos;
3) Radicais ≠ nos carbonos da dupla.
H
H
O
C-C
O
H
C-C
O
H
O
Mesmo composto
5
30/10/15
Isomeria Geométrica (Cis –Trans)
CIS
(próximo a): os radicais iguais, ou de maiores
Z, estão do mesmo lado do semi-plano.
TRANS
(através de): os radicais iguais, ou de
maiores, Z estão em semi-planos opostos.
Em
geral, a forma TRANS é mais estável.
Condições de existência:
1) Cadeias abertas com ligação dupla;
2) Radicais ≠ no mesmo carbono e = entre carbonos;
H
H
C=C
CH3
CH3
Cis
H
CH3
C=C
H
CH3
Trans
Isomeria Geométrica (Cis –Trans)
Condições de existência:
1) Cadeias cíclicas;
2) Radicais ≠ no mesmo carbono e = entre carbonos;
H
CH2
C
C
CH3
H
CH3
Cis
CH2
H
C
CH3
C
CH3
H
Trans
Os isômeros cis e trans possuem
propriedades físicas diferentes, tais como,
PF, PE e densidade.
6
30/10/15
Compostos cíclicos
TRANS
CIS
Classificação
Isômeros
ÓPTICOS
Diasteroisômeros
Enantiômeros
Polarização da Luz
ISOMERIA ÓPTICA
Estuda o comportamento das
substâncias quando submetidas a
um feixe de luz polarizada, que
pode ser obtida a partir da luz
natural (não-polarizada).
A luz polarizada é obtida fazendo-se passar um
feixe de luz natural por dispositivos chamados de
polarizadores. Um dos mais comuns é o prisma de Nicol.
Polarizador
Luz Natural
Luz Polarizada
7
30/10/15
Substância opticamente ativa
Substância
opticamente inativa (SOI): não
desvia o plano de vibração da luz polarizada.
Dextrógiro, (d) ou (+) - desvia o plano de luz
para a direita.
Substância
opticamente ativa (SOA): desvia o
plano de vibração da luz polarizada.
Levógiro, (l) ou (- ): desvia o plano de luz para
a esquerda.
Isomeria Óptica
Luz
polarizada
Luz
polarizada
H
H
CH3- C - COOH
OH
Imagem especular (imagem invertida)
Ác. (+) d-Láctico
HOOC- C - CH3
OH
Ác. (-) l -Láctico
Enantiômeros , enantiomorfos ou antípodas
Mistura racêmica
Está
Uma mistura formada por partes iguais
dos antípodas d e l (mistura equimolar) não
desvia o plano da luz polarizada e é chamada de
mistura racêmica.
ligada à assimetria molecular.
Toda
substância que apresenta carbono
quiral / assimétrico ou que possua centro de
assimetria é opticamente ativa.
8
30/10/15
Isômeros ópticos
São
aqueles cuja única
diferença está no
comportamento diante da
luz polarizada.
Algumas
substâncias, sólidas
ou líquidas, possuem a
capacidade de produzir um
desvio no plano da luz
polarizada. São chamadas
substâncias opticamente
ativas.
Quando
uma substância opticamente
ativa é atravessada pela luz
polarizada, ocorre uma rotação no
plano de vibração, que é então
passado por um analisador, que faz a
leitura do ângulo de rotação (desvio
do plano).
Luz não polarizada
É um conjunto de ondas eletromagnéticas que
vibram em vários planos, perpendiculares á
direção de propagação do feixe luminoso.
Uma lâmpada incandescente emite uma luz
que é constituída de ondas eletromagnéticas, que
se propagam com vibrações em infinitos planos,
formando, teoricamente, um movimento
espiralado. Esse movimento é resultado da
composição das diversas vibrações em vários
planos. Se "filtrarmos" essas vibrações de modo
que se tenha vibração em apenas um plano,
teremos a chamada luz polarizada.
Luz polarizada
É um conjunto de ondas eletromagnéticas que
vibram em um único plano, denominado plano
de polarização.
9
30/10/15
Os
dispositivos capazes de "filtrar"
os planos de propagação da luz
são denominados polarizadores.
Existem muitas maneiras de
polarizar a luz. Uma delas é
utilizar o prisma de Nicol - um
cristal transparente de CaCO3
denominado espato da Islândia,
que possui a propriedade de
produzir a dupla refração da luz.
Para
cada raio incidente saem dois raios
refratados. Esses dois raios refratados são
polarizados, porém, em planos diferentes.
Para obter a luz em um único plano de
vibração é preciso eliminar um desses raios.
Para isso o prisma é cortado segundo um
plano diagonal e em seguida as partes
cortadas são coladas com uma resina
transparente denominada bálsamo do
Canadá. Essa resina é mais refringente que o
cristal; um dos raios atinge o bálsamo com
um ângulo de incidência maior que o ângulo
limite e, consequentemente, é refletido.
Somente um dos raios é capaz de atravessar
o prisma. Temos então a luz polarizada:
Investigando imagens em um espelho.
Simetria
A imagem de nossa mão esquerda no
espelho é diferente dela.
(É igual a mão direita!)
A imagem de uma esfera no espelho é igual a
própria esfera.
10
30/10/15
Se fizermos com que a luz
polarizada atravesse um frasco
contendo uma substância cujas
moléculas sejam assimétricas,
verifica-se experimentalmente
que o plano de vibração da luz
polarizada sofre um desvio.
Quando
esse desvio é para a direita (no
sentido horário) dizemos que a substância é
dextrógira (representada pela letra d ou pelo
sinal +).
Quando o desvio é para a esquerda (no
sentido anti-horário) dizemos que a
substância é levógira (representada pela letra
l ou pelo sinal -).
Professora Cláudia Bacchi
Ângulo de desvio da luz
polarizada.
+
( d) dextrógiro
-
(l) levógiro
+ ( d) dextrógiro
-
(l) levógiro
11
30/10/15
Molécula assimétrica:
É
aquela que possui carbono
assimétrico (C*) ou aquela
que apresenta um centro
assimétrico.
Carbono
assimétrico é um átomo de carbono saturado
(hibridação sp3), que apresenta quatro radicais
diferentes ligados a ele. Com essa estrutura, a
molécula não apresenta nenhum plano de simetria e
sua imagem especular terá estrutura não coincidente.
C*
C*
Exemplo 1
Carbono quiral
H
CH3- *C - COOH
CHFBrCl
OH
Carbono Quiral (C*) ou assimétrico: está ligado a
quatro radicais diferentes.
Exemplo 2
Exemplo 3
12
30/10/15
Antípodas ópticos ou enantimorfos
Dois isômeros opticamente ativos d e l que
apresentam o mesmo ângulo de desvio,só que
em sentidos opostos e são imagens
especulares um do outro.
MISTURA RACÊMICA
resulta numa mistura
opticamente inativa, conhecida
também por isômero racêmico
(dl ou r).
l
d= + 400
+
d
e l = - 400
COMPOSTO MESO
O sistema R/S
A especificação da configuração absoluta de um centro quiral pode
ser feita sem ambiguidade utilizando o sistema de Cahn-Ingold-Prelog. No
sistema R/S, atribui-se a cada substituinte de um centro quiral uma
prioridade de acordo com as regras:
• átomos de maior número atômico tem maior prioridade.
• quando os dois átomos ligados são iguais, amplia-se a comparação aos
átomos ligados a estes até se poder tomar uma decisão. Por exemplo,
CCl3 tem prioridade sobre CH3 pois Cl tem número atômico Z=17, superior
a H (Z=1).
O passo seguinte é orientar a molécula de forma a que o substituinte
de menor prioridade aponte no sentido oposto ao observador.
Se os outros três substituintes estiverem distribuídos de forma a que o
percurso do substituinte de maior prioridade para o de menor prioridade
fôr no sentido dos ponteiros do relógio a configuração denomina-se R (do
latim rectus, que significa "direita"). Se eles estiverem dispostos no
sentido oposto ao dos ponteiros do relógio a configuração denominase S (do latim sinister, que significa "esquerda").
13
30/10/15
São
isômeros ópticos que desviam a luz polarizada
em ângulos diferentes e não são imagens
especulares um do outro
Os
pares abaixo são
d = +400
l = -400
d= + 400
d = +200
considerados diastereoisômeros:
e d = +200
e l = -200
e l = -200
e l = -400
Medicamento
Isômero destrógiro do
LSD causa alucinações
enquanto que o isômero
levógiro não produz
nenhum efeito.
usado no final da década de
1950 prescrito como tranquilizante para
gestantes.
O
Knowles,
O LSD é extraído de uma flor
conhecida como Mornig Glory
Noyori e Sharpless em 2001.
Criaram métodos de obter um produto puro
epecífico, eliminando a versão quiral
indesejada.
L- dopa é um remédio usado
para tratar Mal de Parkinson
14
30/10/15
CÁLCULO DOS
ISÔMEROS ÓPTICOS
Possui 1 C*
n = número de c* diferentes
2n = ISÔMEROS ATIVOS
2n-1 = ISÔMEROS INATIVOS
ero
núm
=
n
H
*
de C
2n =
21
= 2 isômeros ativos
1dextrógiro
1 levógiro
2n-1 = 21-1 = 20 = 1 isômero
inativo(mistura racêmica)
Total 3 isômeros
H
HOOC – C – C - COOH
OH OH
2C*
iguais
2n = 21 = 2 isômeros ativos ( 1 d e 1 ℓ)
2n-1 = 21-1 = 20 = 1 isômero inativo
1 isômero MESO
Total 4 isômeros
2n = 22 = 4 isômeros ativos
2n-1 = 22-1 = 21 = 2 isômero inativos
15