VOLUME 3 | QUÍMICA 3
Resoluções das Atividades
Sumário
Aula 11 – Hibridização; Geometria molecular; Teoria da Repulsão dos Pares
Eletrônicos da Camada de Valência.................................................. 1
Aula 12 – Polaridade molecular e ligações intermoleculares............................ 2
.
Aula 11
Hibridização; Geometria molecular; Teoria da Repulsão
dos Pares Eletrônicos da Camada de Valência
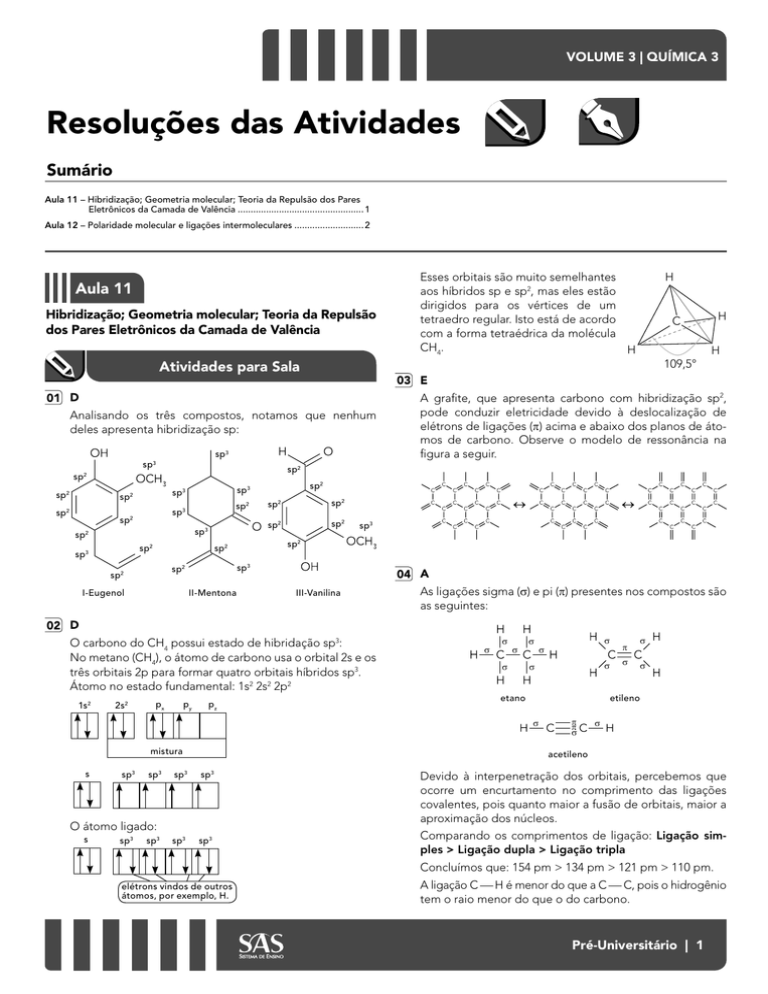
Analisando os três compostos, notamos que nenhum
deles apresenta hibridização sp:
sp3
sp2
sp3
sp2
sp3
sp2
sp2
sp3
A grafite, que apresenta carbono com hibridização sp2,
pode conduzir eletricidade devido à deslocalização de
elétrons de ligações (p) acima e abaixo dos planos de átomos de carbono. Observe o modelo de ressonância na
figura a seguir.
sp2
sp2
sp2
sp
sp3
2
sp3
sp2
I-Eugenol
2
sp
sp2
sp2
sp2
sp3
sp3
sp2
sp2
H
sp2
sp2
sp2
H
C
03 E
01 D
sp3
H
109,5°
Atividades para Sala
Esses orbitais são muito semelhantes
aos híbridos sp e sp2, mas eles estão
dirigidos para os vértices de um
tetraedro regular. Isto está de acordo
com a forma tetraédrica da molécula
CH4.
H
II-Mentona
04 A
III-Vanilina
As ligações sigma (s) e pi (p) presentes nos compostos são
as seguintes:
02 D
O carbono do CH4 possui estado de hibridação sp3:
No metano (CH4), o átomo de carbono usa o orbital 2s e os
três orbitais 2p para formar quatro orbitais híbridos sp3.
Átomo no estado fundamental: 1s2 2s2 2p2
1s2
py
px
2s2
s
s
s
s
s
s
sp
sp
sp
sp3
sp3
s
s
s
p
p
s
s
acetileno
3
sp
3
O átomo ligado:
s
p
etileno
etano
pz
mistura
3
s
s
s
3
s
s
sp3
sp3
elétrons vindos de outros
átomos, por exemplo, H.
Devido à interpenetração dos orbitais, percebemos que
ocorre um encurtamento no comprimento das ligações
covalentes, pois quanto maior a fusão de orbitais, maior a
aproximação dos núcleos.
Comparando os comprimentos de ligação: Ligação simples > Ligação dupla > Ligação tripla
Concluímos que: 154 pm > 134 pm > 121 pm > 110 pm.
A ligação C H é menor do que a C C, pois o hidrogênio
tem o raio menor do que o do carbono.
Pré-Universitário | 1
VOLUME 3 | QUÍMICA 3
Atividades Propostas
08 D
01 A
Observando a estrutura do SO2, podemos
concluir que trata-se de uma molécula angular,
polar e que o átomo de S possui hibridação sp2.
119°
09 D
No caso do ClF3 temos uma geometria da molécula em
forma de T, uma geometria dos pares de elétrons pirâmide
de base quadrada e uma hibridação do tipo sp3d e sp3d2.
10 B
0,136nm
Observando o composto, temos 26 ligações do tipo sigma
e 4 ligações do tipo pi.
0,136nm
0,107nm
02 D
120°
0,107nm
d
Como no composto temos uma ligação tripla e quatro ligações duplas, há um total de seis ligações p, e o H ligado ao
nitrogênio faz ponte de hidrogênio.
I. (V) Suas moléculas contêm carbonos sp2.
II. (V) São hidrofóbicas, pois são apolares, não se dissolvendo
em água.
III. (F) A vitamina A possui um álcool primário.
Aula 12
06 B
I. (F) Por se tratarem de moléculas heteroatômicas simétricas, todas são apolares.
II. (V) A molécula BF3 deve ser plana, pois o elemento B
apresenta uma hibridização do tipo sp2.
III. (F) Apenas a molécula NH3 pode fazer ponte de hidrogênio.
07 C
Observando as constituições da questão, podemos observar que todos os carbonos possuem ligação dupla, logo,
todos são sp2.
2 | Pré-Universitário
60°
a
Polaridade molecular e ligações
intermoleculares
01 B
05 C
a) (F) A fórmula molecular é C18H29N.
b) (F) O número de átomos de carbono primário, secundário e terciário é, respectivamente, 2, 12 e 4.
c) (V) O número de átomos de carbono com hibridização
sp3, sp2 e sp é, respectivamente, 15, 2 e 1.
d) (F) O número de ligações pi (p) é igual a 3.
e) (F) Todos os átomos de carbono que possuem apenas
ligações simples possuem geometria tetraédrica.
0,136nm
Atividades para Sala
04 B
Podemos observar, na estrutura, que o tronco possui sete
ligações pi alternadas (conjugadas) e que, na ligação tripla,
apenas uma das ligações pi está no plano de conjugação.
60°
a
d = a + 0,136 + a
a
a
1
⇒ =
⇒ a = 0, 535
cos 60° =
0,107
2 0,107
d = 2 ⋅ 0, 535 + 0,136 = 0, 243nm
03 B
0,107nm
0,107nm
A primeira amina a ser separada é a trimetilamina, pois não
apresenta o grupo NH, logo não faz pontes de hidrogênio,
que são ligações muito intensas.
02 D
Tanto o etanol como a água possuem hidroxilas. A hidroxila (OH) é um grupo que faz ligações de hidrogênio ou
pontes de hidrogênio.
03 A
Das substâncias elencadas nas alternativas, a única com
caráter apolar e, portanto, capaz de dissolver a graxa é a
gasolina.
04 B
A característica presente nas substâncias tóxicas e alergênicas, que inviabiliza sua solubilização no óleo de mamona,
é a hidrofilia, ou seja, a capacidade de atrair compostos
polares (hidro = água; filia = afinidade). Como o óleo de
mamona é predominantemente apolar, os compostos alergênicos polares não se misturam ao óleo.
VOLUME 3 | QUÍMICA 3
Atividades Propostas
04 C
I. (V)Os compostos 1, 2, 3 e 4 são, respectivamente,
butano, metoxietano, propan-1-ol e ácido etanoico.
Butano: dipolo induzido - dipolo induzido.
Metoxietano: dipolo permanente - dipolo permanente.
Propan-1-ol: pontes de hidrogênio.
Ácido etanoico: pontes de hidrogênio em maior
quantidade.
II. (F) As moléculas do propan-1-ol, por apresentarem o
grupo hidroxila em sua estrutura, possuem interações moleculares menos fortes do que as moléculas do ácido etanoico.
III.(F)O composto orgânico propan-1-ol é um álcool
solúvel em água (solubilidade infinita), pois suas
moléculas fazem ligações predominantemente do
tipo pontes de hidrogênio.
IV.(V)
V. (F) O composto metoxietano é um éter que apresenta
em sua estrutura um átomo de oxigênio.
01 C
A uma mesma pressão, o butanol líquido entra em ebulição a uma temperatura mais alta do que o éter dietílico
líquido, pois o butanol faz ponte de hidrogênio, que é
uma ligação mais intensa do que o dipolo permanente
presente no éter dietílico.
(pares de elétrons
disponíveis para
as pontes)
02 A
A partir da análise das forças intermoleculares, lembrando
que HF faz pontes de hidrogênio, que são interações mais
intensas, e que quanto maior a “nuvem” eletrônica (ou
massa), maior a interação intermolecular para as moléculas
que não fazem pontes de hidrogênio, podemos concluir que:
Substância
Temperatura de
ebulição (°C)
HF
20
HI
–35
HBr
–67
HCl
–85
05 B
A temperatura de ebulição aumenta com a intensificação
das forças intermoleculares do tipo dipolo-induzido.
Quanto maior a cadeia carbônica, maior a força de atração
e, consequentemente, maior a temperatura de ebulição:
TE (eteno) < TE (propeno) <TE (but-1-eno) < TE (hept-1-eno).
06 D
03 B
Teremos:
Imiscíveis
Imiscíveis
(V)
Água (menor
densidade)
Ciclo-hexano (menor
densidade)
Clorofórmio (maior
densidade)
Água (maior densidade)
II
V
Observação: A solubilidade em água do clorofórmio é
baixa: 0,8g/100 mL a 20°C, por isso ocorre a formação de
mistura bifásica com a água.
07 A
(V)
(F)Se compararmos hidrocarbonetos de mesma massa
molar, os compostos de cadeia linear têm temperaturas
de fusão e de ebulição maiores que os de cadeia ramificada.
(V)
(V)
A trimetilamina não forma ligações de hidrogênio entre
suas moléculas, pois não tem átomo de hidrogênio diretamente ligado a nitrogênio, por isso, não faz ligação ou
ponte de hidrogênio.
Trimetilamina
08 E
Nas mesmas condições de pressão, uma substância no
estado líquido possui forças atrativas menores do que a
mesma substância no estado sólido.
Pré-Universitário | 3
VOLUME 3 | QUÍMICA 3
09 D
Teremos:
Substâncias
mais solúveis
Substâncias com
solubilidades
próximas ao
corante amarelo
marrom
laranja
verde
amarela
azul
cor do
confeito
vermelha
Substâncias
menos solúveis
2cm
10 A
a)(V)Correta, porém mal formulada. Por apresentar
cinco grupos hidroxilas, o corante morina faz ligação de hidrogênio com a água. As ligações de
hidrogênio são mais intensas do que as forças de
van der Waals. A temperatura de ebulição da solução aquosa é maior do que a do soluto puro.
b) (F) O composto mostrado na figura 1 apresenta a função fenol, enol, cetona e éter.
fenol
éter
fenol
enol
cetona
c) (F) O carbono da carbonila, no composto mostrado, e
os demais apresentam hibridização sp2.
d) (F) O composto apresenta 8 elétrons p e não possui
carbonos quirais.
e) (F) O composto mostrado apresenta isômeros geométricos, mas não possui carbonos quirais ou assimétricos.
4 | Pré-Universitário