QUÍMICA 2
Resoluções das atividades
Aula 1
b)
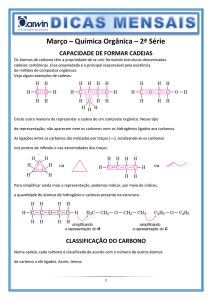
Introdução à Química Orgânica
sp2
sp2
Composto aromático e plano.
Atividades para sala
sp2
01 C
sp2
c)
a) (F) A estrutura possui carbonos primários e secundários.
b) (F) Para apresentar Nox –4, qualquer carbono na estrutura deveria estar ligado a 4 hidrogênios.
c) (V) A equilenina apresenta 6 ligações do tipo pi e em
cada ligação existem 2 elétrons pi, totalizando 12
elétrons pi.
d)(F)A substância possui carbonos trigonais planos
(com dupla ligação) e carbonos tetraédricos (com
somente ligações simples).
e) (F) A estrutura possui ligações sigma e pi.
sp2
sp2
Composto não aromático e
plano.
sp2
sp2
d)
Composto aromático e plano.
02 C
A classificação de cada carbono presente na estrutura está
indicada a seguir.
e)
P
P
S
Q
T
P
P
S
T
P
P
sp2
Carbono sp2:
P
Geometria: trigonal plana
Ângulos: 120º
03 B
Na estrutura do mirceno, encontram-se três ligações duplas,
nas quais está presente uma ligação do tipo pi. Como cada
ligação covalente é formada por dois elétrons, em três ligações pi existirão seis elétrons pi.
04 A
Atividades propostas
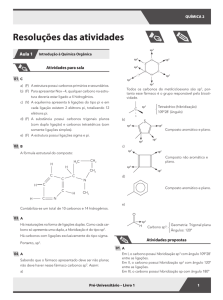
01 A
Sabendo que o fármaco apresentado deve ser não planar,
não deve haver nesse fármaco carbonos sp2.
a)
sp3
sp3
sp3
02 E
sp3
sp3
sp3
sp3
Todos os carbonos do metilcicloexano são sp3, portanto esse fármaco é o grupo responsável pela bioatividade.
sp3
Em I, o carbono possui hibridização sp3 com ângulo 109º28’
entre as ligações.
Em II, o carbono possui hibridização sp2 com ângulo 120º
entre as ligações.
Em III, o carbono possui hibridização sp com ângulo 180º
entre as ligações.
03 E
Tetraédrico (hibridização)
109º28' (ângulo)
A estrutura apresenta:
4 ligações p (8 elétrons p);
10 elétrons não ligantes nos oxigênios e no nitrogênio;
7 carbonos com dupla ligação (sp2);
1 carbono saturado no grupo CH3.
O carbono apresenta arranjo espacial tetraédrico quando
possui somente ligações simples.
Pré-Universitário – Livro 1
1
QUÍMICA 2
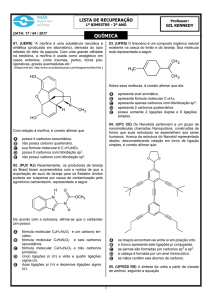
04 D
08 D
Os carbonos terciários estão circulados na estrutura expandida a seguir.
Benzeno:
C6H6
Naftaleno:
A fórmula molecular é C41H56O2, cuja massa molar é:
M(C) = 12 g/mol · 41 = 492
M(O) = 16 g/mol · 2 = 32
M(H) = 1 g/mol · 56 = 56
580 g/mol
C10H8
Antraceno:
05 A
a)(V)
b) (F) O composto II não possui ligações pi.
c) (F) O composto I possui cinco ligações sigma e uma
ligação pi.
d) (F) O composto I possui somente carbonos com hibridização sp2.
e) (F) O composto III possui carbonos de hibridização sp
e sp2.
C14H10
09 A
De acordo com a estrutura do Nanokid:
06 D
O
A fórmula expandida do AAS é:
Fórmula molecular: C8O2H7COOH
07 B
a) (F) Existem carbonos terciários e secundários.
b) (V) Existem 12 carbonos e 14 hidrogênios.
c) (F) Os carbonos 1 e 2 são terciários (possuem somente
ligações simples).
d) (F) Contém átomos de carbono secundário e terciário.
e) (F) Os carbonos da estrutura apresentam somente ligações simples e hibridações sp3.
2
O
É possível observar que as mãos possuem carbonos quaternários.
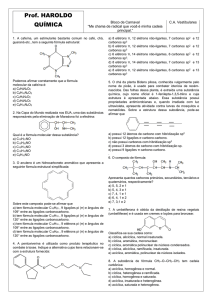
10 C
a) (F) A molécula não possui cadeia fechada com duplas
conjugadas que caracterizam a presença do anel
aromático.
b) (F) O composto possui 17 ligações sigma e 4 ligações
pi.
Pré-Universitário – Livro 1
QUÍMICA 2
c) (V)Todos os carbonos da estrutura possuem dupla
ligação, que caracterizam a hibridização sp2.
d)(F)Não existem grupos com carbono ligados às
cadeias fechadas da estrutura.
e) (F) Os heteroátomos nitrogênio e oxigênio possuem
um e dois pares não ligantes, respectivamente.
Pré-Universitário – Livro 1
3