Prova Integrada – 3º ano – Química – 2º bimestre
01. Dados os compostos:
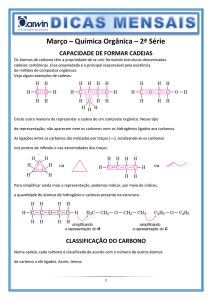
04. O carbono é capaz de fazer até quatro ligações e de
compor cadeias, o que permite a formação de uma infinidade
de compostos orgânicos, entre eles os hidrocarbonetos. Estes
fazem parte de um dos inúmeros grupos orgânicos e são
compostos exclusivamente de carbono e hidrogênio. Essa
função orgânica pode ser subdividida em alcanos, alcenos,
alcinos, alcadienos, ciclanos, ciclenos e aromáticos. Com base
no texto acima e em seus conhecimentos sobre química
orgânica, correlacione as duas colunas da tabela e assinale a
alternativa correta.
Assinale a alternativa em que aparece o nome da
função comum às duas estruturas:
a) Éster.
b) Aldeído.
c) Cetona.
d) Álcool.
e) Ácido carboxílico.
02. O gás dos pântanos, conhecido também como biogás, é
um dos responsáveis pelo efeito estufa. Ele é produzido pela
fermentação anaeróbica da celulose em pântanos e na
decomposição de materiais orgânicos encontrados em
depósitos de lixo e esgoto. Sua extração pode ser feita do
petróleo, da hulha e do gás natural. O biogás é incolor,
inodoro e o mais simples dos alcanos. Possui aplicação como
combustível e é utilizado na produção de hidrogênio. De
acordo com o texto, identifique o gás descrito acima.
a) meteno
b) etano
c) etino
d) propano
e) metano
03. As fragrâncias características dos perfumes são obtidas a
partir de óleos essenciais. Observe as estruturas químicas de
três substâncias comumente empregadas na produção de
perfumes:
O grupo funcional comum às três substâncias corresponde à
seguinte função orgânica:
a) éter.
b) álcool.
c) cetona.
d) aldeído.
e) ácido carboxílico.
a) 6-A; 2-B; 3-C; 7-D; 1-E; 4-F; 5-G
b) 3-A; 6-B; 2-C; 4-D; 1-E; 7-F; 5-G
c) 6-A; 3-B; 2-C; 4-D; 1-E; 5-F; 7-G
d) 3-A; 2-B; 6-C; 4-D; 1-E; 5-F; 7-G
e) 6-A; 2-B; 3-C; 7-D; 4-E; 1-F; 5-G
05. Uma pilha, formada pelos eletrodos de Fe/Fe+2 (uma
lâmina de ferro em contato com uma solução de íons Fe+2) e
Cu/Cu+2 (uma lâmina de cobre em contato com uma solução
de íons Cu+2), apresenta E0 pilha de 0,78 V. Sabendo-se que:
Cu+2 + 2é
Cu(s),
E0= 0,34 V e que a lâmina de ferro se dissolve, o potencialpadrão de redução do eletrodo Fe/Fe+2 é:
a) 0,44 V.
b) 1,12 V.
c) -0,44 V.
d) -1,22 V.
e) 0,56 V.
06. O escurecimento de objetos de prata, como baixelas e
talheres, é muito comum. Ao se cozinhar demasiadamente os
ovos, as proteínas da clara, que contêm átomos de enxofre,
liberam o ácido sulfídrico, que na forma gasosa e na presença
de oxigênio, na água de cozimento, pode levar à oxidação do
objeto de prata, com formação de uma fina camada insolúvel
de sulfeto de prata (Ag2S). O mesmo ocorre quando se
cozinham alimentos como o repolho, que contém compostos
sulfurados como a cisteína, estrutura representada na figura,
que sofre decomposição durante o cozimento, liberando o
H2S.
As principais reações envolvidas nesse fenômeno são
apresentadas nas equações:
A diferença de potencial (ddp) para a reação global que
representa o fenômeno do escurecimento dos objetos de
prata tem valor igual a:
a) –2,61 V.
b) –1,92 V.
c) +0,54 V.
d) +1,92 V.
e) +2,61 V.
07. A fermentação do lixo orgânico, entre outras substâncias,
produz gás metano, que ao sofrer combustão libera certa
quantidade de calor. Esta combustão é representada pela
equação química:
CH4 + 2 O2
CO2 + 2 H2O. Nesta equação podemos
observar que:
a) o carbono sofre redução.
b) a variação do Nox do carbono é igual a 4.
c) o oxigênio sofre oxidação.
d) no CO2 o carbono possui Nox igual a + 4.
e) o oxigênio se encontra em todas as substâncias com Nox
igual a – 2.
08. Nas indústrias de couro, encontram-se presentes alguns
agentes químicos potencialmente nocivos, dentre eles os
representados abaixo:
Os nomes oficiais desses compostos, na ordem dada, são:
a) benzeno, xileno e tolueno.
b) benzeno, tolueno e p-xileno.
c) toluol, benzil e fenol.
d) benzil, toluol e m-xileno.
e) benzeno, metilbenzeno e p-dimetil-benzeno.
09. Em relação à molécula do propeno são feitas as
afirmações:
( I ) Entre os átomos de carbono 1 e 2 existe uma ligação
sigma.
( II ) Entre os átomos de carbono 1 e 2 existe uma ligação pi.
( III) Entre os átomos de carbono 1 e 2 existem duas ligações
sigma.
( IV ) Entre os átomos de carbono 1 e 2 existem duas ligações
pi.
(V) Todas as ligações entre os átomos de carbono e hidrogênio
são ligações sigma.
Dentre as afirmações feitas estão corretas apenas:
a) I e II.
b) I e III.
c) I, II e IV.
d) I, III e V.
e) I, II e V.
10. A acetona (fórmula abaixo), um importante solvente
orgânico, apresenta nos seus carbonos, respectivamente, os
seguintes tipos de hibridizações:
a) sp, sp2 e sp3
b) sp3 , sp3 e sp3
c) sp2, sp e sp3
d) sp3, sp2 e sp3
e) sp3, sp2 e sp2