TAREFA DA SEMANA DE 29 DE ABRIL A 03 DE MAIO
FÍSICA – 3ª SÉRIE
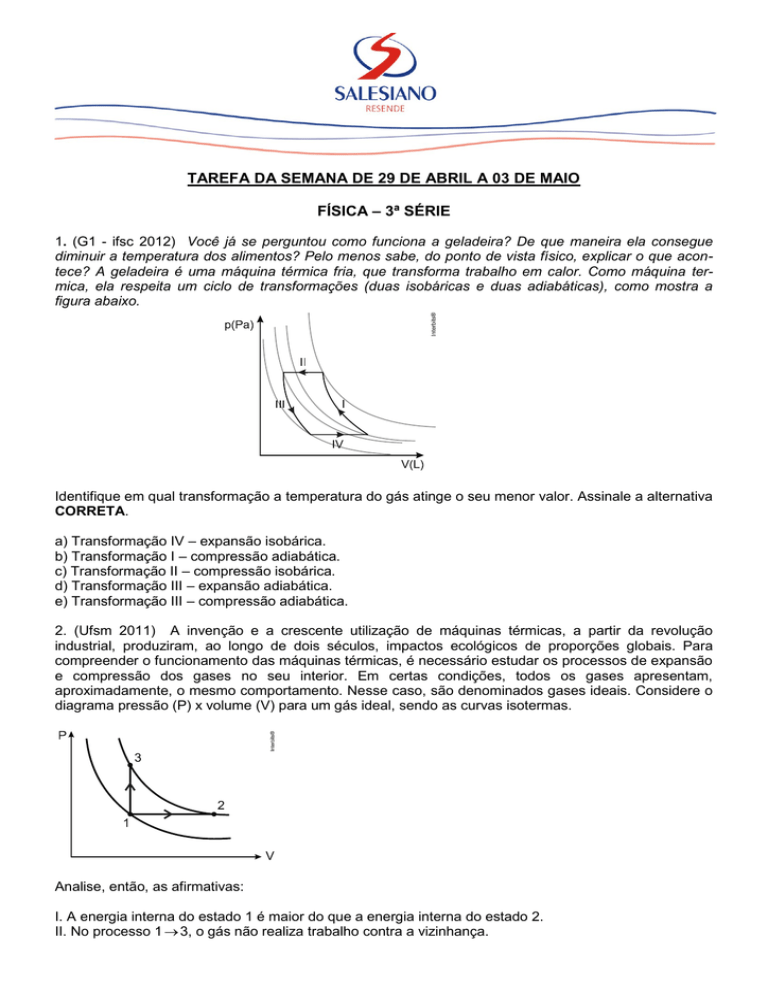
1. (G1 - ifsc 2012) Você já se perguntou como funciona a geladeira? De que maneira ela consegue
diminuir a temperatura dos alimentos? Pelo menos sabe, do ponto de vista físico, explicar o que acontece? A geladeira é uma máquina térmica fria, que transforma trabalho em calor. Como máquina termica, ela respeita um ciclo de transformações (duas isobáricas e duas adiabáticas), como mostra a
figura abaixo.
Identifique em qual transformação a temperatura do gás atinge o seu menor valor. Assinale a alternativa
CORRETA.
a) Transformação IV – expansão isobárica.
b) Transformação I – compressão adiabática.
c) Transformação II – compressão isobárica.
d) Transformação III – expansão adiabática.
e) Transformação III – compressão adiabática.
2. (Ufsm 2011) A invenção e a crescente utilização de máquinas térmicas, a partir da revolução
industrial, produziram, ao longo de dois séculos, impactos ecológicos de proporções globais. Para
compreender o funcionamento das máquinas térmicas, é necessário estudar os processos de expansão
e compressão dos gases no seu interior. Em certas condições, todos os gases apresentam,
aproximadamente, o mesmo comportamento. Nesse caso, são denominados gases ideais. Considere o
diagrama pressão (P) x volume (V) para um gás ideal, sendo as curvas isotermas.
Analise, então, as afirmativas:
I. A energia interna do estado 1 é maior do que a energia interna do estado 2.
II. No processo 1 3, o gás não realiza trabalho contra a vizinhança.
III. No processo 1 2, o gás recebe energia e também fornece energia para a vizinhança.
Está(ão) correta(s)
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas II e III.
e) I, II e III.
3. (Uece 2010) Pode-se afirmar corretamente que a energia interna de um sistema constituído por um
gás ideal
a) diminui em uma expansão isotérmica.
b) aumenta em uma expansão adiabática.
c) diminui em uma expansão livre.
d) aumenta em uma expansão isobárica.
e) NRA
4. (Fgvrj 2010) Ao realizar um trabalho de 80 mil calorias, um sistema termodinâmico recebeu 60 mil
calorias.
Pode-se afirmar que, nesse processo, a energia interna desse sistema
a) aumentou 20 mil calorias.
b) diminuiu 20 mil calorias.
c) aumentou 60 mil calorias.
d) diminuiu 80 mil calorias.
e) se conservou.
5. (Upe 2010) No diagrama PV, a seguir, está representada uma série de processos termodinâmicos.
No processo ab, 250 J de calor são fornecidos ao sistema, e, no processo bd, 600 J de calor são
fornecidos ao sistema.
Analise as afirmações que se seguem.
I. O trabalho realizado no processo ab é nulo.
II. A variação de energia interna no processo ab é 320 J.
III. A variação de energia interna no processo abd é 610 J.
IV. A variação de energia interna no processo acd é 560 J.
É CORRETO afirmar que apenas as(a) afirmações(ão)
a) II e IV estão corretas.
b) IV está correta.
c) I e III estão corretas.
d) III e IV estão corretas.
e) II e III estão corretas.
6. (Ufu 2010) Um botijão de cozinha contém gás sob alta pressão. Ao abrirmos esse botijão,
percebemos que o gás escapa rapidamente para a atmosfera. Como esse processo é muito rápido,
podemos considerá-lo como um processo adiabático.
Considerando que a primeira lei da termodinâmica é dada por ÄU = Q - W, onde ÄU é a variação da
energia interna do gás, Q é a energia transferida na forma de calor e W é o trabalho realizado pelo gás,
é correto afirmar que:
a) A pressão do gás aumentou e a temperatura diminuiu.
b) O trabalho realizado pelo gás foi positivo e a temperatura do gás não variou.
c) O trabalho realizado pelo gás foi positivo e a temperatura do gás diminuiu.
d) A pressão do gás aumentou e o trabalho realizado foi negativo.
e) NRA
7. (Upe 2010) O diagrama PV para uma determinada amostra de gás está representado na figura a
seguir. Se o sistema é levado do estado a para o estado b, ao longo do percurso acb, fornece-se a ele
uma quantidade de calor igual a 100 cal, e ele realiza um trabalho de 40 cal. Se, por meio do percurso
adb, o calor fornecido é de 72 cal, então o trabalho realizado vale em cal:
a) 28
b) 60
c) 12
d) 40
e) 24
8. (Ufv 2010) A figura a seguir ilustra um processo termodinâmico em um gás. Sabendo que durante o
processo ABC a variação da energia interna do gás foi igual a U e que o trabalho realizado pelo gás no
processo BC foi igual a W, então a quantidade de calor transferida ao gás no processo ABC foi:
a) U + VA (PA – PC) + W
b) U + PA (VB – VA) − W
c) U + VC (PA – PC) + W
d) U + PA (VB – VA) + W
e) NRA