Professora Florence Monteiro
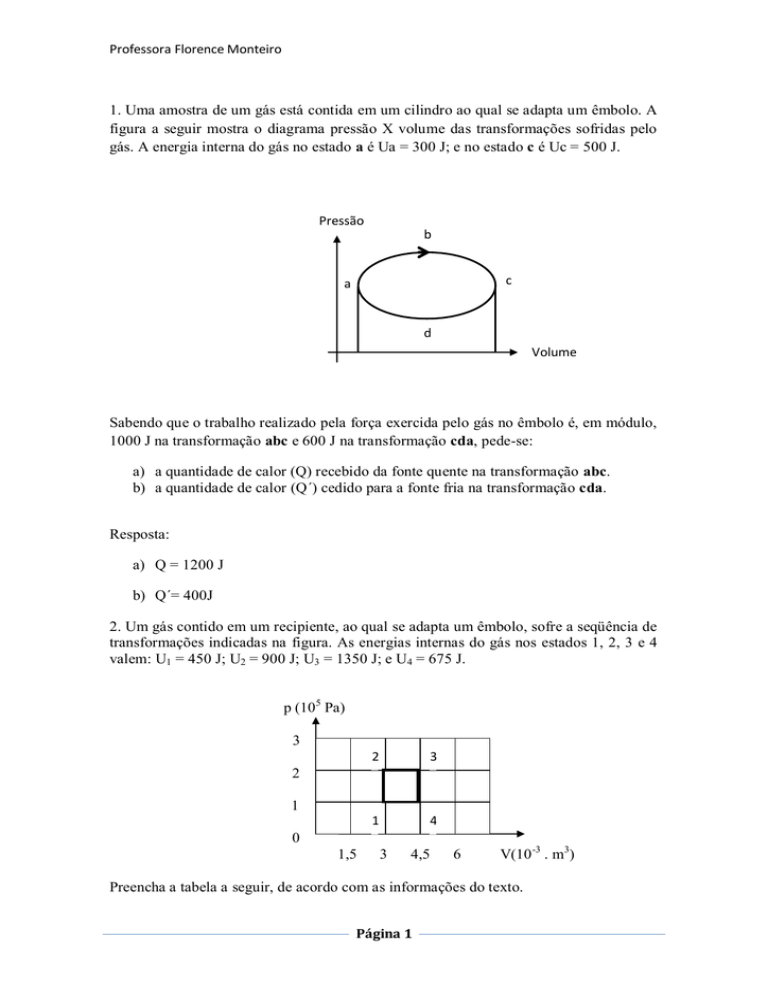
1. Uma amostra de um gás está contida em um cilindro ao qual se adapta um êmbolo. A
figura a seguir mostra o diagrama pressão X volume das transformações sofridas pelo
gás. A energia interna do gás no estado a é Ua = 300 J; e no estado c é Uc = 500 J.
Pressão
b
c
a
d
Volume
Sabendo que o trabalho realizado pela força exercida pelo gás no êmbolo é, em módulo,
1000 J na transformação abc e 600 J na transformação cda, pede-se:
a) a quantidade de calor (Q) recebido da fonte quente na transformação abc.
b) a quantidade de calor (Q´) cedido para a fonte fria na transformação cda.
Resposta:
a) Q = 1200 J
b) Q´= 400J
2. Um gás contido em um recipiente, ao qual se adapta um êmbolo, sofre a seqüência de
transformações indicadas na figura. As energias internas do gás nos estados 1, 2, 3 e 4
valem: U1 = 450 J; U2 = 900 J; U3 = 1350 J; e U4 = 675 J.
p (105 Pa)
3
2
3
1
4
2
1
0
1,5
3
4,5
6
V(10 -3 . m3)
Preencha a tabela a seguir, de acordo com as informações do texto.
Página 1
Professora Florence Monteiro
Transformação
Tipo
Expressão para
o cálculo
Substituições
numéricas
Resposta (J)
12
23
34
41
1 2 3 4
1
3. (UFOP-MG) Um gás perfeito descreve o ciclo ABCD como indica a figura.
Determine o trabalho que o sistema troca com o meio nas transformações:
a) AB
b) BC
p (N/m2)
c) CD
d) DA
e) ABCDA
A
B
3
2
1
C
D
V (m3)
1
2
Resposta:
a) T = 6,0 J
b) T = 0
c) T = - 2,0 J
d) T = 0
e) Tciclo = 4,0 J
Página 2
3
Professora Florence Monteiro
4. (UFBA) Uma certa massa de gás ideal sofre a transformação cíclica reversível
ABCA, conforme o diagrama de p X V apresentado na figura. Determine o trabalho
realizado em cada transformação.
p (105N/m2)
B
6
4
C
A
V (m3)
10
20
30
TAB = 0
TBC =1 x 10-7 J
TCA= - 8 x 106 J
5. Uma massa de gás ocupa volume de 4 litros sob pressão de 2 x 106 N/m2 . Após
receber 500 J de calor, mantendo constante a pressão, o volume passa a 10 litros.
Determine a variação de energia interna do gás.
Resposta:
- 11500 J
6. O gráfico a seguir mostra como varia a energia interna de um mol de oxigênio numa
transformação isométrica, quando a sua temperatura varia de 200 K a 300 K. Determine
a quantidade de calor absorvida pelo gás na transformação.
U (cal)
1500
1000
T (K)
200
300
Página 3
Professora Florence Monteiro
Resposta: Q = 500 cal
7. (Uem 2012) Sobre as transformações termodinâmicas que podem ocorrer com um
gás ideal confinado em um cilindro com pistão, assinale o que for correto.
01) Um gás ideal realiza trabalho ao se expandir, empurrando o pistão contra uma
pressão externa.
02) Em uma transformação adiabática ocorre troca de calor com a vizinhança.
04) A energia interna de uma amostra de gás ideal não varia, quando este sofre uma
transformação isovolumétrica.
08) Quando o gás ideal sofre uma compressão, o trabalho é realizado por um agente
externo sobre o gás ideal.
16) O gás ideal não realiza trabalho em uma transformação isovolumétrica.
Resposta:
01 + 08 + 16 = 25.
01) Correta. Devido à pressão, o gás exerce força sobre o êmbolo, empurrando o
pistão, realizando trabalho positivo.
02) Incorreta. Transformação adiabática é aquela em que o gás não troca calor com a
vizinhança.
04) Incorreta. A energia interna de um gás ideal depende exclusivamente da sua
temperatura absoluta. Portanto, somente não ocorre variação da energia interna,
quando a transformação é isotérmica.
08) Correta. Na compressão o gás recebe trabalho de um agente externo.
16) Correta. Se a transformação é isovolumétrica, não ocorre deslocamento do pistão,
não havendo realização de trabalho.
Página 4
Professora Florence Monteiro
8. (Unifesp 2011) Em um trocador de calor fechado por paredes diatérmicas,
inicialmente o gás monoatômico ideal é resfriado por um processo isocórico e depois
tem seu volume expandido por um processo isobárico, como mostra o diagrama pressão
versus volume.
a) Indique a variação da pressão e do volume no processo isocórico e no processo
isobárico e determine a relação entre a temperatura inicial, no estado termodinâmico
a, e final, no estado termodinâmico c, do gás monoatômico ideal.
b) Calcule a quantidade total de calor trocada em todo o processo termodinâmico abc.
Resposta:
a) No processo isocórico (volume constante) (a b):
Variação do volume: Δ Vab = Vb – Va = 0
Variação da pressão: Δ Pab = Pb – Pa = (1,0 – 3,0) 105 Δ Pab = –2,0 105 Pa.
No processo isobárico (pressão constante) (b c):
Variação do volume: Δ Vbc = Vc – Vb = (6,0 – 2,0) 10–2 Δ Vab = 4,0 10–2 m3.
Variação da pressão: Δ Pbc = Pc – P b = 0.
Aplicando a equação geral dos gases entre os estados a e c.
Pa Va Pc Vc
Ta
Tc
6 10 3
6 10 3
Ta
Tc
3 105 2 102 1 105 6 102
Ta
Tc
Ta Tc
Ta
1.
Tc
b) Sendo Q a quantidade de calor trocado, Δ U a variação da energia interna e W o
trabalho realizado entre dois estados, a 1ª lei da termodinâmica nos dá:
Q = Δ U + W.
Como mostrado no item anterior, a temperatura do gás nos estados a e c são iguais,
portanto a variação da energia interna entre esses dois estados é nula ( Δ Uac = 0).
Então:
Página 5
Professora Florence Monteiro
Qac = Wac = Wab + Wbc.
Mas a transformação ab é isocórica Wab = 0. Então:
Qac = Wbc = Pc (Vbc) = 1,0 105 4,0 10–2
Qac = 4,0 103 J.
9. (Epcar (Afa) 2011) O diagrama abaixo representa um ciclo realizado por um sistema
termodinâmico constituído por n mols de um gás ideal.
Sabendo-se que em cada segundo o sistema realiza 40 ciclos iguais a este, é correto
afirmar que a(o)
a) potência desse sistema é de 1600 W.
b) trabalho realizado em cada ciclo é - 40 J.
c) quantidade de calor trocada pelo gás com o ambiente em cada ciclo é nula.
d) temperatura do gás é menor no ponto C.
Resposta:
[A]
A frequência de operação é 40 ciclos/s, ou seja, 40 Hz. Notemos ainda que, no eixo das
abscissas o volume está em litro. (1 L = 10 –3 m3).
Calculando o trabalho (Wciclo) em cada ciclo. Como se trata de um ciclo no sentido
horário, o trabalho realizado é positivo, sendo numericamente igual á “área” interna do
ciclo.
Wciclo " Área" 0,6 0,2 2 1 105 103 Wciclo 40 J.
O trabalho total (W) em 40 ciclos é:
W 40 40 1.600 J.
Calculando a potência do sistema:
P
W 1.600 J
t
1s
P 1.600 W.
Página 6
Professora Florence Monteiro
10. (Ufpe 2011) Um gás ideal se transforma de acordo com o ciclo termodinâmico
mostrado abaixo no diagrama pressão versus volume. Os processos AB e CD são
isovolumétricos, e os processos BC e DA são isotérmicos. Qual a razão TC /TD entre as
respectivas temperaturas absolutas do gás nos pontos C e D?
Resposta:
A transformação AB é isométrica. Então, para os estados A e B:
pA pB
TA TB
0,5 2,5
TA
TB
TB
5.
TA
Como as transformações BC e DA são isotérmicas, TB TC e TD TA . Então:
TC TB
5.
TD TA
11. (Ufjf 2011) A figura abaixo mostra o diagrama P x V para o ciclo de um sistema
termodinâmico contendo um gás ideal monoatômico.
a) Calcule o trabalho total, em joules, realizado pelo gás no ciclo completo.
b) Calcule a variação da energia interna, em joules, no percurso AB.
c) Qual é a quantidade de calor, em joules, trocada pelo sistema no percurso AB?
Página 7
Professora Florence Monteiro
Resposta:
Dados: 1 atm 105 N/m2 .
a) O trabalho no ciclo é dado pela “área” do ciclo.
Wciclo 1 0,04 1 0,02 105 Wciclo 6.000 J.
b) Como se trata de uma transformação isobárica, a variação da energia interna pode ser
calculada pela expressão:
3
3
P VAB 3 105 0,04
2
2
UAB 18.000 J.
UAB
c) Aplicando a 1ª lei da termodinâmica para a transformação AB:
QAB WAB UAB P VAB 18.000 3 105 0,04 18.000 12.000 18.000
QAB 30.000 J.
12. (Ufg 2010) A máquina térmica é um dispositivo que pode tanto fornecer energia
para um sistema quanto retirar.
Considere que a máquina térmica opera com um gás ideal em um sistema fechado,
conforme o ciclo ilustrado acima. De acordo com o exposto,
a) calcule o trabalho total em ciclo;
b) explique como ela opera, ou seja, qual é a sua função? Justifique sua resposta;
c) calcule a temperatura no ponto C, considerando que a temperatura do ponto A é de
300 K.
Resposta:
a) Como o ciclo é anti-horário, o trabalho realizado é negativo e seu módulo é dado pela
área interna ao ciclo, que forma um trapézio.
Wciclo = -ATrap = –
(VB VA ) (VC VD )
(pD pA ) Wciclo = –
2
(3 1) (2,5 2)
(2 1) 105
2
Wciclo = -1,25 105 J.
Página 8
Professora Florence Monteiro
b) Como o trabalho é negativo, o sistema gasoso está recebendo trabalho, operando
como refrigerador.
c) Aplicando a equação geral dos gases ideais:
pC VC pA VA
TC
TA
TC
pC VC TA 2 105 2,5 300
pA VA
1 105 1
TC = 1.500 K.
13. (Uece 2010) No diagrama P-V a seguir, quatro processos termodinâmicos cíclicos
executados por um gás, com seus respectivos estados iniciais, estão representados. O
processo no qual o trabalho resultante, realizado pelo gás é menor é o
a) I.
b) J.
c) K.
d) L.
Resposta:
[C]
O trabalho (W) realizado numa transformação cíclica é numericamente igual à área
interna do ciclo. A área interna dos ciclos I, J e L corresponde à de 4 quadrículos. A
área do ciclo K é menor que a de 4 quadrículos.
Podemos também efetuar os cálculos:
WI = 1 4 = 4 J;
WJ = 2 2 = 4 J;
WK = 3,14 12 = 3,14 J;
WL = 2 2 = 4 J.
Página 9












